Afrikansk trypanosomiasis - African trypanosomiasis
| Afrikansk trypanosomiasis | |
|---|---|
| Andre navne | Sovesygdom, afrikansk sovesyge |
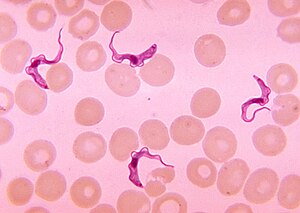 | |
| Trypanosoma dannes i en blodudtværing | |
| Specialitet | Smitsom sygdom |
| Symptomer |
Trin 1 : Feber, hovedpine, kløe, ledsmerter Trin 2 : Søvnproblemer , forvirring , dårlig koordination |
| Almindelig start | 1-3 uger efter eksponering |
| Typer | Trypanosoma brucei gambiense (TbG), Trypanosoma brucei rhodesiense (TbR) |
| Årsager | Trypanosoma brucei spredt af tsetsefluer |
| Diagnostisk metode | Blodudstrygning , lumbal punktering |
| Medicin | Fexinidazol , pentamidin , suramin , eflornithin , nifurtimox |
| Prognose | Fatal uden behandling |
| Frekvens | 977 (2018) |
| Dødsfald: Døde | 3.500 (2015) |
Afrikansk trypanosomiasis , også kendt som afrikansk sovesyge eller simpelthen sovesyge , er en insektbåren parasitisk infektion hos mennesker og andre dyr. Det er forårsaget af arten Trypanosoma brucei . Mennesker er inficeret af to typer, Trypanosoma brucei gambiense (TbG) og Trypanosoma brucei rhodesiense (TbR). TbG forårsager over 98% af de rapporterede tilfælde. Begge overføres normalt ved bid af en inficeret tsetseflue og er mest almindelige i landdistrikter.
I første omgang er sygdommens første fase præget af feber, hovedpine, kløe og ledsmerter, der begynder en til tre uger efter biddet. Uger til måneder senere begynder den anden fase med forvirring, dårlig koordination, følelsesløshed og søvnbesvær. Diagnose er ved at finde parasitten i et blodudstrygning eller i væsken i en lymfeknude. En lumbal punktering er ofte nødvendig for at fortælle forskellen mellem første og anden fase sygdom.
Forebyggelse af alvorlig sygdom indebærer screening af risikopopulation med blodprøver for TbG. Behandlingen er lettere, når sygdommen opdages tidligt, og inden neurologiske symptomer opstår. Behandlingen af det første trin har været med medicinen pentamidin eller suramin . Behandling af anden fase har involveret eflornithin eller en kombination af nifurtimox og eflornithine til TbG. Fexinidazol er en nyere behandling, der kan tages gennem munden i begge trin af TbG. Mens melarsoprol virker for begge typer, bruges det typisk kun til TbR på grund af alvorlige bivirkninger. Uden behandling resulterer sovende sygdom typisk i døden.
Sygdommen forekommer regelmæssigt i nogle regioner i Afrika syd for Sahara, hvor befolkningen risikerer at være omkring 70 millioner i 36 lande. Anslået 11.000 mennesker er i øjeblikket smittet med 2.800 nye infektioner i 2015. I 2018 var der 977 nye tilfælde. I 2015 forårsagede det omkring 3.500 dødsfald, ned fra 34.000 i 1990. Mere end 80% af disse tilfælde er i Den Demokratiske Republik Congo . Tre store udbrud er sket i nyere historie: et fra 1896 til 1906 primært i Uganda og Congo -bassinet og to i 1920 og 1970 i flere afrikanske lande. Det er klassificeret som en forsømt tropisk sygdom . Andre dyr, såsom køer, kan bære sygdommen og blive inficeret, i hvilket tilfælde den er kendt som Nagana eller animalsk trypanosomiasis .
tegn og symptomer
Afrikanske trypanosomiasis symptomer forekommer i to faser: det hæmolymfatiske stadium og det neurologiske stadie (sidstnævnte er karakteriseret ved parasitisk invasion af centralnervesystemet). Neurologiske symptomer opstår imidlertid ud over de indledende træk, og de to faser kan være svære at skelne ud fra kliniske træk alene.
Sygdommen er rapporteret at have atypiske symptomer hos inficerede personer, der stammer fra ikke-endemiske områder (f.eks. Rejsende). Årsagerne hertil er uklare og kan være genetiske. Det lave antal af sådanne tilfælde kan også have skæve fund. Hos sådanne personer siges infektionen hovedsageligt at være feber med gastrointestinale symptomer (f.eks. Diarré og gulsot), hvor lympadenopati kun udvikler sig sjældent.
Trypanosomal chancre
Systemisk sygdom foregår undertiden af en trypanosomal chancre, der udvikler sig på stedet for det infektiøse fluebid inden for 2 dage efter infektion. Chancre er mest almindeligt observeret i T. b. rhodesiense infektion, og kun sjældent i T. b. gambiense (dog i T. b. gambiense- infektion er chancers mere almindelige hos personer fra ikke-endemiske områder).
Hæmolymfatisk fase
Inkubationstiden er 1-3 uger for T. b. rhodesiense og længere (men mindre præcist karakteriseret) i T. b. gambiense infektion. Den første/indledende fase, kendt som den hæmolymfatiske fase, er kendetegnet ved uspecifikke, generaliserede symptomer som: feber (intermitterende) , hovedpine (svær), ledsmerter , kløe , svaghed, utilpashed, træthed, vægttab, lymfadenopati og hepatosplenomegali.
Diagnosen kan blive forsinket på grund af uklarheden i de første symptomer. Sygdommen kan også forveksles med malaria (som faktisk kan forekomme som en co-infektion).
Intermitterende feber
Feber er intermitterende, med angreb, der varer fra en dag til en uge, adskilt med intervaller på et par dage til en måned eller længere. Episoder med feber bliver mindre hyppige i løbet af sygdommen.
Lymfadenopati
Invasion af kredsløbet og lymfesystemet af parasitten er forbundet med alvorlig hævelse af lymfeknuder , ofte til enorme størrelser. Posterior cervikale lymfeknuder er mest almindeligt påvirket, men axillær, inguinal og epitrochlear lymfeknudeinddragelse kan også forekomme. Winterbottoms tegn , de fortællende hævede lymfeknuder langs nakken, kan forekomme. Winterbottoms tegn er almindeligt hos T. b. gambiense infektion.
Andre funktioner
De berørte kan desuden præsentere: hududslæt, hæmolytisk anæmi, hepatomegali og unormal leverfunktion, splenomegali, endokrine forstyrrelser, hjerteinvolvering (f.eks. Perikarditis og kongestivt hjertesvigt) og oftalmisk involvering.
Talrige pletter af blødning i benets hud hos en person, der er inficeret med T. b. rhodesiense
Neurologisk fase
Sygdomens anden fase, den neurologiske fase (også kaldet meningoencephalisk fase ), begynder, når parasitten invaderer centralnervesystemet ved at passere gennem blod -hjerne -barrieren . Fremgang til den neurologiske fase sker efter anslået 21-60 dage i tilfælde af T. b. rhodesiens e infektion, og 300–500 dage i tilfælde af T. b. gambiense infektion.
I virkeligheden overlapper de to faser og er vanskelige at skelne ud fra kliniske træk alene; bestemmelse af det faktiske stadie af sygdommen opnås ved at undersøge cerebrospinalvæsken for tilstedeværelsen af parasitten.
Søvnforstyrrelser
Søvn-vågne forstyrrelser er et ledende træk ved neurologisk stadium og gav sygdommen sit fælles navn afrikansk sovesyge . Inficerede personer oplever en uorganiseret og fragmenteret søvn-vågne-cyklus. De berørte oplever søvninversion, hvilket resulterer i søvn og søvnighed i dagtimerne og perioder med vågenhed og søvnløshed om natten. Derudover oplever de berørte også episoder med pludselig søvnighed.
Neurologiske/neurokognitive symptomer
Neurologiske symptomer omfatter: rysten , generel muskelsvaghed, hemiparese , lammelse af et lem, unormal muskeltonus, gangforstyrrelse, ataksi, taleforstyrrelser, paræstesi, hyperæstesi, anæstesi, synsforstyrrelse, unormale reflekser, anfald og koma. Parkinsonlignende bevægelser kan opstå på grund af uspecifikke bevægelsesforstyrrelser og taleforstyrrelser.
Psykiatriske/adfærdsmæssige symptomer
Enkeltpersoner kan udvise psykiatriske symptomer, som undertiden kan dominere den kliniske diagnose og kan omfatte aggressivitet, apati , irritabilitet, psykotiske reaktioner og hallucinationer , angst , følelsesmæssig labilitet , forvirring , mani , opmærksomhedsunderskud og delirium .
Avanceret/sen sygdom og resultater
Uden behandling er sygdommen altid dødelig, med progressiv mental forringelse, der fører til koma, systemisk organsvigt og død. En ubehandlet infektion med T. b. rhodesiense vil forårsage død inden for måneder, hvorimod en ubehandlet infektion med T. b. gambiense vil forårsage døden efter flere år. Skader forårsaget i den neurologiske fase er irreversible.
årsag
Trypanosoma brucei gambiense tegner sig for størstedelen af afrikanske trypanosomiasis -tilfælde, hvor mennesker er det vigtigste reservoir, der er nødvendigt for transmissionen, mens Trypanosoma brucei rhodesiense hovedsageligt er zoonotisk, med lejlighedsvis menneskelig infektion. Afrikansk trypanosomiasis er afhængig af parasitens (trypanosoms) vekselvirkning med tsetsefluerne (vektor) samt værten (menneske for Trypanosoma brucei gambiense og dyr for Trypanosoma brucei rhodesiense ). Risikoen for at pådrage sig afrikansk trypanosomiasis er afhængig af at komme i kontakt med en inficeret tsetseflue.
Trypanosoma brucei
Der er to underarter af parasitten, der er ansvarlige for at starte sygdommen hos mennesker. Trypanosoma brucei gambiense forårsager sygdommene i det vestlige og centrale Afrika , hvorimod Trypanosoma brucei rhodesiense har et begrænset geografisk område og er ansvarlig for at forårsage sygdommen i øst og det sydlige Afrika. Derudover er en tredje underart af parasitten kendt som Trypanosoma brucei brucei ansvarlig for at påvirke dyr, men ikke mennesker.
Mennesker er hovedreservoiret for T. b. gambiense, men denne art kan også findes hos svin og andre dyr. Vildtdyr og kvæg er hovedreservoiret for T. b. rhodesiense . Disse parasitter inficerer primært individer i Afrika syd for Sahara, fordi det er her vektoren (tsetse fly) er placeret. De to menneskelige former for sygdommen varierer også meget i intensitet. T. b. gambiense forårsager en kronisk tilstand, der kan forblive i en passiv fase i måneder eller år, før symptomer opstår, og infektionen kan vare cirka tre år, før døden indtræder.
T. b. rhodesiense er den akutte form for sygdommen, og døden kan forekomme inden for måneder, siden symptomerne dukker op inden for uger, og den er mere virulent og hurtigere at udvikle end T. b. gambiense . Endvidere er trypanosomer omgivet af en frakke, der er sammensat af variantoverfladeglycoproteiner (VSG). Disse proteiner virker for at beskytte parasitten mod alle lytiske faktorer, der er til stede i humant plasma. Værts immunsystem genkender de glykoproteiner, der findes på parasitens lag, hvilket fører til produktion af forskellige antistoffer (IgM og IgG).
Disse antistoffer vil derefter virke for at ødelægge parasitterne, der cirkulerer rundt om blodet. Fra de flere parasitter, der er til stede i plasmaet, vil et lille antal af dem dog opleve ændringer i deres overfladefrakker, hvilket resulterer i dannelsen af nye VSG'er. Således vil antistofferne produceret af immunsystemet ikke længere genkende parasitten, der fører til spredning, indtil nye antistoffer dannes for at bekæmpe de nye VSG'er. Til sidst vil immunsystemet ikke længere være i stand til at bekæmpe parasitten på grund af de konstante ændringer i VSG'er og infektion vil opstå.
Vektor
| Type | Trypanosoma | Fordeling | V ektor |
|---|---|---|---|
| Kronisk | T. brucei gambiense | Vestafrika |
G. palpalis
G. tachinoides G. morsitans |
| Spids | T. brucei rhodesiense | Østafrika |
G. morsitans
G. swynnertoni G. pallidipes G. fuscipes |
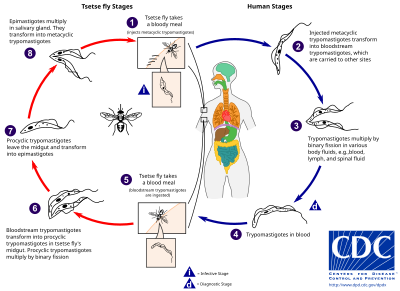
Den tsetsefluen (slægt Glossina ) er en stor, brun, bidende flue, fungerer både som vært og vektor for trypanosom parasitter. Mens man tager blod fra en pattedyrsvært, injicerer en inficeret tsetseflue metacykliske trypomastigoter i hudvæv. Fra biddet kommer parasitter først ind i lymfesystemet og passerer derefter ind i blodbanen. Inde i pattedyrsværten omdannes de til trypomastigoter i blodbanen og transporteres til andre steder i hele kroppen, når andre kropsvæsker (f.eks. Lymfe, spinalvæske) og fortsætter med at replikere ved binær fission .
Hele livscyklussen for afrikanske trypanosomer er repræsenteret af ekstracellulære stadier. En tsetseflue bliver inficeret med trypomastigoter i blodbanen, når man tager et blodmåltid på en inficeret pattedyrsvært. I fluens midterarm omdannes parasitterne til procykliske trypomastigoter, multipliceres med binær fission, forlader midtergutten og omdannes til epimastigoter. Epimastigoter når fluens spytkirtler og fortsætter multiplikation med binær fission.
Hele fluens livscyklus tager cirka tre uger. Ud over bidet fra tsetsefluen kan sygdommen overføres ved:
- Mor-til-barn-infektion: trypanosomet kan undertiden krydse placenta og inficere fosteret.
- Laboratorier: utilsigtede infektioner, f.eks. Ved håndtering af blod fra en inficeret person og organtransplantation, selvom dette er ualmindeligt.
- Blodtransfusion
- Seksuel kontakt (dette kan være muligt)
Hesteprangere fluer ( Tabanidae ) og stikfluer ( Muscidae ) eventuelt spille en rolle i transmissionen af nagana (dyret form af sovesyge) og den humane sygdom formular.
Patofysiologi
Tryptophol er en kemisk forbindelse, der produceres af den trypanosomale parasit ved sovesyge, som fremkalder søvn hos mennesker.
Diagnose

Guldstandarden for diagnose er identifikation af trypanosomer i en prøve ved mikroskopisk undersøgelse. Prøver, der kan bruges til diagnose, omfatter chancrevæske , lymfeknudeaspirater, blod, knoglemarv og under det neurologiske stadie cerebrospinalvæske . Påvisning af trypanosomspecifikke antistoffer kan bruges til diagnose, men følsomheden og specificiteten af disse metoder er for variable til at kunne bruges alene til klinisk diagnose. Endvidere serokonversion forekommer efter indtræden af kliniske symptomer i løbet af en T. b. rhodesiense infektion, så er af begrænset diagnostisk brug.
Trypanosomer kan påvises fra prøver ved hjælp af to forskellige præparater. Et vådt præparat kan bruges til at lede efter de bevægelige trypanosomer. Alternativt kan en fast (tørret) udstrygning farves ved hjælp af Giemsas eller Fields teknik og undersøges under et mikroskop. Ofte er parasitten relativt lav i prøven, så teknikker til at koncentrere parasitterne kan bruges før mikroskopisk undersøgelse. For blodprøver omfatter disse centrifugering efterfulgt af undersøgelse af buffy coat ; mini anion-udveksling/centrifugering; og den kvantitative buffy coat (QBC) teknik. For andre prøver, såsom spinalvæske, omfatter koncentrationsteknikker centrifugering efterfulgt af undersøgelse af sedimentet.
Tre serologiske test er også tilgængelige til påvisning af parasitten: micro-CATT (kortagglutinationstest for trypanosomiasis), wb-CATT og wb-LATEX. Den første bruger tørret blod, mens de to andre bruger fuldblodsprøver. En undersøgelse fra 2002 fandt, at wb-CATT var den mest effektive til diagnose, mens wb-LATEX er en bedre undersøgelse i situationer, hvor der kræves større følsomhed.
Forebyggelse
I øjeblikket er der få medicinsk relaterede forebyggelsesmuligheder for afrikansk trypanosomiasis (dvs. der findes ingen vaccine til immunitet). Selvom risikoen for infektion fra et tsetsefluebid er mindre (anslået til mindre end 0,1%), er brugen af insektafvisende midler, iført langærmet tøj, undgåelse af tsetse-tætte områder, implementering af bush-clearance-metoder og vildtvildning den bedste muligheder for at undgå infektion til rådighed for lokale beboere i berørte områder.
I juli 2000 blev der vedtaget en resolution om at danne Pan African Tsetse and Trypanosomiasis Eradication Campaign (PATTEC). Kampagnen arbejder på at udrydde tsetse-vektorpopulationerne og efterfølgende protozo-sygdommen ved brug af insekticidimprægnerede mål, fluefælder, insekticidbehandlet kvæg, ultralavdosis aerial/ground spraying (SAT) af tsetse-hvilesteder og det sterile insektteknik (SIT). Brugen af SIT i Zanzibar viste sig effektiv til at fjerne hele bestanden af tsetsefluer, men var dyr og er relativt upraktisk at bruge i mange af de endemiske lande, der er ramt af afrikansk trypanosomiasis.
Et pilotprogram i Senegal har reduceret tsetsefluebestanden med hele 99% ved at indføre hanfluer, der er blevet steriliseret ved udsættelse for gammastråler .
Regelmæssig aktiv overvågning, der involverer påvisning og hurtig behandling af nye infektioner, og tsetse fluebekæmpelse er rygraden i den strategi, der bruges til at kontrollere søvnsygdom. Systematisk screening af risikofællesskaber er den bedste fremgangsmåde, fordi screening fra sag til sag ikke er praktisk i endemiske regioner. Systematisk screening kan være i form af mobile klinikker eller faste screeningscentre, hvor hold dagligt rejser til områder med høje infektionshastigheder. En sådan screeningindsats er vigtig, fordi tidlige symptomer ikke er tydelige eller alvorlige nok til at berettige mennesker med gambiense sygdom til at søge lægehjælp, især i meget fjerntliggende områder. Diagnosen af sygdommen er også vanskelig, og sundhedsarbejdere kan ikke forbinde sådanne generelle symptomer med trypanosomiasis. Systematisk screening gør det muligt at opdage og behandle sygdomme på et tidligt stadie, før sygdommen skrider frem, og fjerne det potentielle humane reservoir. Et enkelt tilfælde af seksuel overførsel af vestafrikansk sovesyge er blevet rapporteret.
Behandling
Første etape
Behandlingen af sygdom i første fase er fexinidazol gennem munden eller pentamidin ved injektion til T. b. gambiense . Suramin ved injektion bruges til T. b. rhodesiense .
Anden etape
Fexinidazol kan bruges til anden fase af TbG, hvis sygdommen ikke er alvorlig. Ellers synes et regime, der involverer kombinationen af nifurtimox og eflornithin , nifurtimox-eflornithin kombinationsbehandling (NECT) eller eflornithine alene at være mere effektivt og resultere i færre bivirkninger. Disse behandlinger kan erstatte melarsoprol, når de er tilgængelige. NECT har fordelen ved at kræve færre injektioner af eflornithin.
Intravenøs melarsoprol var tidligere standardbehandling for anden fase (neurologisk fase) sygdom og er effektiv for begge typer. Melarsoprol er den eneste behandling for anden fase T. b. rhodesiense ; det forårsager dog død hos 5% af de mennesker, der tager det. Modstand mod melarsoprol kan forekomme.
Prognose
Hvis ubehandlet, T. b. gambiense resulterer næsten altid i dødsfald, med kun få individer vist i en langsigtet 15 års opfølgning at have overlevet efter at have nægtet behandling. T. b. rhodesiense , der er en mere akut og alvorlig form for sygdommen, er konsekvent dødelig, hvis den ikke behandles. Sygdomsprogression varierer meget afhængigt af sygdomsform. For personer, der er inficeret af T. b. gambiense , der tegner sig for 98% af alle de rapporterede tilfælde, kan en person være inficeret i måneder eller endda år uden tegn eller symptomer indtil det fremskredne sygdomsstadium, hvor det er for sent at blive behandlet med succes. For personer, der er berørt af T. b. rhodesiense , der tegner sig for 2% af alle rapporterede tilfælde, vises symptomer inden for uger eller måneder efter infektionen. Sygdomsfremgang er hurtig og invaderer centralnervesystemet og forårsager død inden for kort tid.
Epidemiologi

I 2010 forårsagede det omkring 9.000 dødsfald, ned fra 34.000 i 1990. Fra og med 2000 er de handicapjusterede leveår (9 til 10 år) tabt på grund af sovesyge 2,0 mio. Fra 2010–2014 var der anslået 55 millioner mennesker i risiko for gambiense afrikansk Trypanosomiasis og over 6 millioner mennesker i risiko for rhodesiense afrikansk trypanosomiasis. I 2014 rapporterede Verdenssundhedsorganisationen 3.797 tilfælde af menneskelig afrikansk trypanosomiasis, da det forudsagte antal tilfælde skulle være 5.000. Antallet af samlede rapporterede tilfælde i 2014 er en reduktion på 86% til det samlede antal tilfælde, der blev rapporteret i 2000.
Sygdommen er registreret som forekommende i 37 lande, alle i Afrika syd for Sahara. Det forekommer regelmæssigt i det sydøstlige Uganda og det vestlige Kenya og dræbte mere end 48.000 afrikanere i 2008. Den Demokratiske Republik Congo er det mest berørte land i verden og tegner sig for 75% af Trypanosoma brucei gambiense -tilfælde . Befolkningen i risiko er omkring 69 millioner, hvor en tredjedel af dette tal har en 'meget høj' til 'moderat' risiko, og de resterende to tredjedele har en 'lav' til 'meget lav' risiko. Antallet af mennesker, der bliver ramt af sygdommen, er faldet. Med denne hastighed er elimination af søvnsygdom en mulighed. Verdenssundhedsorganisationen planlægger at udrydde sovesyge i år 2030.
| Trypanosoma brucei gambiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Angola | 1498 | 2094 | 2406 | 1796 | 1274 | 2441 | 6726 | 8275 | 6610 | 5351 | 4546 | 4577 | 3621 | 3115 | 2280 | 1727 | 1105 | 648 | 517 | 247 | 211 | 154 | 70 | 69 | 36 | 35 | 19 | 18 | 79 | 30 |
| Benin | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Burkina Faso | 27 | 27 | 20 | 17 | 18 | 13 | 12 | 1 | 15 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| Cameroun | 86 | 69 | 21 | 3 | 20 | 21 | 17 | 10 | 54 | 32 | 27 | 14 | 32 | 33 | 17 | 3 | 15 | 7 | 13 | 24 | 16 | 15 | 7 | 6 | 7 | 6 | 6 | 5 | 7 | 17 |
| Den Centralafrikanske Republik | 308 | 197 | 362 | 262 | 368 | 676 | 492 | 730 | 1068 | 869 | 988 | 718 | 572 | 539 | 738 | 666 | 460 | 654 | 1194 | 1054 | 395 | 132 | 381 | 59 | 194 | 147 | 124 | 76 | 57 | 86 |
| Tchad | 20 | 221 | 149 | 65 | 214 | 315 | 178 | 122 | 134 | 187 | 153 | 138 | 715 | 222 | 483 | 190 | 276 | 97 | 196 | 510 | 232 | 276 | 197 | 195 | 95 | 67 | 53 | 28 | 12 | 16 |
| Congo | 580 | 703 | 727 | 829 | 418 | 475 | 474 | 142 | 201 | 91 | 111 | 894 | 1005 | 717 | 873 | 398 | 300 | 189 | 182 | 87 | 87 | 61 | 39 | 20 | 21 | 36 | 18 | 15 | 24 | 17 |
| Elfenbenskysten | 365 | 349 | 456 | 260 | 206 | 326 | 240 | 185 | 121 | 104 | 188 | 92 | 97 | 68 | 74 | 42 | 29 | 13 | 14 | 8 | 8 | 10 | 9 | 7 | 6 | 3 | 0 | 3 | 2 | 1 |
| Den Demokratiske Republik Congo | 7515 | 5825 | 7757 | 11384 | 19021 | 18182 | 19342 | 25094 | 26318 | 18684 | 16951 | 17300 | 13816 | 11459 | 10339 | 10249 | 8013 | 8155 | 7318 | 7178 | 5624 | 5590 | 5968 | 5647 | 3205 | 2351 | 1769 | 1110 | 660 | 604 |
| Ækvatorial Guinea | 63 | 36 | 45 | 30 | 85 | 37 | 46 | 67 | 62 | 28 | 16 | 17 | 32 | 23 | 22 | 17 | 13 | 15 | 11 | 7 | 8 | 1 | 2 | 3 | 0 | 0 | 3 | 4 | 4 | 3 |
| Gabon | 80 | 45 | 33 | 80 | 61 | 20 | 32 | 11 | 6 | 38 | 45 | 30 | 26 | 26 | 49 | 53 | 31 | 30 | 24 | 14 | 22 | 17 | 9 | 17 | 10 | 9 | 10 | 9 | 16 | 8 |
| Ghana | 3 | 6 | 16 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Guinea | 52 | 29 | 24 | 27 | 26 | 33 | 38 | 88 | 99 | 68 | 52 | 72 | 132 | 130 | 95 | 94 | 48 | 69 | 90 | 79 | 68 | 57 | 70 | 78 | 33 | 29 | 107 | 140 | 74 | 69 |
| Mali | 0 | 0 | 0 | 27 | 17 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Nigeria | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 27 | 14 | 14 | 26 | 31 | 10 | 21 | 3 | 0 | 0 | 0 | 2 | 3 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Sydsudan | 67 | 58 | 28 | 62 | 69 | 56 | 157 | 737 | 1726 | 1312 | 1801 | 1919 | 3121 | 3061 | 1742 | 1853 | 789 | 469 | 623 | 373 | 199 | 272 | 317 | 117 | 63 | 45 | 17 | 12 | 17 | 11 |
| At gå | 2 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Uganda | 2066 | 1328 | 2042 | 1764 | 1469 | 1062 | 981 | 1123 | 971 | 1036 | 948 | 310 | 604 | 517 | 378 | 311 | 290 | 120 | 198 | 99 | 101 | 44 | 20 | 9 | 9 | 4 | 4 | 0 | 1 | 2 |
| i alt | 12756 | 10987 | 14088 | 16607 | 23266 | 23671 | 28736 | 36585 | 37385 | 27862 | 25841 | 26095 | 23799 | 19941 | 17100 | 15624 | 11372 | 10466 | 10380 | 9680 | 6973 | 6632 | 7091 | 6228 | 3679 | 2733 | 2131 | 1420 | 953 | 864 |
| Trypanosoma brucei rhodesiense | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 |
| Kenya | 91 | 8 | 4 | 2 | 1 | 0 | 2 | 5 | 14 | 22 | 15 | 10 | 11 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Malawi | 228 | 195 | 143 | 53 | 31 | 15 | 8 | 7 | 10 | 11 | 35 | 38 | 43 | 70 | 48 | 41 | 58 | 50 | 49 | 39 | 29 | 23 | 18 | 35 | 32 | 30 | 37 | 7 | 15 | 91 |
| Mozambique | 3 | 7 | 24 | 10 | 16 | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | 1 | Ingen data | 1 | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data |
| Uganda | 1417 | 832 | 606 | 503 | 342 | 497 | 178 | 217 | 283 | 283 | 300 | 426 | 329 | 338 | 335 | 473 | 261 | 119 | 138 | 129 | 112 | 84 | 71 | 43 | 70 | 28 | 10 | 13 | 4 | 5 |
| Den Forenede Republik Tanzania | 187 | 177 | 366 | 262 | 319 | 422 | 400 | 354 | 299 | 288 | 350 | 277 | 228 | 113 | 159 | 186 | 127 | 126 | 59 | 14 | 5 | 1 | 4 | 1 | 1 | 2 | 3 | 3 | 0 | 3 |
| Zambia | 7 | Ingen data | 4 | 1 | 1 | 1 | 3 | Ingen data | Ingen data | 15 | 9 | 4 | 5 | 15 | 9 | 7 | 6 | 10 | 13 | 4 | 8 | 3 | 6 | 6 | 12 | 8 | 2 | 3 | 5 | 15 |
| Zimbabwe | Ingen data | Ingen data | Ingen data | Ingen data | 1 | Ingen data | Ingen data | 9 | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | Ingen data | 3 | Ingen data | Ingen data | 0 | 3 | 2 | 4 | 9 | 1 | 3 | 3 | 1 | 1 | 0 | 2 |
| i alt | 1933 | 1219 | 1147 | 831 | 710 | 935 | 591 | 583 | 606 | 619 | 709 | 755 | 617 | 536 | 552 | 707 | 453 | 305 | 259 | 187 | 154 | 111 | 101 | 85 | 115 | 68 | 52 | 27 | 24 | 116 |
Historie

Tilstanden har været til stede i Afrika i tusinder af år. På grund af manglende rejse mellem oprindelige mennesker havde sovesyge hos mennesker været begrænset til isolerede lommer. Dette ændrede sig efter arabiske slavehandlere kom ind i Centralafrika fra øst efter Congo -floden og bragte parasitter med. Gambisk sovesyge rejste op ad Congo -floden og derefter længere mod øst.
En arabisk forfatter fra 1300-tallet efterlod følgende beskrivelse for sultanen i Mali-riget: "Hans ende skulle overhales af den sovende sygdom ( illat an-nawm ), som er en sygdom, der ofte rammer indbyggerne i disse lande især deres høvdinge. Søvnen overhaler en af dem på en sådan måde, at det næppe er muligt at vække ham. "
Den britiske flådekirurg John Atkins beskrev sygdommen, da han vendte tilbage fra Vestafrika i 1734:
Den søvnige distemper (almindelig blandt negerne) giver ingen anden tidligere meddelelse end en mangel på appetit 2 eller 3 dage før; deres søvn er sund, og følelse og følelse meget lidt; for at trække, bedøve eller piske vil næppe røre Sans og Kraft nok til at bevæge sig; og det øjeblik, du holder op med at slå den smarte, er glemt, og nedad falder de igen i en tilstand af ufølsomhed, der konstant driver fra munden som i dyb salivation; træk vejret langsomt, men ikke ulige eller snorke. Unge mennesker er mere underlagt det end de gamle; og dommen generelt udtalt er Døden, Prognostikken fejler sjældent. Hvis nu og da en af dem kommer sig, mister han helt sikkert den lille grund, han havde, og vender Ideot ...
Den franske marinekirurg Marie-Théophile Griffon du Bellay behandlede og beskrev sager, mens han var stationeret ombord på hospitalsskibet Caravane i Gabon i slutningen af 1860'erne.
I 1901 udbrød en ødelæggende epidemi i Uganda og dræbte mere end 250.000 mennesker, herunder omkring to tredjedele af befolkningen i de berørte søområder. Ifølge The Cambridge History of Africa , "har man anslået, at op mod halvdelen af befolkningen døde af sove-sygdom og kopper i landene på begge bredder af den nedre flod Congo ."
Årsagsmiddel og vektor blev identificeret i 1903 af David Bruce , og protozoernes underarter blev differentieret i 1910. Bruce havde tidligere vist, at T. brucei var årsag til en lignende sygdom hos heste og kvæg, der blev overført af tsetsefluen ( Glossina morsitans ).
Den første effektive behandling, atoxyl , en arsen baseret stof udviklet af Paul Ehrlich og Kiyoshi Shiga , blev introduceret i 1910, men blindhed var en alvorlig bivirkning.
Suramin blev først syntetiseret af Oskar Dressel og Richard Kothe i 1916 for Bayer . Det blev introduceret i 1920 for at behandle den første fase af sygdommen. I 1922 blev Suramin generelt kombineret med tryparsamid (et andet femværdigt organoarsenisk lægemiddel), det første lægemiddel, der kom ind i nervesystemet og var nyttigt i behandlingen af den anden fase af gambiense -formen. Tryparsamid blev annonceret i Journal of Experimental Medicine i 1919 og testet i Belgisk Congo af Louise Pearce fra Rockefeller Institute i 1920. Det blev brugt under den store epidemi i Vest- og Centralafrika på millioner af mennesker og var grundlaget for terapien indtil 1960'erne. Den amerikanske medicinske missionær Arthur Lewis Piper var aktiv i at bruge tryparsamid til behandling af sovende sygdom i Belgisk Congo i 1925.
Pentamidin , et yderst effektivt lægemiddel til den første fase af sygdommen, har været brugt siden 1937. I løbet af 1950'erne blev det i vid udstrækning brugt som et profylaktisk middel i det vestlige Afrika, hvilket førte til et kraftigt fald i infektionshastigheder. På det tidspunkt mente man at udrydde sygdommen.
Den organoarseniske melarsoprol (Arsobal), der blev udviklet i 1940'erne, er effektiv for mennesker med anden etages sovesyge. 3-10% af de injicerede har imidlertid reaktiv encefalopati (kramper, progressiv koma eller psykotiske reaktioner), og 10-70% af sådanne tilfælde resulterer i dødsfald; det kan forårsage hjerneskade hos dem, der overlever encephalopati. På grund af dets effektivitet bruges melarsoprol stadig i dag. Modstanden mod melarsoprol stiger, og kombinationsbehandling med nifurtimox er i øjeblikket under forskning.
Eflornithine (difluoromethylornithine eller DFMO), den mest moderne behandling, blev udviklet i 1970'erne af Albert Sjoerdsma og gennemgik kliniske forsøg i 1980'erne. Lægemidlet blev godkendt af United States Food and Drug Administration i 1990. Aventis , det ansvarlige selskab for dets fremstilling, stoppede produktionen i 1999. I 2001 underskrev Aventis i samarbejde med Læger uden Grænser og Verdenssundhedsorganisationen en lang- tidsaftale om fremstilling og donering af stoffet.
Ud over sovesyge har tidligere navne inkluderet negro sløvhed, maladie du sommeil (Fr), Schlafkrankheit (Ger), afrikansk sløvhed og Congo trypanosomiasis.
- Den britisk ledede sovende sygdomskommission indsamler tsetsefluer, Uganda og Nyasaland , 1908-1913
Forskning
Parasitens genom er blevet sekventeret, og flere proteiner er blevet identificeret som potentielle mål for lægemiddelbehandling. Analyse af genomet afslørede også årsagen til, at det har været så svært at generere en vaccine til denne sygdom. T. brucei har over 800 gener, der gør proteiner til parasitten "blander og matcher" for at undgå detektering af immunsystemet.
Brug af en genetisk modificeret form af en bakterie, der forekommer naturligt i tarmene i vektorer, undersøges som en metode til bekæmpelse af sygdommen.
Nylige fund tyder på, at parasitten ikke er i stand til at overleve i blodbanen uden dens flagellum . Denne indsigt giver forskere en ny vinkel at angribe parasitten med.
Trypanosomiasis -vacciner er under undersøgelse.
Derudover har Drugs for Neglected Disease Initiative bidraget til forskning i afrikansk sovesygdom ved at udvikle en forbindelse kaldet fexinidazol . Dette projekt blev oprindeligt startet i april 2007 og registrerede 749 mennesker i Den Demokratiske Republik Congo og Den Centralafrikanske Republik . Resultaterne viste effekt og sikkerhed i begge stadier af sygdommen, både hos voksne og børn ≥ 6 år og med en vægt på ≥ 20 kg. Det Europæiske Lægemiddelagentur godkendte det for første og anden fase sygdom uden for Europa i november 2018. Behandlingen blev godkendt i Den Demokratiske Republik Congo i december 2018.
Finansiering
For nuværende finansieringsstatistik er human afrikansk trypanosomiasis grupperet med kinetoplastidinfektioner. Kinetoplastider refererer til en gruppe flagellaterede protozoer. Kinetoplastid -infektioner omfatter afrikansk sovesyge, Chagas 'sygdom og Leishmaniasis. Tilsammen udgjorde disse tre sygdomme 4,4 millioner handicapjusterede leveår (DALY'er) og yderligere 70.075 registrerede dødsfald årligt. For kinetoplastidinfektioner var den samlede globale forsknings- og udviklingsfinansiering på ca. , Henholdsvis 38,7 millioner dollars og 31,7 millioner dollars.
Til sovesyge blev finansieringen opdelt i grundforskning, opdagelse af lægemidler, vacciner og diagnostik. Det største beløb var rettet mod grundforskning af sygdommen; cirka 21,6 millioner dollars blev rettet mod denne indsats. Hvad angår terapeutisk udvikling, blev der investeret cirka $ 10,9 millioner.
Den øverste finansierer for forskning og udvikling af kinetoplastidinfektion er offentlige kilder. Cirka 62% af finansieringen kommer fra højindkomstlande, mens 9% kommer fra lav- og mellemindkomstlande. Højindkomstlandes offentlige midler er den største bidragyder til den forsømte sygdomsforskningsindsats. I de senere år har finansiering fra højindkomstlande imidlertid været støt faldende; i 2007 ydede højindkomstlande 67,5% af den samlede finansiering, mens højindkomstlande i 2012 kun ydede 60% af den samlede finansiering til kinetoplastidinfektioner i 2012. Denne nedadgående tendens efterlader et hul for andre finansierere, såsom filantropiske fonde og private farmaceutiske virksomheder at udfylde.
Meget af de fremskridt, der er gjort inden for afrikansk sovesyge og forsømt forskning i forskning som helhed, er et resultat af de andre ikke-offentlige finansiører. En af disse store finansieringskilder er kommet fra fonde, der i stigende grad er blevet mere engageret i at ignorere sygdomsmedicinsk opdagelse i det 21. århundrede. I 2012 leverede filantropiske kilder 15,9% af den samlede finansiering. Bill and Melinda Gates Foundation har været førende inden for finansiering af forsømt sygdomsudvikling. De har ydet $ 444,1 millioner amerikanske dollars til forsømt forskning i sygdom i 2012. Hidtil har de doneret over $ 1,02 milliarder amerikanske dollars til den forsømte indsats for at opdage sygdom.
Specielt for kinetoplastid-infektioner har de doneret i gennemsnit 28,15 millioner dollars årligt mellem årene 2007 til 2011. De har mærket human afrikansk trypanosomiasis som et mål med stor mulighed, hvilket betyder, at det er en sygdom, der giver størst mulighed for kontrol, eliminering og udryddelse gennem udvikling af nye lægemidler, vacciner, folkesundhedsprogrammer og diagnostik. De er den næsthøjeste finansieringskilde til forsømte sygdomme, umiddelbart bag US National Institutes of Health. I en tid, hvor offentlige midler falder, og offentlige tilskud til videnskabelig forskning er sværere at opnå, har den filantropiske verden trådt til for at skubbe forskningen fremad.
En anden vigtig komponent i øget interesse og finansiering er kommet fra industrien. I 2012 bidrog de med 13,1% i alt til kinetoplastidens forsknings- og udviklingsindsats og har desuden spillet en vigtig rolle ved at bidrage til offentlig-private partnerskaber (OPP) samt produktudviklingspartnerskaber (PDP). Et offentligt-privat partnerskab er et arrangement mellem en eller flere offentlige enheder og en eller flere private enheder, der eksisterer for at opnå et specifikt sundhedsresultat eller for at producere et sundhedsprodukt. Partnerskabet kan eksistere på mange måder; de kan dele og udveksle midler, ejendom, udstyr, menneskelige ressourcer og intellektuel ejendomsret. Disse offentlig-private partnerskaber og produktudviklingspartnerskaber er blevet etableret for at løse udfordringer i medicinalindustrien, især relateret til forsømt sygdomsforskning. Disse partnerskaber kan bidrage til at øge omfanget af indsatsen mod terapeutisk udvikling ved at bruge forskellig viden, færdigheder og ekspertise fra forskellige kilder. Disse former for partnerskaber har vist sig at være mere effektive end industrien eller offentlige grupper, der arbejder uafhængigt.
Andre dyr og reservoir
Trypanosoma af både rhodesiense og gambiense typer kan påvirke andre dyr såsom kvæg og vilde dyr. Afrikansk trypanosomiasis er generelt blevet betragtet som en antroponotisk sygdom, og derfor var dets kontrolprogram hovedsageligt fokuseret på at stoppe transmissionen ved at behandle menneskelige tilfælde og eliminere vektoren. Imidlertid blev der rapporteret om, at dyrereservoirer muligvis spillede en vigtig rolle i den endemiske karakter af afrikansk trypanosomiasis og for dens genopblussen i de historiske fokusområder i Vest- og Centralafrika.
Referencer
eksterne links
| Scholia har et emne profil for afrikansk sovesyge . |
- "En læge drøm" . stories.dndi.org . Hentet 14. maj 2020 .
- "Sovesyge" . Læger uden grænser . Arkiveret fra originalen den 23. oktober 2013.
- Links til billeder af sovende sygdom (Hardin MD/ University of Iowa )
- Hale Carpenter G (1920). En naturforsker ved Victoriasøen, med en beretning om sovende sygdom og Tse-tse Fluen . Afvind. OCLC 2649363 .
| Klassifikation | |
|---|---|
| Eksterne ressourcer |