Alveolær makrofag - Alveolar macrophage

En alveolær makrofag , lungemakrofag , (eller støvcelle ) er en type makrofag , en professionel fagocyt , der findes i luftvejene og på niveauet af alveolerne i lungerne , men adskilt fra deres vægge.
Aktiviteten af den alveolære makrofag er relativt høj, fordi de er placeret ved en af de store grænser mellem kroppen og omverdenen. De er ansvarlige for at fjerne partikler som støv eller mikroorganismer fra luftvejene.
Alveolære makrofager ses ofte at indeholde granuler af eksogent materiale, såsom partikelformigt kulstof, som de har opsamlet fra åndedrætsoverflader. Sådanne sorte granulater kan være særlig almindelige i rygerlunger eller langsigtede byboere.
Den alveolære makrofag er den tredje celletype i alveolen, de andre er pneumocytter af type I og type II .
Sammenligning af pigmenterede lungemakrofager
| Sygdom | Makrofag navn | Makrofagpigmentudseende (HE -plet) | Almindelig makrofagplacering | Tilhørende sygehistorie | Billede | Billedkommentar |
|---|---|---|---|---|---|---|
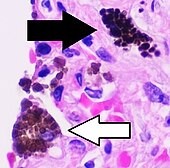
| Antracose | Sortbrune granulater | Interstitium (perivaskulær) |
|
|
Sort pil viser interstitiel antrakotisk pigment. Makrofager i nærheden (hvid pil) kan formodes at indeholde antrakotisk pigment. | |
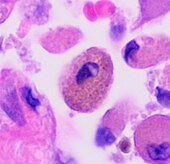
| Respiratorisk bronkiolitis | "Rygerens makrofager" | Gul til lysebrun og fint granuleret | Luftveje (især respiratoriske bronkioler) | Tobaksrygning |
|
Rygerens makrofag i midten |
| Kronisk lungestop | Siderophages | Brun-gylden og brydbar. | Alveoler |
|

|
Siderophage (sort pil) og interstitium med ødem, hæmosiderinaflejring (sort pil) og kollagen fortykning, hvilket indikerer hjertesvigt. |

Fungere


Alveolære makrofager er fagocytter, der spiller en afgørende rolle i homeostase, værtsforsvar og omdannelse af væv. Deres befolkningstæthed er afgørende for disse mange processer. De er meget adaptive og kan frigive mange sekreter for at interagere med andre celler og molekyler ved hjælp af flere overfladereceptorer . Alveolære makrofager er også involveret i fagocytose af apoptotiske og nekrotiske celler. De skal være selektive for det materiale, der phagocytiseres for at beskytte de normale celler og strukturer. For at bekæmpe infektion letter fagocytterne mange mønstergenkendelsesreceptorer (PRR'er) for at hjælpe med at genkende patogenassocierede molekylære mønstre (PAMP'er) på overfladen af patogene mikroorganismer. PAMP'er har alle de fælles træk ved at være unikke for en gruppe patogener, men uforanderlige i deres grundstruktur; og er afgørende for patogenicitet (en organismes evne til at producere en infektionssygdom i en anden organisme). Proteiner involveret i mikrobiel mønstergenkendelse omfatter mannose-receptor, komplementreceptorer, DC-SIGN, Toll-lignende receptorer (TLR'er), scavenger-receptoren, CD14 og Mac-1. PRR'er kan opdeles i tre klasser:
- signalering af PRR'er, der aktiverer gentranskriptionelle mekanismer, der fører til cellulær aktivering,
- endocytiske PRR'er, der fungerer ved patogenbinding og fagocytose, og
- udskilles PRR'er, der normalt fungerer som opsoniner eller aktivatorer af komplement.
Anerkendelse og clearance af invaderende mikroorganismer sker gennem både opsonin-afhængige og opsonin-uafhængige veje. De molekylære mekanismer, der letter opsonin-afhængig fagocytose, er forskellige for specifikke opsonin/receptorpar. For eksempel forekommer fagocytose af IgG-opsoniserede patogener gennem Fcy-receptorerne (FcγR) og involverer fagocytudvidelser omkring mikroben, hvilket resulterer i produktion af proinflammatoriske mediatorer. Omvendt sker komplementreceptormedieret patogenindtagelse uden observerbare membranforlængelser (partikler synker bare ned i cellen) og resulterer generelt ikke i et inflammatorisk mediatorrespons.
Efter internalisering er mikroben omsluttet af et vesikulært fagosom, som derefter gennemgår fusion med primære eller sekundære lysosomer og danner et fagolysosom. Der er forskellige mekanismer, der fører til intracellulært drab; der er oxidative processer og andre uafhængige af det oxidative stofskifte. Førstnævnte involverer aktivering af membranenzymsystemer, der fører til en stimulering af iltoptagelse (kendt som åndedrætsudbrud) og dets reduktion til reaktive iltmellemprodukter (ROI'er), molekylære arter, der er meget giftige for mikroorganismer. Enzymet, der er ansvarligt for fremkaldelse af åndedrætsudbrud, er kendt som nicotinamid -adenindinucleotidphosphat (NADPH) oxidase, som består af fem underenheder. En komponent er et membrancytokrom, der består af to proteinunderenheder, gp91phox og p22phox; de resterende tre komponenter er cytosolisk afledte proteiner: p40phox, p47phox og p67phox. NADPH -oxidase findes i cytosolen i AM, når den er i hviletilstand; men ved aktivering har to af dets cytosoliske komponenter, p47phox og p67phox, deres tyrosin- og serinrester phosphoryleret, som derefter er i stand til at formidle translokation af NADPHox til cytokromkomponenten, gp91phox/p22phox, på plasmamembranen via cytoskeletale elementer.
Sammenlignet med andre fagocytter er åndedrætsudbruddet i AM af en større størrelse. Oxygen-uafhængige mikrobicidmekanismer er baseret på produktion af syre, på udskillelse af lysozymer, på jernbindende proteiner og på syntesen af toksiske kationiske polypeptider. Makrofager besidder et repertoire af antimikrobielle molekyler pakket i deres granulater og lysosomer. Disse organeller indeholder et utal af nedbrydende enzymer og antimikrobielle peptider, der frigives til fagolysosomet, såsom proteaser, nukleaser, phosphataser, esteraser, lipaser og meget basiske peptider. Desuden besidder makrofager en række næringsstofberøvelsesmekanismer, der bruges til at sulte fagocytoserede patogener fra essentielle mikronæringsstoffer. Visse mikroorganismer har udviklet modforanstaltninger, der gør dem i stand til at undgå at blive ødelagt af fagocytter. Selvom lysosommedieret nedbrydning er et effektivt middel til at neutralisere en infektion og forhindre kolonisering, parasiterer flere patogener makrofager og udnytter dem som værtscelle til vækst, vedligeholdelse og replikation. Parasitter som Toxoplasma gondii og mycobacteria er i stand til at forhindre fusion af fagosomer med lysosomer og undslipper dermed den skadelige virkning af lysosomale hydrolaser. Andre undgår lysosomer ved at forlade den fagocytiske vakuol for at nå den cytosoliske matrix, hvor deres udvikling er uhindret. I disse tilfælde kan makrofager udløses til aktivt at ødelægge fagocytoserede mikroorganismer ved at producere et antal meget toksiske molekyler og forårsage afsavnsmekanisme til at sulte det. Endelig har nogle mikrober enzymer til at afgifte iltmetabolitter dannet under åndedrætsudbruddet.
Når det ikke er tilstrækkeligt til at afværge truslen, kan alveolære makrofager frigive proinflammatoriske cytokiner og kemokiner til at fremkalde et højt udviklet netværk af defensive fagocytiske celler, der er ansvarlige for det adaptive immunrespons.
Lungerne er særligt følsomme og tilbøjelige til at beskadige, og for at undgå kollateral skade på type 1 og type II pneumocytter opbevares alveolære makrofager i hviletilstand, producerer små inflammatoriske cytokiner og udviser lidt fagocytisk aktivitet, hvilket fremgår af nedreguleret ekspression af fagocytiske receptor Macrophage 1 antigen (Mac-1). AM undertrykker aktivt induktionen af to af kroppens immunitetssystemer: den adaptive immunitet og humorale immunitet. Den adaptive immunitet undertrykkes gennem AM's virkninger på interstitielle dendritiske celler, B-celler og T-celler, da disse celler er mindre selektive for, hvad de ødelægger og ofte forårsager unødvendig skade på normale celler. For at forhindre ukontrolleret betændelse i de nedre luftveje udskiller alveolære makrofager nitrogenoxid, prostaglandiner, interleukin-4 og -10 (IL-4, IL-10) og transformerende vækstfaktor-β (TGF-β).
Signalmolekylers rolle
Nitrogenoxid
NO er en vigtig kilde til immunmodulering hos gnavere og produceres af enzym nitrogenoxid syntetase type 2 (NOS2) i den alveolære makrofag. NO hæmmer tyrosinfosforylering af kinaserne involveret i produktionen af interleukin-2 (IL-2) -receptoren, hvis ekspression er grundlæggende for T-celleproliferation. Hos mennesker har NOS2 -aktivitet imidlertid været vanskelig at verificere.
Der er to forklaringer på den manglende reaktionsevne hos promotoren for human inducerbar nitrogenoxidsyntetase (iNOS) over for NO -aktivering af lipopolysaccharider (LPS) + interferon gamma (IFNy). Den første er, at der er forskellige inaktiverende nukleotidvariationer i det humane modstykke til forstærkerelementet, der regulerer LPS/IFNy -induceret ekspression af musens NOS2 -gen. Den anden er på grund af fraværet af en nuklear faktor i humane makrofager, der er nødvendig for optimal ekspression af gen NOS2 (LPS-inducerbar nuklear faktor-kappa B/Rel-kompleks). Det antages, at vanskeligheden ved at verificere NOS2 skyldes et meget mere tæt kontrolleret udtryk i humane AM'er sammenlignet med det i gnavere AM'er. NOS2 er en del af en autoregulatorisk feedback-loop, hvor et allergen eller provoker stimulerer inflammatorisk cytokinproduktion, som igen stimulerer NO-produktion, og NO nedregulerer cytokinproduktion. Hos rotter hæmmer NO granulocyt-makrofag-kolonistimulerende faktor (GM-CSF) -medieret modning af dendritiske celler, og hos mennesker hæmmer det TNF-alfa-medieret modning af humane dendritiske celler gennem cykliske GMP-afhængige mekanismer. NO forlænger humane dendritiske cellers evne til at internalisere antigener på inflammationssteder og modulerer derfor begyndelsestrinene, der fører til antigenspecifikke immunresponser.
INGEN produktion er blevet impliceret som relevant for astmas patologi. Patienter med astma viser et øget udtryk for iNOS i luftvejsepitelceller og et øget niveau af nitrogenoxid i udåndet luft.
Prostaglandin endoperoxid 2 (PGE2)
Mange andre immunmodulerende faktorer er blevet isoleret, hvoraf de vigtigste er prostaglandiner og cytokiner. PGE2 var den første immunmodulator, der blev afledt af makrofager og beskrevet. PGE2-funktioner til forstærkning af perifert blodlymfocyt IL-10-transkription og proteinproduktion; samt ved deaktivering af makrofager og T-celler. PGE2 er et immunmodulerende eicosanoid afledt af cellemembrankomponenten, arachidonsyre , og behandles i arachidonsyrekaskaden: den successive iltning og isomerisering af arachidonsyre med cyclooxygenase- og PGE2 -syntaseenzymer. Reguleringen af målceller ved PGE2 sker via signalering gennem fire cellemembranassocierede G-proteinkoblede E-prostanoid (EP) receptorer, navngivet EP1, EP2, EP3 og EP4. PGE2 hæmmer bakteriedrab og ROI-produktion af AM ved at forringe Fcy-medieret fagocytose gennem dets evne til at stimulere produktionen af intracellulære cykliske adenosinmonophosphat (cAMP) effektorer via EP2- og EP4-receptorsignalering. EP2- og EP4 -receptorer signalerer primært gennem stimulerende G -protein (Gs), stigende adenylylcyclase (AC) aktivitet og efterfølgende cAMP -dannelse. cAMP er en anden messenger, der påvirker flere cellulære funktioner via aktivering af to nedstrøms effektormolekyler, proteinkinase A (PKA) og udvekslingsproteinerne aktiveret direkte af cAMP (Epac -1 og -2). Epac-1 og PKA er begge vigtige faktorer, der er involveret i hæmning af AM-bakteriedrab. Virkningerne af PKA skyldes dens evne til at fosforylere serin- og threoninrester på mange cellulære proteiner, især transkriptionsfaktor cAMP -responselementbindende protein (CREB). cAMP/PKA/CREB-aksen medierer inhiberingen af TNF-alfa-frigivelse. Dræbningen af fagocytoserede bakterier ved AM'er er afhængig af flere forskellige mikrobicidmekanismer, f.eks. Den reducerede NADPH-oxidasemedierede frigivelse af ROI. ROI-generering ved NADPH-oxidase er en vigtig bakteriedræbende mekanisme efter FcR-medieret fagocytose. PGE2 aktiverer både Gs-koblede EP2- og EP4-receptorer ved ligering, stimulerer cAMP-produktion og efterfølgende aktivering af nedstrøms cAMP-effektorer, PKA og Epac-1; begge som igen forringer phosphorylering og fagosomal membran -translokation af NADPH -oxidasekomponent, p47phox, og hæmmer derved respiratorisk burst.
Interleukin -4 og -10
IL-4 er et pleiotropisk cytokin, der spiller en central rolle i udviklingen af T-hjælper type 2 (Th2) celler. IL-4 er vigtig for differentiering af naive CD4-T-celler til modne celler af Th2-typen; samt for skift af immunoglobulin (Ig) til IgE og IgG4 under udviklingen af immunresponser. Ig er en klasse af antistof, der kun findes hos pattedyr, der spiller en vigtig rolle i allergirespons og forsvar mod mange slags patogener ved at beskytte kroppen mod dem ved komplementaktivering, opsonisering for fagocytose og neutralisering af deres toksiner.
IL-4 og IL-10 har begge vist sig at reducere produktionen af metalloproteinaser (endopeptidaser, der nedbryder kollagen og andre ekstracellulære proteiner) af humane AM'er. IL-4 har to virkninger på makrofagens biologiske funktion, som enten kan være stimulerende eller hæmmende. Det forbedrer MHC klasse II-antigen (ekstracellulært proteinkompleks, der udelukkende interagerer med CD4-T-celler som en del af den eksogene vej) og Mac-1 (overfladereceptor som en del af medfødt komplementsystem) -udtryk, hvilket fremmer fagocytose. IL-4 har også vist sig at hæmme produktionen af PGE2 ved at reducere ekspressionen af enzymet, prostaglandin H-syntase -2 (PGHS-2), hvilket er kritisk i produktionen af PGE2. IL-4 hæmmer imidlertid produktionen af TNF-alfa, IL-1 og -6, som alle er vigtige cytokiner i det proinflammatoriske respons).
IL-10 hæmmer udskillelsen af proinflammatoriske cytokiner TNF-alfa og INF-gamma og undertrykker således proliferationen af T-celler, NK-celler og AM. IL-10 deler lignende immunmodulerende mekanismer som TGF-β. Det menes, at begge cytokiner reducerer apoptosefrekvensen i humane alveolære makrofager, hvilket indirekte forbedrer alveolær makrofag-medieret inhibering af T-celleproliferation. Der er en signifikant stigning i basalhastigheden for apoptose ved aktivering af bakterielle produkter. Apoptose er især reguleret af tilstedeværelsen af cytokiner: IFNγ øger apoptosehastigheden, hvorimod IL-10 og TGF-β reducerer den. Imidlertid har IL-10 kontraproduktive virkninger på immunsystemet og har vist sig faktisk at fremme infektion med fremmede patogener. IL-10's rolle i bakteriel og parasitær infektion er blevet opdaget som en strategi til at undgå vært immunsystemer. Der er bakterier, som parasiterer AM'er ved at invadere gennem deres membraner og trives ved at vokse og replikere inde i dem og udnytte AM'er som værtsceller. Normalt kan denne infektion elimineres af T-celler, som aktiverer enzymer i alveolære makrofager, der ødelægger bakterierne; men disse bakterier har vist sig at ændre cytokinsignaleringsnetværket til deres fordel. Som et hæmmende cytokin letter IL-10 infektionen af humane alveolære makrofager og monocytter ved fuldstændig at vende den beskyttende effekt af IFNy mod intracellulær Legionella pneumophila replikation. Yersinia enterocolitica har også vist sig at frigive virulensantigen LcrV, som inducerer IL-10 gennem Toll-lignende receptor-2 og CD14 (et ekstra overfladeprotein af TLR4-medieret LPS-signalering), hvilket resulterer i undertrykkelse af IFNγ og TNF-alfa undertrykkelse.
Transformerende vækstfaktor β (TGF-β)
Under normale forhold klæber alveolære makrofager tæt til alveolære epitelceller, hvilket inducerer ekspressionen af αvβ6 -integrinet. Integriner er dimere celleoverfladereceptorer sammensat af alfa- og beta-underenheder, som aktiverer TGF-β. svar. TGF-β regulerer stramt antiinflammatorisk aktivitet ved at undertrykke proinflammatorisk cytokinproduktion og derved hæmme T-lymfocytfunktion. Integrins avβ6 og avβ8 sequester latent TGF-β til celleoverfladen, hvor aktivering kan være tæt koblet til cellulære reaktioner på miljøbelastning i vedligeholdelsen af homeostase; integriner lokaliserer også aktiveret TGFp i nærheden af makrofagerne. Normalt udskilles modent TGFp som et latent kompleks med sit N-terminale fragment, latensassocieret peptid (LAP), som hæmmer dets aktivitet. Det latente kompleks er kovalent forbundet med den ekstracellulære matrix ved binding til latente TGF-β-bindende proteiner. TGF-β aktiveres af forskellige mekanismer i lungen, hvilket i sidste ende involverer enten proteolyse eller konformationel ændring af LAP. αvβ6-integrin er i stand til at formidle aktivering af TGF-β ved binding til TGF-β1 LAP, der fungerer som et ligandbindingssted for integrinet, og er en væsentlig komponent i TGF-β-aktiveringsapparatet. Når den er aktiveret, fører TGFβ til undertrykkelse af makrofagfunktionalitet (cytokinproduktion og fagocytose). Binding af aktiveret TGF-β til dets receptorer udtrykt på alveolære makrofager inducerer en nedstrøms signalkaskade, herunder phosphorylering af receptorregulerede små mødre mod dekapentaplegiske (R-SMAD) homologer 2 og 3. Phosphorylerede SMAD-2 og -3 danner derefter heteromere komplekser med common-mediator SMAD 4 (co-SMAD-4). Når de er samlet, translokerer komplekserne til kernen via kerneporen ved hjælp af importins alfa/beta. Når de er i kernen, akkumuleres disse komplekser og fungerer til sidst som en transkriptionsfaktor, der regulerer ekspressionen af TGF-β-målgener. Således involverer TGF-β-signalering en direkte vej fra receptorerne på overfladen af en celle til kernen.
Aktivering
Afgiftslignende receptorer (TLR'er) signalerer PRR'er , der er i stand til at genkende forskellige bakterielle proteiner. Selvom bakterier har udviklet midler til at undgå værtsforsvarsmekanismer, udtrykker de PAMP'er, såsom lipoglycaner og lipoproteiner, der genkendes af celler i det medfødte immunsystem gennem TLR'erne. Ved binding af PAMP'er til TLR'er udløser TLR inflammatoriske og defensive reaktioner i værtscellen, hvilket inducerer actinpolymerisation i alveolære makrofager (en afgørende komponent i endocytose og motilitet). Actinpolymerisation i alveolære makrofager forårsager undertrykkelse af integrinekspression, hvilket igen forårsager deaktivering af TGF-β og nedregulering af det basale phosphoryleringsniveau af SMAD 2/3; efterfølgende fører til aktivering og frigørelse af alveolære makrofager fra de alveolære epitelceller [15]. Ved aktivering bliver makrofager primet til fagocytose og begynder at udskille proinflammatoriske cytokiner (TNF-α og IL-6).
Priming af makrofager involverer forbedring af respiratorisk burstaktivitet med IFN-y og TNF-a. IFNy inducerer både en øget affinitet af NADPH -oxidasen for NADPH i makrofager såvel som en øget hastighed for gentranskription og meddelelsesekspression for gp91phox -protein. TNF-a fungerer som en autokrin stimulus ved at øge ekspressionen af både p47phox- og p67phox-transkripter. ROI'erne produceret under respirations burst-responset forbedrer igen makrofager produktion af TNF-α.
Deaktivering
Gasudveksling skal genoprettes så hurtigt som muligt for at undgå kollateral skade, så aktiverede lymfocytter udskiller IFNγ for at stimulere produktionen af matrixmetalloproteinase MMP-9 af makrofager. AM'er er blevet rapporteret at producere MMP-9 delvist via PGE2-afhængige PKA-signalveje, som er de veje, der er involveret i hæmning af fagocytose. MMP-9 aktiverer latent TGF-β, der reinducerer ekspression af αvβ6-integriner på alveolære epitelceller og derved returnerer den alveolære makrofag til en hviletilstand. Aktivering af TGF-β er også fordelagtig, fordi dets produktion stimulerer kollagensyntese i interstitielle fibroblaster, hvilket er nødvendigt for at genoprette alveolær vægarkitektur.
Se også
Referencer
eksterne links
- Histologi billede: 13906loa - Histology Learning System ved Boston University - "Respiratory System: lung (human), alveolar macrophages"
- Histologi på KUMC resp-resp16 " Alveoli "
- Skub ved ufl.edu
