Faktor IX - Factor IX
Faktor IX (eller jul faktor ) ( EF 3.4.21.22 ) er en af de serinproteaser af koagulation systemet; det tilhører peptidase -familien S1. Mangel på dette protein forårsager hæmofili B . Det blev opdaget i 1952 efter at en ung dreng ved navn Stephen Christmas viste sig at mangle denne nøjagtige faktor, hvilket førte til hæmofili .
Koagulationsfaktor IX er på Verdenssundhedsorganisationens liste over essentielle lægemidler .
Fysiologi

Faktor IX produceres som et zymogen , en inaktiv forløber. Det behandles for at fjerne signalpeptidet , glycosyleret og derefter spaltet af faktor XIa (af kontaktvejen) eller faktor VIIa (af vævsfaktorvejen) for at producere en to-kædet form, hvor kæderne er forbundet med en disulfidbro . Når den aktiveres til faktor IXa , i nærvær af Ca2 + , membranphospholipider og en faktor VIII -cofaktor, hydrolyserer den en arginin - isoleucinbinding i faktor X til dannelse af faktor Xa.
Faktor IX inhiberes af antithrombin .
Faktor IX -ekspression stiger med alderen hos mennesker og mus. I musemodeller har mutationer inden for promotorregionen af faktor IX en aldersafhængig fænotype.
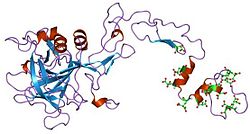
Domænearkitektur
Faktor VII , IX og X spiller alle nøgleroller i blodkoagulation og deler også en fælles domænearkitektur. Faktor IX -proteinet består af fire proteindomæner : Gla -domænet , to tandemkopier af EGF -domænet og et C -terminalt trypsinlignende peptidase -domæne, der udfører den katalytiske spaltning.
Den N-terminale EGF-domæne har vist sig at i det mindste delvis være ansvarlig for binding vævsfaktor . Wilkinson et al . konkludere, at resterne 88 til 109 i det andet EGF -domæne medierer binding til blodplader og samling af faktor X -aktiverende kompleks.
Strukturerne for alle fire domæner er blevet løst. En struktur af de to EGF-domæner og det trypsinlignende domæne blev bestemt for svineproteinet. Strukturen af Gla-domænet, der er ansvarlig for Ca (II) -afhængig phospholipidbinding, blev også bestemt ved NMR .
Flere strukturer af 'superaktive' mutanter er blevet løst, som afslører arten af faktor IX -aktivering af andre proteiner i koaguleringskaskaden.
Genetik
Den genet for faktor IX er placeret på X-kromosomet (Xq27.1-q27.2) og er derfor X-linked recessive : mutationer i dette gen påvirker mænd langt oftere end kvinder. Det blev først klonet i 1982 af Kotoku Kurachi og Earl Davie .
Polly , et transgent klonet Poll Dorset -får, der bærer genet for faktor IX, blev produceret af Dr. Ian Wilmut ved Roslin Institute i 1997.
Rolle i sygdom
Mangel på faktor IX forårsager julesygdom ( hæmofili B ). Over 3000 varianter af faktor IX er blevet beskrevet, hvilket påvirker 73% af de 461 rester; nogle forårsager ingen symptomer, men mange fører til en betydelig blødningsforstyrrelse. Den oprindelige julesygdomsmutation blev identificeret ved sekventering af julens DNA og afslørede en mutation, der ændrede en cystein til en serin. Rekombinant faktor IX bruges til behandling af julesygdomme. Formuleringer omfatter:
- nonacog alfa (mærke navn BeneFix)
- albutrepenonacog alfa (mærkenavn Idelvion)
- eftrenonacog alfa (mærke Alprolix)
- nonacog beta pegol (mærke Refixia)
Nogle sjældne mutationer af faktor IX resulterer i forhøjet koagulationsaktivitet og kan resultere i koagulationssygdomme, såsom dyb venetrombose . Denne gevinst af funktionsmutation gør proteinet hyperfunktionelt og er forbundet med familiær tidlig trombofili.
Faktor IX -mangel behandles ved injektion af oprenset faktor IX frembragt ved kloning i forskellige dyre- eller dyrecellevektorer. Tranexaminsyre kan være af værdi hos patienter, der opereres, og som har arvet faktor IX -mangel for at reducere den perioperative risiko for blødning.
En liste over alle mutationer i faktor IX udarbejdes og vedligeholdes af EAHAD.
Koagulationsfaktor IX er på Verdenssundhedsorganisationens liste over essentielle lægemidler .
Referencer
Yderligere læsning
- Davie EW, Fujikawa K (1975). "Grundlæggende mekanismer i blodkoagulation". Årlig gennemgang af biokemi . 44 : 799–829. doi : 10.1146/annurev.bi.44.070175.004055 . PMID 237463 .
- Sommer SS (jul 1992). "Vurdering af det underliggende mønster af humane kønsmutationer: lektioner fra faktor IX -genet". FASEB Journal . 6 (10): 2767–74. doi : 10.1096/fasebj.6.10.1634040 . PMID 1634040 . S2CID 15211597 .
- Lenting PJ, van Mourik JA, Mertens K (dec 1998). "Koagulationsfaktor VIIIs livscyklus i betragtning af dets struktur og funktion". Blod . 92 (11): 3983–96. doi : 10.1182/blood.V92.11.3983 . PMID 9834200 .
- Lowe GD (dec 2001). "Faktor IX og trombose" (PDF) . British Journal of Hematology . 115 (3): 507–13. doi : 10.1046/j.1365-2141.2001.03186.x . PMID 11736930 . S2CID 44650866 .
- O'Connell NM (jun 2003). "Faktor XI-mangel-fra molekylær genetik til klinisk ledelse". Blodkoagulation og fibrinolyse . 14 Suppl 1: S59-64. doi : 10.1097/00001721-200306001-00014 . PMID 14567539 .
- Du X (maj 2007). "Signalering og regulering af trombocytglycoproteinet Ib-IX-V-kompleks". Nuværende udtalelse i hæmatologi . 14 (3): 262–9. doi : 10.1097/MOH.0b013e3280dce51a . PMID 17414217 . S2CID 39904506 .
eksterne links
- "Koagulationsfaktor IX (rekombinant), Fc Fusion Protein" . Lægemiddeloplysningsportal . US National Library of Medicine.
- "Eftrenonacog alfa" . Lægemiddeloplysningsportal . US National Library of Medicine.
- "Nonacog alfa" . Lægemiddeloplysningsportal . US National Library of Medicine.
- "Albutrepenonacog alfa" . Lægemiddeloplysningsportal . US National Library of Medicine.
- "Nonacog beta pegol" . Lægemiddeloplysningsportal . US National Library of Medicine.
- Oversigt over alle de tilgængelige strukturoplysninger i PDB for UniProt : P00740 (koagulationsfaktor IX) på PDBe-KB .
- GeneReviews/NCBI/NIH/UW -post om Hemophilia B
- Den Merops online database for peptidaser og deres hæmmere: S01.214