Kogepunkt -Boiling point
Et stofs kogepunkt er den temperatur, hvor en væskes damptryk er lig med trykket omkring væsken, og væsken ændres til en damp.
En væskes kogepunkt varierer afhængigt af det omgivende miljøtryk. En væske i et delvist vakuum har et lavere kogepunkt, end når væsken er ved atmosfærisk tryk . En væske ved højt tryk har et højere kogepunkt, end når væsken er ved atmosfærisk tryk. For eksempel koger vand ved 100 °C (212 °F) ved havoverfladen, men ved 93,4 °C (200,1 °F) i 1.905 meters (6.250 fod) højde. For et givet tryk vil forskellige væsker koge ved forskellige temperaturer.
Det normale kogepunkt (også kaldet det atmosfæriske kogepunkt eller det atmosfæriske trykkogepunkt ) for en væske er det specielle tilfælde, hvor væskens damptryk er lig med det definerede atmosfæriske tryk ved havoverfladen, én atmosfære . Ved den temperatur bliver væskens damptryk tilstrækkeligt til at overvinde atmosfærisk tryk og tillade dampbobler at dannes inde i hovedparten af væsken. Standardkogepunktet er blevet defineret af IUPAC siden 1982 som den temperatur, ved hvilken kogningen sker under et tryk på en bar .
Fordampningsvarmen er den energi, der kræves for at omdanne en given mængde (en mol, kg, pund osv.) af et stof fra en væske til en gas ved et givet tryk (ofte atmosfærisk tryk).
Væsker kan ændre sig til en damp ved temperaturer under deres kogepunkter gennem fordampningsprocessen . Fordampning er et overfladefænomen, hvor molekyler placeret nær væskens kant, ikke indeholdt af tilstrækkeligt væsketryk på den side, undslipper i omgivelserne som damp . På den anden side er kogning en proces, hvor molekyler hvor som helst i væsken undslipper, hvilket resulterer i dannelsen af dampbobler i væsken.
Mætningstemperatur og tryk
En mættet væske indeholder så meget termisk energi, som den kan uden at koge (eller omvendt indeholder en mættet damp så lidt termisk energi, som den kan uden at kondensere ).
Mætningstemperatur betyder kogepunkt . Mætningstemperaturen er temperaturen for et tilsvarende mætningstryk, hvorved en væske koger ind i sin dampfase . Væsken kan siges at være mættet med termisk energi . Enhver tilføjelse af termisk energi resulterer i en faseovergang .
Hvis trykket i et system forbliver konstant ( isobarisk ), vil en damp ved mætningstemperatur begynde at kondensere til sin væskefase, når termisk energi ( varme ) fjernes. Tilsvarende vil en væske ved mætningstemperatur og -tryk koge ind i sin dampfase, når der tilføres yderligere termisk energi.
Kogepunktet svarer til den temperatur, ved hvilken væskens damptryk svarer til det omgivende miljøtryk. Således er kogepunktet afhængig af trykket. Kogepunkter kan offentliggøres med hensyn til NIST, USA standardtryk på 101.325 kPa (eller 1 atm ), eller IUPAC standardtryk på 100.000 kPa. I højere højder, hvor det atmosfæriske tryk er meget lavere, er kogepunktet også lavere. Kogepunktet stiger med øget tryk op til det kritiske punkt , hvor gas- og væskeegenskaberne bliver identiske. Kogepunktet kan ikke øges ud over det kritiske punkt. Ligeledes falder kogepunktet med faldende tryk, indtil tredobbeltpunktet er nået. Kogepunktet kan ikke sænkes til under tredobbeltpunktet.
Hvis fordampningsvarmen og damptrykket af en væske ved en bestemt temperatur er kendt, kan kogepunktet beregnes ved at bruge Clausius-Clapeyron-ligningen , således:
hvor:
- er kogepunktet ved interessetrykket,
- er den ideelle gaskonstant ,
- er væskens damptryk ,
- er et eller andet tryk, hvor det tilsvarende er kendt (normalt tilgængelige data ved 1 atm eller 100 kPa),
- er væskens fordampningsvarme ,
- er kogetemperaturen,
- er den naturlige logaritme .
Mætningstryk er trykket for en tilsvarende mætningstemperatur, ved hvilken en væske koger ind i sin dampfase. Mætningstryk og mætningstemperatur har en direkte sammenhæng: Når mætningstrykket øges, er mætningstemperaturen også det.
Hvis temperaturen i et system forbliver konstant (et isotermisk system), vil damp ved mætningstryk og temperatur begynde at kondensere til sin væskefase, når systemtrykket øges. På samme måde vil en væske ved mætningstryk og temperatur have tendens til at blinke ind i sin dampfase, når systemtrykket falder.
Der er to konventioner vedrørende standardkogepunktet for vand : Det normale kogepunkt er 99,97 °C (211,9 °F ) ved et tryk på 1 atm (dvs. 101,325 kPa). Det IUPAC-anbefalede standardkogepunkt for vand ved et standardtryk på 100 kPa (1 bar) er 99,61 °C (211,3 °F ). Til sammenligning, på toppen af Mount Everest , i 8.848 m (29.029 fod) højde, er trykket omkring 34 kPa (255 Torr ), og vands kogepunkt er 71 °C (160 °F ). Celsius temperaturskalaen blev defineret indtil 1954 af to punkter: 0 °C er defineret af vandets frysepunkt og 100 °C er defineret af vandets kogepunkt ved standard atmosfærisk tryk.
Forholdet mellem det normale kogepunkt og væskers damptryk
Jo højere damptryk en væske er ved en given temperatur, jo lavere er væskens normale kogepunkt (dvs. kogepunktet ved atmosfærisk tryk).
Damptryksdiagrammet til højre har grafer over damptrykket i forhold til temperaturerne for en række forskellige væsker. Som det kan ses i skemaet, har væskerne med de højeste damptryk de laveste normale kogepunkter.
For eksempel, ved enhver given temperatur, har methylchlorid det højeste damptryk af nogen af væskerne i diagrammet. Det har også det laveste normale kogepunkt (−24,2 °C), hvilket er der, hvor damptrykskurven for methylchlorid (den blå linje) skærer den vandrette tryklinje for én atmosfære ( atm ) absolut damptryk.
Det kritiske punkt for en væske er den højeste temperatur (og tryk), den faktisk vil koge ved.
Se også Vandets damptryk .
Elementernes egenskaber
Grundstoffet med det laveste kogepunkt er helium . Både kogepunkterne for rhenium og wolfram overstiger 5000 K ved standardtryk ; fordi det er svært at måle ekstreme temperaturer præcist uden bias, er begge blevet citeret i litteraturen som havende det højere kogepunkt.
Kogepunkt som referenceegenskab for en ren forbindelse
Som det kan ses af ovenstående plot af logaritmen af damptrykket vs. temperaturen for en given ren kemisk forbindelse , kan dens normale kogepunkt tjene som en indikation af den pågældende forbindelses samlede flygtighed . En given ren forbindelse har kun ét normalt kogepunkt, hvis nogen, og en forbindelses normale kogepunkt og smeltepunkt kan tjene som karakteristiske fysiske egenskaber for den forbindelse, opført i opslagsbøger. Jo højere en forbindelses normale kogepunkt er, jo mindre flygtig er denne forbindelse generelt, og omvendt, jo lavere en forbindelses normale kogepunkt er, desto mere flygtig er forbindelsen generelt. Nogle forbindelser nedbrydes ved højere temperaturer, før de når deres normale kogepunkt, eller nogle gange endda deres smeltepunkt. For en stabil forbindelse varierer kogepunktet fra dets tredobbelte punkt til dets kritiske punkt afhængigt af det eksterne tryk. Ud over dets tredobbelte punkt er en forbindelses normale kogepunkt, hvis nogen, højere end dens smeltepunkt. Ud over det kritiske punkt smelter en forbindelses væske- og dampfaser sammen i én fase, som kan kaldes en overophedet gas. Ved en given temperatur, hvis en forbindelses normale kogepunkt er lavere, vil denne forbindelse generelt eksistere som en gas ved atmosfærisk ydre tryk. Hvis forbindelsens normale kogepunkt er højere, så kan denne forbindelse eksistere som en væske eller fast stof ved den givne temperatur ved atmosfærisk ydre tryk, og vil således eksistere i ligevægt med dens damp (hvis den er flygtig), hvis dens dampe er indeholdt. Hvis en forbindelses dampe ikke er indeholdt, kan nogle flygtige forbindelser til sidst fordampe på trods af deres højere kogepunkter.

Generelt har forbindelser med ionbindinger høje normale kogepunkter, hvis de ikke nedbrydes, før de når så høje temperaturer. Mange metaller har høje kogepunkter, men ikke alle. Meget generelt - hvor andre faktorer er lige - i forbindelser med kovalent bundne molekyler , når størrelsen af molekylet (eller molekylmassen ) øges, stiger det normale kogepunkt. Når molekylstørrelsen bliver den for et makromolekyle , polymer eller på anden måde meget stor, nedbrydes forbindelsen ofte ved høj temperatur, før kogepunktet nås. En anden faktor, der påvirker det normale kogepunkt for en forbindelse, er polariteten af dens molekyler. Når polariteten af en forbindelses molekyler stiger, stiger dens normale kogepunkt, mens andre faktorer er lige store. Nært beslægtet er et molekyles evne til at danne hydrogenbindinger (i flydende tilstand), hvilket gør det sværere for molekyler at forlade den flydende tilstand og dermed øger det normale kogepunkt for forbindelsen. Simple carboxylsyrer dimeriseres ved at danne hydrogenbindinger mellem molekyler. En mindre faktor, der påvirker kogepunkter, er formen af et molekyle. At gøre formen på et molekyle mere kompakt har en tendens til at sænke det normale kogepunkt lidt sammenlignet med et tilsvarende molekyle med mere overfladeareal.
| Almindeligt navn | n - butan | isobutan |
|---|---|---|
| IUPAC navn | butan | 2-methylpropan |
| Molekylær form |
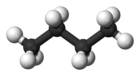
|
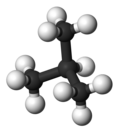
|
| Kogepunkt (°C) |
-0,5 | −11.7 |
| Almindeligt navn | n - pentan | isopentan | neopentan |
|---|---|---|---|
| IUPAC navn | pentan | 2-methylbutan | 2,2-dimethylpropan |
| Molekylær form |

|

|

|
| Kogepunkt (°C) |
36,0 | 27.7 | 9.5 |

De fleste flygtige forbindelser (hvor som helst i nærheden af omgivende temperaturer) går gennem en mellemliggende flydende fase, mens de varmes op fra en fast fase for til sidst at omdannes til en dampfase. Sammenlignet med kogning er en sublimering en fysisk transformation, hvor et fast stof bliver direkte til damp, hvilket sker i nogle få udvalgte tilfælde, såsom med kuldioxid ved atmosfærisk tryk. For sådanne forbindelser er et sublimeringspunkt en temperatur, ved hvilken et fast stof, der bliver direkte til damp, har et damptryk svarende til det ydre tryk.
Urenheder og blandinger
I det foregående afsnit blev kogepunkter for rene forbindelser dækket. Damptryk og kogepunkter for stoffer kan påvirkes af tilstedeværelsen af opløste urenheder ( opløste stoffer ) eller andre blandbare forbindelser, graden af virkning afhænger af koncentrationen af urenhederne eller andre forbindelser. Tilstedeværelsen af ikke-flygtige urenheder såsom salte eller forbindelser med en flygtighed langt lavere end hovedkomponentforbindelsen nedsætter dens molfraktion og opløsningens flygtighed og hæver dermed det normale kogepunkt i forhold til koncentrationen af de opløste stoffer. Denne effekt kaldes kogepunktsforhøjelse . Som et almindeligt eksempel koger saltvand ved en højere temperatur end rent vand.
I andre blandinger af blandbare forbindelser (komponenter) kan der være to eller flere komponenter med varierende flygtighed, som hver har sit eget rene komponentkogepunkt ved ethvert givet tryk. Tilstedeværelsen af andre flygtige komponenter i en blanding påvirker damptrykket og dermed kogepunkter og dugpunkter for alle komponenterne i blandingen. Dugpunktet er en temperatur, hvor en damp kondenserer til en væske. Desuden er sammensætningen af dampen forskellig fra sammensætningen af væsken i de fleste sådanne tilfælde ved en given temperatur. For at illustrere disse virkninger mellem de flygtige komponenter i en blanding, bruges et kogepunktsdiagram almindeligvis. Destillation er en proces med kogning og [normalt] kondensation, som udnytter disse forskelle i sammensætning mellem væske- og dampfaser.
Bord
| Gruppe → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Periode |
|
||||||||||||||||||||
| 1 |
H 2 20,271 K (-252,879 °C) |
|
Han4,222 K (-268,928 °C) |
||||||||||||||||||
| 2 |
Li1603 K (1330 °C) |
Være2742 K (2469 °C) |
|
B4200 K (3927 °C) |
C3915 K ( subl. ) (3642 °C) |
N 2 77.355 K (-195.795 °C) |
O 2 90,188 K (-182,962 °C) |
F 2 85,03 K (−188,11 °C) |
Ne27.104 K (−246.046 °C) |
||||||||||||
| 3 |
Na1156.090 K (882.940 °C) |
Mg1363 K (1091 °C) |
|
Al2743 K (2470 °C) |
Si3538 K (3265 °C) |
P553,7 K (280,5 °C) |
S717,8 K (444,6 °C) |
Cl 2239,11 K (-34,04 °C) |
Ar87.302 K (-185.848 °C) |
||||||||||||
| 4 |
K1032 K (759 °C) |
Ca1757 K (1484 °C) |
Sc3109 K (2836 °C) |
Ti3560 K (3287 °C) |
V3680 K (3407 °C) |
Cr2945,15 K (2672,0 °C) |
Mn2334 K (2061 °C) |
Fe3134 K (2861 °C) |
Co3200 K (2927 °C) |
Ni3003 K (2730 °C) |
Cu2835 K (2562 °C) |
Zn1180 K (907 °C) |
Ga2673 K (2400 °C) |
Ge3106 K (2833 °C) |
Som887 K ( subl. ) (615 °C) |
Se958 K (685 °C) |
Br 2332,0 K (58,8 °C) |
Kr119.735 K (-153.415 °C) |
|||
| 5 |
Rb961 K (688 °C) |
Sr1650 K (1377 °C) |
Y3203 K (2930 °C) |
Zr4650 K (4377 °C) |
NB5017 K (4744 °C) |
Mo4912 K (4639 °C) |
Tc4538 K (4265 °C) |
Ru4423 K (4150 °C) |
Rh3968 K (3695 °C) |
Pd3236 K (2963 °C) |
Ag2483 K (2210 °C) |
Cd1040 K (767 °C) |
I2345 K (2072 °C) |
Sn2875 K (2602 °C) |
Sb1908 K (1635 °C) |
Te1261 K (988 °C) |
jeg 2 457,4 K (184,3 °C) |
Xe165.051 K (-108.099 °C) |
|||
| 6 |
Cs944 K (671 °C) |
Ba2118 K (1845 °C) |
|
Lu3675 K (3402 °C) |
Hf4876 K (4603 °C) |
Ta5731 K (5458 °C) |
W6203 K (5930 °C) |
Vedr5900,15 K (5627,0 °C) |
Os5285 K (5012 °C) |
Ir4403 K (4130 °C) |
Pt4098 K (3825 °C) |
Au3243 K (2970 °C) |
Hg629,88 K (356,73 °C) |
Tl1746 K (1473 °C) |
Pb2022 K (1749 °C) |
Bi1837 K (1564 °C) |
Po1235 K (962 °C) |
Klokken 2503±3 K (230±3 °C) |
Rn211,5 K (-61,7 °C) |
||
| 7 |
Fr950 K (677 °C) |
Ra2010 K (1737 °C) |
|
Lr |
Rf5800 K (2100 °C) |
Db | Sg | Bh | Hs | Mt | Ds | Rg |
Cn340±10 K (67±10 °C) |
Nh1430 K (1130 °C) |
Fl380 K (107 °C) |
Mc~1400 K (~1100 °C) |
Lv1035-1135 K (762-862 °C) |
Ts883 K (610 °C) |
Og450±10 K (177±10 °C) |
||
|
|
|||||||||||||||||||||
|
|
La3737 K (3464 °C) |
Ce3716 K (3443 °C) 6 |
Pr3403 K (3130 °C) |
Nd3347 K (3074 °C) |
Om eftermiddagen3273 K (3000 °C) |
Sm2173 K (1900 °C) |
Eu1802 K (1529 °C) |
Gd3273 K (3000 °C) |
Tb3396 K (3123 °C) |
D y2840 K (2567 °C) |
Ho2873 K (2600 °C) |
Eh3141 K (2868 °C) |
Tm2223 K (1950 °C) |
Yb1469 K (1196 °C) |
|||||||
|
|
Ac3471 K (3198 °C) |
Th5061 K (4788 °C) |
Pa4300? K (4027 °C) |
U4404 K (4131 °C) |
Np4175,15 K (3902,0 °C) |
Pu3508,15 K (3235,0 °C) |
Er2880 K (2607 °C) |
Cm3383 K (3110 °C) |
Bk2900 K (2627 °C) |
Jf1743 K (1470 °C) |
Es1269 (996 °C) |
Fm | Md | Ingen | |||||||
| Legende | |||||||||||||||||||||
| Værdier er i Kelvin K og Celsius °C, afrundet | |||||||||||||||||||||
| For ækvivalent i Fahrenheit °F, se: Kogepunkter for elementerne (dataside) | |||||||||||||||||||||
| Nogle værdier er forudsigelser | |||||||||||||||||||||
|
Primordial Fra forfald Syntetisk Border viser naturlig forekomst af elementet |
|||||||||||||||||||||
Se også
- Elementernes kogepunkter (dataside)
- Kogepunktsforhøjelse
- Kritisk punkt (termodynamik)
- Ebulliometer , en enhed til nøjagtigt at måle væskes kogepunkt
- Hagedorn temperatur
- Joback-metoden (estimering af normale kogepunkter ud fra molekylær struktur)
- Liste over gasser inklusive kogepunkter
- Smeltepunkt
- Underkøling
- Overophedning
- Ørredens konstante relation til latent varme til kogepunktet
- Triple point
Referencer
eksterne links
- . . 1914.










