Idiopatisk multicentrisk Castleman sygdom - Idiopathic multicentric Castleman disease
| Idiopatisk multicentrisk Castleman sygdom | |
|---|---|
| Andre navne | Kæmpe lymfeknudehyperplasi, lymfoid hamartom, angiofollikulær lymfeknudehyperplasi |
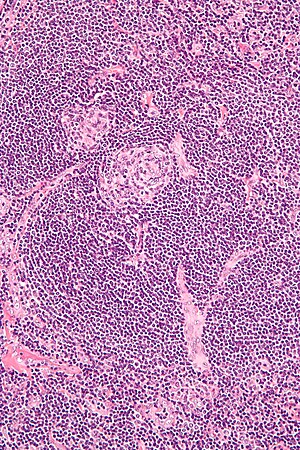 | |
| Mikrografi af lymfeknudebiopsi, der viser hyalin vaskulære træk i overensstemmelse med Castleman sygdom | |
| Specialitet | Hæmatologi, immunologi, reumatologi, patologi |
| Diagnostisk metode | Baseret på patienthistorie, fysisk undersøgelse, laboratorietest, medicinsk billeddannelse, histopatologi |
| Frekvens | ca. 1500-1800 nye sager om året i USA |
Idiopatisk multicentrisk Castleman sygdom (iMCD) er en undertype af Castleman sygdom (også kendt som kæmpe lymfeknude hyperplasi , lymfoide hamartom eller angiofollikulær lymfeknude hyperplasi ), en gruppe af lymfoproliferative lidelser karakteriseret ved lymfeknudeforstørrelse , karakteristiske træk ved mikroskopisk analyse af forstørret lymfeknudevæv og en række symptomer og kliniske fund.
Mennesker med iMCD har forstørrede lymfeknuder i flere regioner og har ofte influenzalignende symptomer, unormale fund ved blodprøver og dysfunktion i vitale organer, såsom lever, nyrer og knoglemarv.
iMCD har funktioner, der ofte findes i autoimmune sygdomme og kræftformer, men den underliggende sygdomsmekanisme er ukendt. Behandling af iMCD kan omfatte brug af en række forskellige lægemidler, herunder immunsuppressiva og kemoterapi.
Castleman sygdom blev opkaldt efter Dr. Benjamin Castleman , der først beskrev sygdommen i 1956. Castleman Disease Collaborative Network er den største organisation med fokus på sygdommen og er involveret i forskning, opmærksomhed og patientstøtte.
tegn og symptomer
Patienter med iMCD kan opleve forstørrede lymfeknuder i flere lymfeknuderegioner; systemiske symptomer (feber, nattesved, utilsigtet vægttab, træthed) forstørrelse af lever og / eller milt ; ophobning af ekstravaskulær væske i ekstremiteterne ( ødem ), underliv ( ascites ) eller foring af lungerne ( pleural effusion ) lungesymptomer såsom hoste og åndenød og hudfund som kirsebærhæmangiomer .
Årsager
Årsagen til iMCD er ikke kendt, og der er ikke identificeret nogen risikofaktorer. Genetiske varianter er blevet observeret i tilfælde af Castleman sygdom; ingen genetisk variant er imidlertid blevet valideret som sygdomsfremkaldende.
I modsætning til HHV-8-associeret MCD er iMCD ikke forårsaget af ukontrolleret HHV-8-infektion.
Mekanisme
Sygdomsmekanismen ved iMCD er ikke blevet beskrevet fuldt ud. Det er kendt, at interleukin-6 (IL-6) , et molekyle, der stimulerer immunceller, spiller en rolle i nogle tilfælde af iMCD. IL-6 niveauer målt hos nogle patienter med iMCD stiger og falder med tilsvarende ændringer i sygdomsaktivitet, mus behandlet med IL-6 udvikler funktioner i iMCD og blokering af IL-6-stien ved hjælp af medicinen siltuximab og tocilizumab behandler effektivt nogle patienter med iMCD. Imidlertid viser mange patienter med iMCD ikke forhøjede niveauer af IL-6, og IL-6 niveauer er ikke stærkt korreleret med respons på behandling med anti-IL-6 medicin. I tilfælde hvor IL-6 spiller en rolle, forbliver den underliggende årsag til forhøjede IL-6 niveauer og cellerne, der er ansvarlige for at producere IL-6, ukendt.
Flere teoretiske mekanismer til iMCD er blevet foreslået baseret på eksisterende forskning og observerede ligheder mellem iMCD og andre sygdomme, der præsenterer med lignende kliniske fund og lymfeknudehistologi:
- Autoimmun - Immunsystemet kan producere antistoffer, der er målrettet mod sunde celler i kroppen i stedet for bakterier og vira. Selvstyrede antistoffer ses almindeligvis i autoimmune sygdomme, såsom systemisk lupus erythematøs og reumatoid arthritis .
- Autoinflammatorisk - En mutation i et gen, der kontrollerer inflammatoriske systemer, kan bidrage til skadelig aktivering af inflammatoriske veje hos patienter med iMCD.
- Neoplastisk - Genetiske mutationer, der udvikler sig i modne celler ( somatiske mutationer), kan forårsage en tilvækst af unormale celler som i kræft såsom lymfom .
- Patogen - Human herpesvirus 8 (HHV-8) er det kendte forårsagende middel i HHV-8-associeret MCD, som har meget lignende symptomer og fund til iMCD. Mens iMCD pr. Definition ikke er forårsaget af HHV-8, kan en ukendt virus forårsage sygdommen.
Der har ikke været rapporterede tilfælde af UCD omdannet til iMCD.
Diagnose
iMCD diagnosticeres i henhold til evidensbaseret konsensusdiagnostiske kriterier, som kræver en grundig evaluering inklusive patienthistorie , fysisk undersøgelse , laboratorietest , radiologisk billeddannelse og mikroskopisk analyse (histologi) af biopsieret væv fra en forstørret lymfeknude. Diagnose af iMCD kræver kliniske abnormiteter, udelukkelse af andre sygdomme og en lymfeknudebiopsi, der viser funktioner, der er i overensstemmelse med Castleman-sygdommen. En lymfeknudebiopsi alene er ikke tilstrækkelig til at stille diagnosen.
Laboratorietest
Laboratorietest kan demonstrere forhøjet C-reaktivt protein , nedsat hæmoglobinniveau ( anæmi ), lavt albuminniveau , forhøjet kreatinin , forhøjede immunglobulinniveauer og unormalt (forhøjet eller nedsat) blodpladetal . Patienter kan også have forhøjelser af molekyler, der er involveret i inflammation ( cytokiner ), såsom Interleukin 6 (IL-6) og vaskulær endotelvækstfaktor (VEGF) .
Medicinsk billeddannelse
Radiologisk billeddannelse vil demonstrere forstørrede lymfeknuder i flere regioner, som typisk er 18F-fluorodoxyglucose (FDG) ivrig efter positronemissionstomografi (PET) .
Tilknyttede sygdomme
iMCD ses almindeligvis hos patienter med POEMS syndrom , men det er uklart, om iMCD opstår som en uafhængig sygdomsproces eller en manifestation af POEMS syndrom hos disse patienter. Patienter med iMCD har øget risiko for solide tumorer og kræft i blodet. Lejlighedsvis er patienter med iMCD tilstede med lymfocytisk interstitiel pneumonitis .
TAFRO syndrom
IMCD patienter med t hrombocytopenia, en nasarca, myelo f ibrosis, r enal dysfunktion og o rganomegaly syndrom (TAFRO syndrom) anses for at have en distinkt klinisk undertype af IMCD. Patienter har ofte hurtig progression af symptomer og udvikler ofte svær organdysfunktion. Sammenlignet med iMCD-patienter uden TAFRO-syndrom er iMCD-patienter med TAFRO-syndrom mere tilbøjelige til at have alvorlig mavesmerter, lave blodpladeniveauer, progressiv nyrefunktion og normale til let forhøjede immunglobulinniveauer. Mens iMCD med TAFRO syndrom først blev beskrevet hos japanske patienter i 2010, er der siden rapporteret tilfælde af iMCD med TAFRO syndrom hos ikke-japanske patienter i mange andre lande.
Klassifikation
Castleman sygdom beskriver en gruppe på mindst 3 forskellige lidelser - Unicentric Castleman sygdom (UCD), human herpesvirus 8 associeret multicentrisk Castleman sygdom (HHV-8-associeret MCD) og idiopatisk multicentrisk Castleman sygdom (iMCD) . Det er vigtigt at identificere den korrekte undertype af sygdommen, da de tre lidelser varierer betydeligt i symptomer, kliniske fund, sygdomsmekanisme, behandlingsmetode og prognose.
- I Unicentric Castleman sygdom er forstørrede lymfeknuder med karakteristiske mikroskopiske fund kun til stede i et enkelt lymfeknudeområde.
- I de multicentriske undertyper af Castleman sygdom er forstørrede lymfeknuder med karakteristiske fund til stede i flere lymfeknuderegioner. De multicentriske varianter af Castleman sygdom klassificeres yderligere efter kendte årsager til sygdommen.
- HHV-8-associeret MCD er forårsaget af ukontrolleret infektion med humant herpesvirus 8 (HHV-8).
- I idiopatisk multicentrisk Castleman sygdom (iMCD) er årsagen til sygdommen ukendt ( idiopatisk ). Test for HHV-8 skal være negativ for at diagnosticere iMCD.
Idiopatisk multicentrisk Castleman sygdom
iMCD kan yderligere differentieres ved tilstedeværelsen af associerede sygdomme, såsom p olyneuropati, o rganomegali, e ndocrinopati, m onoklonalt protein, s kin changes syndrom (POEMS syndrom) eller ved forskellige kliniske træk, såsom t hrombocytopeni, en nasarca, myelo f ibrosis, r enal dysfunktion og o rganomegaly syndrom (TAFRO syndrom).
Diagnostiske kriterier
Diagnose af iMCD kræver: tilstedeværelsen af begge hovedkriterier, flere regioner med forstørrede lymfeknuder som demonstreret ved medicinsk billeddannelse; tilstedeværelsen af mindst to mindre kriterier, hvoraf mindst en skal være en unormal laboratorietest og udelukkelse af sygdomme, der kan efterligne iMCD.
Hovedkriterium 1: flere regioner med forstørrede lymfeknuder
Radiologisk billeddannelse skal demonstrere forstørrede lymfeknuder i flere regioner.
Hovedkriterium 2: mikroskopisk analyse af lymfeknudebiopsi i overensstemmelse med iMCD
Det mikroskopiske udseende (histologi) af biopsieret væv fra en forstørret lymfeknude skal demonstrere en konstellation af funktioner, der er i overensstemmelse med Castleman-sygdommen. Der er tre mønstre af karakteristiske histologiske funktioner forbundet med iMCD:
- Hypervaskulær - regresserede germinale centre , follikulær dendritisk cellefremspring , hypervaskularitet i interfollikulære regioner og fremtrædende kappezoner med et ”løg-hud” udseende.
- Plasmacytisk - øget antal follikler med store hyperplastiske kimcentre og arklignende plasmacytose (øget antal plasmaceller ).
- Blandet - træk ved både hypervaskulær og plasmacytisk.
iMCD viser oftest plasmacytiske træk; imidlertid kan hypervaskulære træk eller en blanding af både hypervaskulære og plasmacytiske træk også ses i iMCD-lymfeknuder. Den kliniske nytte af subtypning af iMCD efter histologiske egenskaber er usikker, da histologiske undertyper ikke konsekvent forudsiger sygdommens sværhedsgrad eller behandlingsrespons.
Farvning med latensassocieret nukleart antigen (LANA-1) , en markør for HHV-8-infektion, skal være negativ for at diagnosticere iMCD.
Mindre kriterier
Patienter skal opleve mindst to af de følgende 11 mindre kriterier, hvor mindst en er en unormal laboratorietest.
Laboratorieprøver:
- Forhøjet C-reaktivt protein eller erytrocytsedimenteringshastighed
- Lavt hæmoglobinniveau (anæmi)
- Unormal (lav eller høj) blodpladetælling
- Lavt albuminniveau
- Forhøjet kreatinin
- Øgede niveauer af immunglobuliner (hypergammaglobulinæmi)
Kliniske egenskaber:
- Influenza-lignende symptomer
- Forstørrelse af lever og / eller milt
- Væskeansamling (ødem, ascites, pleural effusioner)
- Hudfund som kirsebærhæmangiomer eller papirknopper i blodet
- Lymfocytisk interstitiel pneumonitis
Sygdomme, der skal udelukkes
Diagnose kræver udelukkelse af sygdomme, der kan præsentere med lignende kliniske fund og lignende udseende ved mikroskopisk analyse af væv fra en forstørret lymfeknude. Sygdomme, der skal udelukkes ved diagnosen af iMCD, inkluderer infektiøse sygdomme, såsom HHV-8-associeret MCD , Epstein-Barr-virusmononukleose og reaktiv lymfadenopati ; autoimmune sygdomme, såsom systemisk lupus erythematosus og reumatoid arthritis ; og cancere, herunder lymfom , multipelt myelom , og primær lymfeknude plasmacytoma .
Behandling
På grund af sjældenheden af iMCD er data vedrørende behandling begrænsede og baseret på en kombination af observationssagsserier, sagsrapporter og et enkelt randomiseret klinisk forsøg. I modsætning til UCD, hvor kirurgi er den valgte behandling og helbredende for de fleste patienter, er kirurgi ikke effektiv i iMCD. I stedet for kirurgisk behandling anvendes en række medikamenter baseret på sygdommens sværhedsgrad og en patients reaktion på tidligere behandlinger. Siltuximab , et monoklonalt antistof målrettet mod IL-6 , er den eneste medicin, der er godkendt af United States Food and Drug Administration (FDA) til behandling af iMCD; dog er vellykket brug af andre lægemidler rapporteret i litteraturen.
I 2018 blev de første evidensbaserede retningslinjer for konsensusbehandling for iMCD offentliggjort af en international gruppe eksperter inden for området. Ud over at oprette en behandlingsalgoritme for iMCD etablerede disse behandlingsretningslinjer fælles definitioner for sygdommens sværhedsgrad og respons på behandlingen.
Evaluering af iMCD-sværhedsgrad
Patienter med iMCD klassificeres som svære eller ikke-alvorlige sygdomme baseret på de 5 kriterier, der er anført nedenfor. Patient med 2 eller flere af nedenstående kriterier klassificeres som værende med alvorlig sygdom, mens patienter med 0-1 af kriterierne er klassificeret som havende ikke-alvorlig sygdom.
- Eastern Cooperative Oncology Group (ECOG) præstationsstatus ≥ 2
- Anslået glomerulær filtreringshastighed (eGFR) <30 eller kreatinin> 3,0 mg / dL
- Anasarca og / eller ascites og / eller pleural effusion og / eller perikardial effusion
- Hæmoglobin ≤ 8,0 g / dL
- Lungeforstyrrelse (f.eks. Interstitiel pneumonitis med dyspnø)
Behandlingsrespons
Patienter med iMCD evalueres for behandlingsrespons baseret på ændringer i symptomer, størrelsen af involverede lymfeknuder og laboratorietest. Hver kategori klassificeres som et komplet respons, delvis respons, stabil sygdom eller progressiv sygdom. Samlet behandlingsrespons bestemmes af den laveste kategoriklasse. For eksempel vil en patient med et komplet laboratorierespons, et delvis symptomrespons og komplet lymfeknuderesvar få et samlet behandlingsrespons med delvis respons. Se nedenfor for beskrivelser af kriterier og klassificering af svar.
Laboratorietest
Laboratorietest inkluderer alt af følgende: C-reaktivt protein, hæmoglobin, albumin og eGFR.
- Komplet svar - Alle laboratorieværdier inden for normale intervaller
- Delvis respons -> 50% i alle laboratorieværdier
- Stabil sygdom - Alle laboratorieværdier mellem <50% forbedring og <25% forværring
- Progressiv sygdom -> 25% forværring i enhver laboratorieværdi
Symptomer
Fire symptomer vurderes ved hjælp af National Cancer Institute Common Terminology Criteria of Adverse Events (version 4): Træthed, anoreksi, feber og kropsvægt
- Komplet respons - Normalisering til baseline før sygdom
- Delvis respons - Forbedring af alle 4 symptomer, men ikke til baseline før sygdom
- Stabil sygdom - Forbedring af mindst 1 (men ikke alle) symptomer
- Progressiv sygdom - Forværring af mindst 1 symptom ved 2 eller flere vurderinger
Lymfeknude
Behandlingsrespons for lymfeknuder evalueres ved anvendelse af radiologisk billeddannelse og klassificeres som komplet respons, delvis respons, stabil sygdom og progressiv sygdom baseret på modificerede Cheson-kriterier.
Behandlingsalgoritme
Behandlingsalgoritmen til iMCD er primært baseret på sygdommens sværhedsgrad og respons på behandlingen. På grund af den høje tilbagefald med tilbagetrækning af behandlingen behandles de fleste patienter med iMCD med medicin på ubestemt tid.
Ikke-alvorlig sygdom
Siltuximab, en IL-6-blokker, er den anbefalede behandling til alle patienter med ikke-alvorlig iMCD uanset målt IL-6-niveau. Tocilizumab , et lægemiddel, der også retter sig mod IL-6-stien, bruges almindeligvis som et alternativ til siltuximab, når siltuximab ikke er tilgængelig. Kortikosteroider kan tilsættes til anti-IL-6-behandling afhængigt af klinisk præsentation. Rituximab , et lægemiddel, der er målrettet mod B-celler, anbefales primært som andenlinjeterapi til patienter, der ikke reagerer på siltuximab eller tocilizumab, men kan bruges som førstelinjemiddel hos passende patienter.
Behandlingsanbefalinger er ikke veldefinerede for patienter med ikke-alvorlig sygdom, som ikke reagerer på siltuximab, tocilizumab og rituximab. Cytotoksiske kemoterapier er rapporteret at inducere remission hos patienter med ikke-alvorlig iMCD; brugen af cytotoksiske kemoterapier anbefales dog ikke i øjeblikket til ikke-alvorlig iMCD på grund af stor sandsynlighed for tilbagefald og alvorlige bivirkningsprofiler. Som et alternativ anbefales immunmodulatorer såsom thalidomid, cyclosporin A, sirolimus, bortezomib og anakinra på grund af deres lignende responsrater og mere gunstige langsigtede bivirkningsprofiler.
Alvorlig sygdom
Anbefalet indledende behandling til alle patienter med svær iMCD er steroider med høj dosis kombineret med et anti-IL-6 middel såsom siltuximab eller tocilizumab, uanset målt IL-6 niveauer. For patienter, som øjeblikkeligt forbedrer sig med dette regime, kan steroider langsomt tilspidses, men anti-IL-6-midlet bør fortsættes på ubestemt tid på grund af den høje tilbagefaldshastighed ved seponering af behandlingen. På grund af den høje risiko for komplikationer forbundet med svær iMCD anbefales cytotoksiske kemoterapiregimer, hvis patienter forværres eller ikke forbedrer sig med højdosis steroider og anti-IL-6-terapier. Patienter med livstruende sygdom, især patienter med TAFRO-syndrom, kan have behov for avancerede foranstaltninger såsom vejrtrækningsstøtte med en mekanisk ventilator eller behandling med dialyse for nyresvigt.
Efter forbedring af sygdomsstatus fortsættes vedligeholdelsesbehandling med et anti-IL-6 middel eller en immunsuppressiv medicin typisk på ubestemt tid, da tilbagetrækning af sådanne lægemidler kan føre til tilbagefald.
Opfølgning
Patienter med iMCD kræver rutinemæssig vurdering af behandlingsrespons og sygdomsprogression. Det anbefales, at opfølgningsbesøg inkluderer evaluering af symptomer, fysisk undersøgelse, laboratorietest og radiologisk billeddannelse.
Prognose
iMCD kan præsentere som en akut livstruende sygdom hos nogle patienter eller en kronisk sygdom hos andre. Nogle patienter har langvarig stabil sygdom, mens andre lider af blusser af svær sygdom, som kan blive bedre med behandlingen. Vellykket behandling styrer symptomer og organdysfunktion forbundet med iMCD, forbedrer symptomer og organdysfunktion under sygdomsudbrud og forhindrer fremtidige sygdomsudbrud.
Observeret overlevelse i en nylig undersøgelse af iMCD-patienter var 92% efter 2 år, 76% efter 5 år og 59% efter 10 år.
Epidemiologi
Der er cirka 1500-1800 nye tilfælde af iMCD diagnosticeret om året i USA. iMCD kan forekomme i alle aldre, men medianalderen ved præsentation er cirka 50 år gammel. Der er en let øget forekomst af iMCD hos kvinder.
Der har ikke været nogen offentliggjorte epidemiologiske undersøgelser af Castlemans sygdom uden for USA. der har dog ikke været nogen offentliggjorte data, der viser øget eller nedsat forekomst af Castleman-sygdom i specifikke regioner eller etniske grupper.
Historie
Castleman sygdom blev først beskrevet af Dr. Benjamin Castleman i 1956. World Castleman Disease Day blev oprettet i 2018 og afholdes hvert år den 23. juli.
Kultur
Den Castleman Disease Collaborative Network blev grundlagt i 2012 og er den største organisation med fokus på Castlemans sygdom. Det er et globalt samarbejdsnetværk involveret i forskning, bevidsthed og patientstøtte.
Referencer
| Klassifikation |
|---|
