L -type calciumkanal - L-type calcium channel
| Calciumkanal, spændingsafhængig | |
|---|---|
 Krystallografisk struktur
| |
| Identifikatorer | |
| Symbol | Calciumkanal, spændingsafhængig |

Den L-typen calcium kanal (også kendt som dihydropyridin kanal, eller DHP kanal ) er en del af den høje spænding aktiveret familie af spændingsafhængig calciumkanal . "L" står for langvarig og refererer til aktiveringens længde. Denne kanal har fire underenheder ( Cav1.1 , Cav1.2 , Cav1.3 , Cav1.4 ).
L-type calciumkanaler er ansvarlige for excitation- kontraktionskobling af skelet , glat , hjertemuskulatur og for aldosteronsekretion i endokrine celler i binyrebarken . De findes også i neuroner, og ved hjælp af calciumkanaler af L-type i endokrine celler regulerer de neurohormoner og neurotransmittere . De har også set at spille en rolle i genekspression, mRNA-stabilitet, neuronal overlevelse, iskæmisk induceret axonal skade, synaptisk effekt og både aktivering og deaktivering af andre ionkanaler.
I hjertemyocytter passerer L-type calciumkanalen indad Ca 2+ strøm og udløser calciumfrigivelse fra det sarkoplasmatiske nethinde ved at aktivere ryanodinreceptor 2 (RyR2) (calciuminduceret-calciumfrigivelse). Fosforylering af disse kanaler øger deres permeabilitet for calcium og øger kontraktiliteten af deres respektive hjertemyocytter.
L-type calciumkanalblokerende lægemidler bruges som hjerte- antiarytmika eller antihypertensiva , afhængigt af om lægemidlerne har højere affinitet til hjertet ( phenylalkylaminer , som verapamil ) eller til blodkarrene ( dihydropyridinerne , som nifedipin ).
I skeletmuskulaturen er der en meget høj koncentration af L-type calciumkanaler, der er placeret i T-tubuli . Muskeldepolarisering resulterer i store portstrømme, men unormalt lav calciumflux, hvilket nu forklares ved den meget langsomme aktivering af ionstrømmene. Af denne grund passerer lidt eller ingen Ca 2+ over T-tubulamembranen under et enkelt aktionspotentiale.
Historie
I 1953 opdagede Paul Fatt og Bernard Katz spændingslukkede calciumkanaler i krebsdyrmusklen. Kanalerne udviste forskellige aktiveringsspændinger og calciumledende egenskaber og blev således adskilt i højspændingsaktiverende kanaler (HVA) og lavspændingsaktiverende kanaler (LVA). Efter yderligere eksperimentering blev det fundet, at HVA-kanaler ville åbne for 1,4-dihydropyridin ( DHP'er ). Ved hjælp af DHP'er fandt de ud af, at HVA-kanaler var specifikke for visse væv og reagerede forskelligt, hvilket førte til yderligere kategorisering af HVA-kanalerne i L-type, P-type og N-type . L-type calciumkanaler blev sekventeret med peptider, og det blev fundet, at der var 4 slags calciumkanaler af L-type: α 1 S (skeletmuskel), α 1 C (hjerte), α 1 D (findes i hjernen) og α 1 F (fundet i nethinden). I 2000, efter at der blev foretaget mere forskning på α 1- underenheder i spændingsstyrede calciumkanaler, blev der brugt en ny nomenklatur, der kaldte L-type calciumkanaler CaV1, med dens underenheder kaldet CaV1.1 , Cav1.2 , CaV1.3 og CaV1.4 . Forskning på CaV1 -underenhederne afslører fortsat mere om deres struktur, funktion og farmaceutiske applikationer.
Struktur
L-type calciumkanaler indeholder 5 forskellige underenheder, α1 (170–240 kDa), α2 (150 kDa), δ (17-25 kDa), β (50-78 kDa) og γ (32 kDa) underenheder. Α2, δ og β-underenhederne er ikke-kovalent bundet til α1-underenheden og modulerer ionhandel og biofysiske egenskaber ved α1-underenheden. Α2 og δ underenhederne er i det ekstracellulære rum, mens β og γ underenhederne er placeret i det cytosoliske rum.
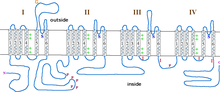
Α1-underenheden er en heterotetramer, der har fire transmembrane områder , kendt som domæner I-IV, der krydser plasmaet seks gange som α-spiraler , kaldet S0-S6 (S0 og S1 krydser sammen membranen én gang). Α1 -underenheden som helhed indeholder spændingsfølende domæne, ledningspore og portapparat. Som de fleste spændingsstyrede ionkanaler består a-underenheden af 4 underenheder. Hver underenhed er dannet af 6 alfa-spiralformede, transmembrane domæner, der krydser membranen (nummereret S1-S6). S1-S4-underenhederne udgør spændingsføleren, mens S5-S6-underenhederne udgør selektivitetsfilteret. For at fornemme cellens spænding indeholder S1-S3 spiraler mange negativt ladede aminosyrer aminosyrer, mens S4 spiraler indeholder for det meste positivt ladede aminosyrer med en P-loop, der forbinder S4 med S5 spiraler. Efter S1-6-domæner er der seks C-domæner, der består af to EF-håndmotiver (C1-2 og C3-4) og et Pre-IQ-domæne (C5) og IQ-domæne (C6). Der er også to EF-håndmotiver på N-terminalen. Både N- og C-terminalen er i det cytosoliske rum, hvor C-terminalen er meget længere end N-terminalen.
Det er kendt, at β-underenheden har fire isoformer (β1-β4) til at regulere kanalens funktioner og er forbundet med α1 via α1 I og II linker i cytosolen ved β α1- bindingslommen (ABP). Hver isoform indeholder et src-homologi 3-domæne (SH3) og et guanylat-kinase-lignende domæne (GK), der er adskilt af et HOOK-domæne og tre ustrukturerede regioner.
Α2- og δ -underenhederne er forbundet med disulfidbindinger (undertiden kendt som α2δ -underenheden) og interagerer med α1. de har fire kendte isoformer kaldet α2δ-1 til α2δ-2 og indeholder et von Willebrand A (VWA) domæne og et Cache-domæne . Α2 -regionen er i det ekstracellulære rum, mens δ -regionen er i cellemembranen og har vist sig at være forankret med et glycosylphosphatidylinositol (GPI) anker.
Γ-underenheden har otte isoformer (γ1-γ8) og er forbundet til α1-underenheden og er kun fundet i muskelceller i CaV1.1- og CaV1.2-kanalerne. Der vides ikke meget om y -underenheden, men den er blevet forbundet med interaktioner i hydrofobe kræfter.
Mekanisme
Åbning af poren i L-type calciumkanaler finder sted i α1-underenheden. Når membranen depolariseres, bevæger S4 -helixen sig gennem S4- og S5 -linkerne til de cytoplasmatiske ender af S5- og S6 -helixerne. Dette åbner aktiveringsporten, der dannes af indersiden af S6 -helixerne i α1 -underenheden.
Den mest fremherskende måde til autoinhibering af L-type calciumkanaler er med Ca 2+ /Cam-komplekset. Når poren åbner og forårsager en tilstrømning af calcium, binder calcium sig til calmodulin og interagerer derefter med sløjfen, der forbinder de tilstødende EF-håndmotiver og forårsager en konformationsændring i EF-håndmotivet, så det interagerer med poren for at forårsage hurtig hæmning i kanalen. Det diskuteres stadig om, hvor og hvordan poren og EF-hånden interagerer. Hydrofobe lommer i Ca 2+ /Cam -komplekset vil også binde til tre sektioner af IQ -domænet kendt som "aromatiske ankre". Den Ca 2+ / Cam kompleks har en høj affinitet over L-type calciumkanaler, gør det muligt at få blokeret selv når der er små mængder af calcium til stede i cellen. Poren lukker til sidst, da cellen repolariseres og forårsager en konformationsændring i kanalen for at sætte den i den lukkede konformation.
Hæmning og modulering
En af de mest anerkendte egenskaber ved L-type calciumkanalen er dens unikke følsomhed over for 1,4-dihydropyridiner (DHP'er) . I modsætning til andre spændingsgatede calciumkanaler er calciumkanaler af L-type resistente over for ⍵-CT X (GVIA) og ⍵-AG A (IVA) hæmmende lægemidler.
En vel observeret form for modulering skyldes alternativ splejsning . En almindelig form for modulering fra alternativ splejsning er C-terminalmodulatoren (CTM). Den har en positivt ladet α-helix på C-terminalen kaldet DCRD og en negativt ladet helix lige efter IQ-motivet (CaM-interaktionssted) kaldet PCRD. De to spiraler kan danne en struktur, der binder konkurrencedygtigt med CaM for at reducere sandsynligheden for åben tilstand og reducere calciumafhængig hæmning (CDI).
Alternativ splejsning ses også på β -underenhederne for at skabe forskellige isoformer for at give kanaler forskellige egenskaber på grund af palmitoylering og RNA -redigering . Andre former for modulering på β -underenheden inkluderer stigning eller formindskelse af underenhedens ekspression. Dette skyldes det faktum, at β-underenheder øger kanalens åbne sandsynlighed, aktivitet i plasmamembranen og modvirker ubiquitination af kanalen.
L-type calciumkanaler moduleres også af G-proteinkoblede receptorer og det adrenerge nervesystem . Proteinkinase A (PKA) aktiveret af en G-proteinkoblede receptorkaskade kan fosforylere calciumkanaler af L-type, efter at kanaler danner et signalkompleks med A-Kinase-forankringsproteiner (AKAP'er) , for at øge calciumstrømmen gennem kanalen og øge åben tilstandssandsynlighed og en accelereret genopretningsperiode. Aktiveret phospholipase C (PLC) fra G-proteinkoblede receptorer kan nedbryde polyphosphoinositider for at reducere kanalernes calciumstrøm med 20%-30%.
Det adrenerge nervesystem har vist sig at modulere calciumkanaler af L-typen ved at spalte det C-terminale fragment, når den β-adrenerge receptor stimuleres til at øge aktiveringen af kanalerne.
Gener
Se også
Referencer
Yderligere læsning
- Takahashi K, Hayashi S, Miyajima M, Omori M, Wang J, Kaihara K, et al. (Maj 2019). "L-type calciumkanal modulerer mekanosensitiviteten af kardiomyocytcellelinjen H9c2" . Celle Calcium . 79 : 68–74. doi : 10.1016/j.ceca.2019.02.008 . PMID 30836292 .
Denne artikel indeholder tekst fra United States National Library of Medicine , som er offentligt tilhørende .
eksterne links
- "Spændingsgatede calciumkanaler" . IUPHAR Database over receptorer og ionkanaler . International Union of Basic and Clinical Pharmacology.
- L-Type+Calcium+Channel på US National Library of Medicine Medical Subject Headings (MeSH)