Leukæmi - Leukemia
| Leukæmi | |
|---|---|
| Andre navne | Leukæmi |
 | |
| En Wrights farvede knoglemarvsaspirat smear fra en person med B-celle akut lymfoblastisk leukæmi . | |
| Udtale | |
| Specialitet | Hæmatologi og onkologi |
| Symptomer | Blødning, blå mærker , træthed , feber, øget risiko for infektioner |
| Almindelig start | Alle aldre, mest almindelige i 60'erne og 70'erne. Det er den mest almindelige ondartede kræftsygdom hos børn, men helbredelsesgraden er også højere for dem. |
| Årsager | Arvelige og miljømæssige faktorer |
| Risikofaktorer | Rygning , familiehistorie, ioniserende stråling , nogle kemikalier, tidligere kemoterapi, Downs syndrom . |
| Diagnostisk metode | Blodprøver , knoglemarvsbiopsi |
| Behandling | Kemoterapi , strålebehandling , målrettet terapi , knoglemarvstransplantation , understøttende pleje |
| Prognose | Fem års overlevelse 57% (USA) |
| Frekvens | 2,3 millioner (2015) |
| Dødsfald: Døde | 353.500 (2015) |
Leukæmi , også kendt som leukæmi , er en gruppe af blodkræftformer, der normalt begynder i knoglemarven og resulterer i et stort antal unormale blodlegemer . Disse blodlegemer er ikke fuldt udviklede og kaldes blaster eller leukæmiceller . Symptomer kan omfatte blødning og blå mærker , knoglesmerter, træthed , feber og øget risiko for infektioner. Disse symptomer opstår på grund af mangel på normale blodlegemer . Diagnosen stilles typisk ved blodprøver eller knoglemarvsbiopsi .
Den nøjagtige årsag til leukæmi er ukendt. En kombination af genetiske faktorer og miljømæssige (ikke-nedarvede) faktorer menes at spille en rolle. Risikofaktorer omfatter rygning , ioniserende stråling , nogle kemikalier (såsom benzen ), tidligere kemoterapi og Downs syndrom . Mennesker med en familiehistorie af leukæmi har også en højere risiko. Der er fire hovedtyper af leukæmi - akut lymfoblastisk leukæmi (ALL), akut myeloid leukæmi (AML), kronisk lymfatisk leukæmi (CLL) og kronisk myeloid leukæmi (CML) - samt en række mindre almindelige typer. Leukemier og lymfomer tilhører begge en bredere gruppe af tumorer, der påvirker blod, knoglemarv og lymfesystem , kendt som tumorer i det hæmatopoietiske og lymfoide væv .
Behandling kan indebære en kombination af kemoterapi , strålebehandling , målrettet terapi og knoglemarvstransplantation ud over understøttende pleje og palliativ pleje efter behov. Visse typer leukæmi kan håndteres med vågent ventetid . Behandlingens succes afhænger af typen af leukæmi og personens alder. Resultaterne er blevet bedre i den udviklede verden. Fem års overlevelse er 57% i USA. Hos børn under 15 år er den femårige overlevelsesrate større end 60% eller endda 90%, afhængigt af typen af leukæmi. Hos børn med akut leukæmi, der er kræftfrie efter fem år, er det usandsynligt , at kræften vender tilbage .
I 2015 var leukæmi til stede hos 2,3 millioner mennesker verden over og forårsagede 353.500 dødsfald. I 2012 blev det nyudviklet hos 352.000 mennesker. Det er den mest almindelige kræftform hos børn, hvor tre fjerdedele af leukæmi tilfælde hos børn er den akutte lymfoblastiske type. Imidlertid diagnosticeres over 90% af alle leukæmier hos voksne, hvor CLL og AML er mest almindelige hos voksne. Det forekommer mere almindeligt i den udviklede verden .
Klassifikation
| Celletype | Spids | Kronisk |
|---|---|---|
|
Lymfocytisk leukæmi (eller "lymfoblastisk") |
Akut lymfoblastisk leukæmi (ALL) |
Kronisk lymfatisk leukæmi (CLL) |
|
Myelogen leukæmi ("myeloid" eller "ikke -lymfocytisk") |
Akut myelogen leukæmi (AML eller myeloblastisk) |
Kronisk myelogen leukæmi (CML) |
Generel klassificering
Klinisk og patologisk er leukæmi opdelt i en række store grupper. Den første opdeling er mellem dens akutte og kroniske former:
- Akut leukæmi er kendetegnet ved en hurtig stigning i antallet af umodne blodlegemer. Trængsel, der skyldes sådanne celler, gør knoglemarven ude af stand til at producere sunde blodlegemer, hvilket resulterer i lavt hæmoglobin og lave blodplader . Øjeblikkelig behandling er påkrævet ved akut leukæmi på grund af den hurtige progression og akkumulering af de maligne celler , som derefter vælter ind i blodbanen og spredes til andre organer i kroppen. Akutte former for leukæmi er de mest almindelige former for leukæmi hos børn .
- Kronisk leukæmi er kendetegnet ved overdreven opbygning af relativt modne, men stadig unormale, hvide blodlegemer. Normalt tager det måneder eller år at udvikle sig, cellerne produceres med en meget højere hastighed end normalt, hvilket resulterer i mange unormale hvide blodlegemer. Mens akut leukæmi skal behandles med det samme, overvåges kroniske former undertiden i nogen tid før behandlingen for at sikre maksimal effektivitet af behandlingen. Kronisk leukæmi forekommer for det meste hos ældre mennesker, men kan forekomme i enhver aldersgruppe.
Desuden er sygdommene opdelt efter, hvilken type blodlegemer der påvirkes. Dette opdeler leukæmier i lymfoblastiske eller lymfocytiske leukæmier og myeloide eller myelogene leukæmier :
- Ved lymfoblastiske eller lymfocytiske leukæmier finder kræftændringen sted i en type marvcelle, der normalt fortsætter med at danne lymfocytter , som er infektionsbekæmpende immunsystemceller. De fleste lymfocytiske leukæmier involverer en specifik undertype af lymfocyt, B -cellen .
- Ved myeloide eller myelogene leukæmier finder kræftændringen sted i en type marvcelle, der normalt fortsætter med at danne røde blodlegemer , nogle andre typer hvide blodlegemer og blodplader .
Kombination af disse to klassifikationer giver i alt fire hovedkategorier. Inden for hver af disse hovedkategorier er der typisk flere underkategorier. Endelig betragtes nogle sjældnere typer normalt uden for denne klassificeringsordning.
Specifikke typer
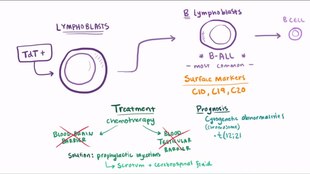
- Akut lymfoblastisk leukæmi (ALL) er den mest almindelige type leukæmi hos små børn. Det påvirker også voksne, især de 65 og ældre. Standardbehandlinger omfatter kemoterapi og strålebehandling . Undertyper omfatter prækursor B akut lymfoblastisk leukæmi , forløber T akut lymfoblastisk leukæmi , Burkitts leukæmi og akut bifenotypisk leukæmi . Mens de fleste tilfælde af ALL forekommer hos børn, forekommer 80% af dødsfaldene fra ALL hos voksne.
- Kronisk lymfatisk leukæmi (CLL) rammer oftest voksne over 55 år. Det forekommer nogle gange hos yngre voksne, men det påvirker næsten aldrig børn. To tredjedele af de berørte mennesker er mænd. Den femårige overlevelsesrate er 85%. Det er uhelbredeligt, men der er mange effektive behandlinger. En undertype er B-celle prolymfocytisk leukæmi , en mere aggressiv sygdom.
- Akut myelogen leukæmi (AML) forekommer langt mere almindeligt hos voksne end hos børn og mere almindeligt hos mænd end kvinder. Det behandles med kemoterapi. Den femårige overlevelsesrate er 20%. Undertyper af AML omfatter akut promyelocytisk leukæmi , akut myeloblastisk leukæmi og akut megakaryoblastisk leukæmi .
- Kronisk myelogen leukæmi (CML) forekommer hovedsageligt hos voksne; et meget lille antal børn udvikler også denne sygdom. Det behandles med imatinib (Gleevec i USA, Glivec i Europa) eller andre lægemidler. Den femårige overlevelsesrate er 90%. En undertype er kronisk myelomonocytisk leukæmi .
- Hårcelleleukæmi (HCL) betragtes undertiden som en undergruppe af kronisk lymfatisk leukæmi, men passer ikke pænt ind i denne kategori. Omkring 80% af de berørte mennesker er voksne mænd. Der er ikke rapporteret tilfælde hos børn. HCL er uhelbredelig, men let behandles. Overlevelse er 96% til 100% efter ti år.
- T-celle prolymfocytisk leukæmi (T-PLL) er en meget sjælden og aggressiv leukæmi, der rammer voksne; noget flere mænd end kvinder diagnosticeres med denne sygdom. På trods af dens generelle sjældenhed er det den mest almindelige type moden T -celle leukæmi; næsten alle andre leukæmier involverer B -celler . Det er svært at behandle, og medianoverlevelsen måles i måneder.
- Stor granulær lymfatisk leukæmi kan involvere enten T-celler eller NK-celler ; ligesom hårcelleleukæmi, der udelukkende involverer B -celler, er det en sjælden og sløv (ikke aggressiv) leukæmi.
- Voksen T-celle leukæmi er forårsaget af humant T-lymfotropisk virus (HTLV), en virus, der ligner HIV . Ligesom HIV inficerer HTLV CD4+ T-celler og replikerer i dem; i modsætning til hiv ødelægger det dem imidlertid ikke. I stedet "foreviger" HTLV de inficerede T-celler, hvilket giver dem mulighed for at formere sig unormalt. Humane T-celle lymfotropiske virustyper I og II (HTLV-I/II) er endemiske i visse områder af verden.
- Klonale eosinofilier (også kaldet klonale hypereosinofilier ) er en gruppe af blodsygdomme karakteriseret ved vækst af eosinofiler i knoglemarv , blod og/eller andre væv. De kan være præ-kræft eller kræft . Klonale eosinofili involverer en "klon" af eosinofiler, dvs. en gruppe genetisk identiske eosinofiler, der alle voksede fra den samme muterede stamcelle. Disse lidelser kan udvikle sig til kronisk eosinofil leukæmi eller kan være forbundet med forskellige former for myeloide neoplasmer, lymfoide neoplasmer, myelofibrose eller myelodysplastisk syndrom .
Pre-leukæmi
- Forbigående myeloproliferativ sygdom , også kaldet forbigående leukæmi, involverer den unormale spredning af en klon af ikke-kræftformede megakaryoblaster . Sygdommen er begrænset til personer med Downs syndrom eller genetiske ændringer, der ligner dem i Downs syndrom, udvikler sig hos en baby under graviditeten eller kort efter fødslen og forsvinder inden for 3 måneder eller i ~ 10% af tilfældene udvikler sig til akut megakaryoblastisk leukæmi . Forbigående myeloid leukæmi er en præ-leukæmisk tilstand.
tegn og symptomer
De mest almindelige symptomer hos børn er let blå mærker , lys hud , feber og en forstørret milt eller lever .
Skader på knoglemarven ved at fortrænge de normale knoglemarvsceller med et større antal umodne hvide blodlegemer resulterer i mangel på blodplader , som er vigtige i blodkoagulationsprocessen . Det betyder, at mennesker med leukæmi let kan blive blå mærker , bløde for meget eller udvikle pinchblødninger ( petechiae ).
Hvide blodlegemer , der er involveret i bekæmpelse af patogener , kan være undertrykt eller dysfunktionel. Dette kan få personens immunsystem til ikke at kunne bekæmpe en simpel infektion eller begynde at angribe andre kropsceller. Fordi leukæmi forhindrer immunsystemet i at fungere normalt, oplever nogle mennesker hyppig infektion , lige fra inficerede mandler , sår i munden eller diarré til livstruende lungebetændelse eller opportunistiske infektioner .
Endelig fører den røde blodlegememangel til anæmi , som kan forårsage dyspnø og bleghed .
Nogle mennesker oplever andre symptomer, såsom at føle sig syg , have feber, kuldegysninger, nattesved, føle sig træt og andre influenzalignende symptomer . Nogle mennesker oplever kvalme eller en følelse af fylde på grund af en forstørret lever og milt ; dette kan resultere i utilsigtet vægttab . Blaster, der er ramt af sygdommen, kan komme sammen og blive hævede i leveren eller i lymfeknuderne, der forårsager smerter og fører til kvalme.
Hvis de leukæmiske celler invaderer centralnervesystemet , kan der opstå neurologiske symptomer (især hovedpine ). Usædvanlige neurologiske symptomer som migræne , anfald eller koma kan forekomme som følge af hjernestamstryk. Alle symptomer forbundet med leukæmi kan tilskrives andre sygdomme. Derfor er leukæmi altid diagnosticeret gennem medicinske tests .
Ordet leukæmi , som betyder 'hvidt blod', stammer fra det karakteristiske høje antal hvide blodlegemer, der forekommer hos de fleste ramte før behandlingen. Det høje antal hvide blodlegemer er tydeligt, når en blodprøve ses under et mikroskop , hvor de ekstra hvide blodlegemer ofte er umodne eller dysfunktionelle. Det for store antal celler kan også forstyrre niveauet af andre celler og forårsage yderligere skadelig ubalance i blodtalet.
Nogle mennesker med diagnosen leukæmi har ikke et højt antal hvide blodlegemer synlige under et normalt blodtal. Denne mindre almindelige tilstand kaldes aleukæmi . Knoglemarven indeholder stadig kræft hvide blodlegemer, der forstyrrer den normale produktion af blodlegemer, men de forbliver i marven i stedet for at komme ind i blodbanen, hvor de ville være synlige i en blodprøve. For en person med aleukæmi kan antallet af hvide blodlegemer i blodbanen være normalt eller lavt. Aleukæmi kan forekomme i enhver af de fire hovedtyper af leukæmi og er særlig almindelig ved hårcelleleukæmi .
Årsager
Der er ingen kendt årsag til nogen af de forskellige typer leukæmier. De få kendte årsager, som generelt ikke er faktorer inden for den gennemsnitlige persons kontrol, tegner sig for relativt få tilfælde. Årsagen til de fleste tilfælde af leukæmi er ukendt. De forskellige leukæmier har sandsynligvis forskellige årsager.
Leukæmi, ligesom andre kræftformer, skyldes mutationer i DNA . Visse mutationer kan udløse leukæmi ved at aktivere onkogener eller deaktivere tumorsuppressorgener og derved forstyrre reguleringen af celledød, differentiering eller division. Disse mutationer kan forekomme spontant eller som følge af udsættelse for stråling eller kræftfremkaldende stoffer.
Blandt voksne er de kendte årsager naturlig og kunstig ioniserende stråling og nogle kemikalier, især benzen og alkylerende kemoterapimidler til tidligere maligniteter. Brug af tobak er forbundet med en lille stigning i risikoen for at udvikle akut myeloid leukæmi hos voksne. Cohort- og case-control undersøgelser har knyttet eksponering for nogle petrokemikalier og hårfarver til udviklingen af nogle former for leukæmi. Kost har meget begrænset eller ingen effekt, selvom at spise flere grøntsager kan give en lille beskyttende fordel.
Virus har også været forbundet med nogle former for leukæmi. For eksempel forårsager humant T-lymfotropisk virus (HTLV-1) voksen T-celle leukæmi .
Et par tilfælde af moder-føtal overførsel (en baby får leukæmi, fordi moderen havde leukæmi under graviditeten) er blevet rapporteret. Børn født af mødre, der bruger fertilitetslægemidler til at fremkalde ægløsning, er mere end dobbelt så tilbøjelige til at udvikle leukæmi i løbet af deres barndom end andre børn.
Stråling
Store doser af Sr-90- emission fra atomreaktorulykker , tilnavnet knoglesøgende øger risikoen for knoglekræft og leukæmi hos dyr og formodes at gøre det hos mennesker.
Genetiske forhold
Nogle mennesker har en genetisk disposition for at udvikle leukæmi. Denne disposition fremgår af familiehistorier og tvillingestudier . De berørte mennesker kan have et enkelt gen eller flere gener til fælles. I nogle tilfælde har familier en tendens til at udvikle de samme former for leukæmi som andre medlemmer; i andre familier kan berørte mennesker udvikle forskellige former for leukæmi eller relaterede blodkræftformer .
Ud over disse genetiske problemer har mennesker med kromosomale abnormiteter eller visse andre genetiske tilstande større risiko for leukæmi. For eksempel har mennesker med Downs syndrom en signifikant øget risiko for at udvikle former for akut leukæmi (især akut myeloid leukæmi ), og Fanconi -anæmi er en risikofaktor for at udvikle akut myeloid leukæmi. Mutation i SPRED1 -genet har været forbundet med en disposition for leukæmi i barndommen.
Kronisk myelogen leukæmi er forbundet med en genetisk abnormitet kaldet Philadelphia -translokationen ; 95% af mennesker med CML bærer Philadelphia -mutationen, selvom dette ikke er eksklusivt for CML og kan observeres hos mennesker med andre former for leukæmi.
Ikke-ioniserende stråling
Hvorvidt ikke-ioniserende stråling forårsager leukæmi er blevet undersøgt i flere årtier. Det Internationale Agentur for Kræftforskning ekspertgruppe foretog en detaljeret gennemgang af alle data på statiske og ekstremt lavfrekvente elektromagnetiske energi, der forekommer naturligt og i tilknytning til produktion, transmission og brug af elektrisk strøm. De konkluderede, at der er begrænset bevis for, at høje niveauer af ELF magnetiske (men ikke elektriske) felter kan forårsage nogle tilfælde af leukæmi hos børn . Der er ikke påvist bevis for et forhold til leukæmi eller en anden form for malignitet hos voksne. Da eksponering for sådanne niveauer af ELF'er er relativt usædvanlig, konkluderer Verdenssundhedsorganisationen , at ELF -eksponering, hvis det senere viser sig at være årsagssammenhængende, udgør kun 100 til 2400 tilfælde på verdensplan hvert år, hvilket repræsenterer 0,2 til 4,9% af den samlede forekomst af barndom leukæmi for det år (ca. 0,03 til 0,9% af alle leukæmier).
Diagnose
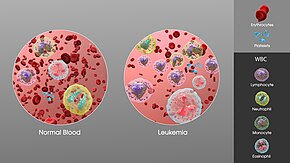
Diagnosen er normalt baseret på gentagne komplette blodtællinger og en knoglemarvsundersøgelse efter observationer af symptomerne. Nogle gange viser blodprøver muligvis ikke, at en person har leukæmi, især i de tidlige stadier af sygdommen eller under remission. En lymfeknudebiopsi kan udføres for at diagnosticere visse typer leukæmi i visse situationer.
Efter diagnosen kan blodkemitest bruges til at bestemme graden af lever- og nyreskader eller virkningerne af kemoterapi på personen. Når der opstår bekymringer om andre skader på grund af leukæmi, kan læger bruge røntgen , MR eller ultralyd . Disse kan potentielt vise leukæmiens virkninger på sådanne kropsdele som knogler (røntgen), hjernen (MRI) eller nyrerne, milten og leveren (ultralyd). CT -scanninger kan bruges til at kontrollere lymfeknuder i brystet, selvom dette er ualmindeligt.
På trods af brugen af disse metoder til at diagnosticere, om en person har leukæmi eller ej, er mange mennesker ikke blevet diagnosticeret, fordi mange af symptomerne er vage, uspecifikke og kan referere til andre sygdomme. Af denne grund anslår American Cancer Society, at mindst en femtedel af mennesker med leukæmi endnu ikke er blevet diagnosticeret.
Behandling
De fleste former for leukæmi behandles med farmaceutisk medicin , typisk kombineret til en kemoterapibehandling med flere lægemidler . Nogle behandles også med strålebehandling . I nogle tilfælde er en knoglemarvstransplantation effektiv.
Akut lymfoblastisk
Håndteringen af ALL er rettet mod kontrol af knoglemarv og systemisk (helkropssygdom). Derudover skal behandlingen forhindre leukæmiceller i at sprede sig til andre steder, især centralnervesystemet (CNS) f.eks. Månedlige lumbale punkteringer. Generelt er AL behandling opdelt i flere faser:
- Induktionskemoterapi for at medføre knoglemarvsmission. For voksne omfatter standardinduktionsplaner prednison , vincristin og et antracyklinlægemiddel ; andre lægemiddelplaner kan omfatte L-asparaginase eller cyclophosphamid . For børn med lavrisiko ALL består standardterapi normalt af tre lægemidler (prednison, L-asparaginase og vincristin) i den første behandlingsmåned.
- Konsolideringsterapi eller intensiveringsterapi for at fjerne eventuelle resterende leukæmiceller. Der er mange forskellige tilgange til konsolidering, men det er typisk en højdosis, multilægemiddelbehandling, der gennemføres i et par måneder. Mennesker med ALLE med lav til gennemsnitlig risiko får behandling med antimetabolitlægemidler som methotrexat og 6-mercaptopurin (6-MP). Mennesker med høj risiko får højere lægemiddeldoser af disse lægemidler plus yderligere lægemidler.
- CNS-profylakse (forebyggende behandling) for at forhindre kræft i at sprede sig til hjernen og nervesystemet hos mennesker med høj risiko. Standard profylakse kan omfatte stråling af hovedet og/eller medicin leveret direkte ind i rygsøjlen.
- Vedligeholdelsesbehandlinger med kemoterapeutiske lægemidler for at forhindre tilbagefald af sygdom, når der er opnået remission. Vedligeholdelsesbehandling indebærer normalt lavere lægemiddeldoser og kan fortsætte i op til tre år.
- Alternativt kan allogen knoglemarvstransplantation være passende for personer med høj risiko eller tilbagefald.
Kronisk lymfocyt
Beslutning om behandling
Hæmatologer baserer CLL -behandling på både den enkelte persons scene og symptomer. En stor gruppe mennesker med CLL har sygdomme af lav kvalitet, som ikke nyder godt af behandling. Personer med CLL-relaterede komplikationer eller mere avanceret sygdom har ofte fordel af behandling. Generelt er indikationerne for behandling:
- Faldende hæmoglobin eller blodplade tælling
- Fremgang til et senere stadium af sygdommen
- Smertefuld, sygdomsrelateret tilgroning af lymfeknuder eller milt
- En stigning i hastigheden af lymfocyt produktion
Behandlingsmetode
De fleste CLL -tilfælde er uhelbredelige ved nuværende behandlinger, så behandlingen er rettet mod at undertrykke sygdommen i mange år frem for at helbrede den. Den primære kemoterapeutiske plan er kombinationskemoterapi med chlorambucil eller cyclophosphamid plus et kortikosteroid som prednison eller prednisolon . Anvendelsen af et kortikosteroid har den yderligere fordel at undertrykke nogle relaterede autoimmune sygdomme, såsom immunhemolytisk anæmi eller immunmedieret trombocytopeni . I resistente tilfælde kan single-agent behandlinger med nukleosidlægemidler som fludarabin , pentostatin eller cladribin være vellykkede. Yngre og sundere mennesker kan vælge allogen eller autolog knoglemarvstransplantation i håb om en permanent kur.
Akut myelogen
Mange forskellige kræftbekæmpende lægemidler er effektive til behandling af AML. Behandlinger varierer noget efter personens alder og efter den specifikke undertype AML. Samlet set er strategien at kontrollere knoglemarv og systemisk (helkropssygdom), samtidig med at der tilbydes specifik behandling for centralnervesystemet (CNS), hvis det er involveret.
Generelt er de fleste onkologer afhængige af kombinationer af lægemidler til den indledende induktionsfase af kemoterapi. En sådan kombination af kemoterapi giver normalt fordelene ved tidlig remission og en lavere risiko for sygdomsresistens. Konsoliderings- og vedligeholdelsesbehandlinger har til formål at forhindre tilbagefald af sygdomme. Konsolideringsbehandling indebærer ofte en gentagelse af induktionskemoterapi eller intensivering af kemoterapi med yderligere lægemidler. Derimod involverer vedligeholdelsesbehandling lægemiddeldoser, der er lavere end dem, der administreres under induktionsfasen.
Kronisk myelogen
Der er mange mulige behandlinger for CML, men plejestandarden for nydiagnosticerede mennesker er imatinib (Gleevec) terapi. Sammenlignet med de fleste kræftbekæmpende lægemidler har det relativt få bivirkninger og kan tages oralt derhjemme. Med dette lægemiddel vil mere end 90% af mennesker kunne holde sygdommen i skak i mindst fem år, så CML bliver en kronisk, håndterbar tilstand.
I en mere avanceret, ukontrolleret tilstand, når personen ikke kan tåle imatinib, eller hvis personen ønsker at prøve en permanent kur, kan der udføres en allogen knoglemarvstransplantation. Denne procedure involverer højdosis kemoterapi og stråling efterfulgt af infusion af knoglemarv fra en kompatibel donor. Ca. 30% af mennesker dør af denne procedure.
Hårcelle
Beslutning om behandling af
mennesker med hårcelleleukæmi, der er symptomfrie, modtager typisk ikke øjeblikkelig behandling. Behandling anses generelt for nødvendig, når personen viser tegn og symptomer såsom lavt antal blodlegemer (f.eks. Infektionsbekæmpende neutrofiltal under 1,0 K/µL), hyppige infektioner, uforklarlige blå mærker, anæmi eller træthed, der er signifikant nok til at forstyrre personens hverdag.
Typisk behandlingsmetode
Folk, der har brug for behandling, modtager normalt enten en uge cladribin , givet dagligt ved intravenøs infusion eller en simpel injektion under huden, eller seks måneders pentostatin , givet hver fjerde uge ved intravenøs infusion. I de fleste tilfælde vil en behandlingsrunde give en langvarig remission.
Andre behandlinger omfatter rituximab infusion eller selvinjektion med Interferon-alpha . I begrænsede tilfælde kan personen have gavn af miltomi (fjernelse af milten). Disse behandlinger gives typisk ikke som den første behandling, fordi deres succesrater er lavere end cladribin eller pentostatin.
T-celle prolymfocytisk
De fleste mennesker med T-celle prolymfocytisk leukæmi, en sjælden og aggressiv leukæmi med en median overlevelse på mindre end et år, kræver øjeblikkelig behandling.
T-celle prolymfocytisk leukæmi er vanskelig at behandle, og den reagerer ikke på de fleste tilgængelige kemoterapeutiske lægemidler. Mange forskellige behandlinger er blevet forsøgt med begrænset succes hos visse mennesker: purinanaloger (pentostatin, fludarabin, cladribin), chlorambucil og forskellige former for kombinationskemoterapi (cyclophosphamid, doxorubicin, vincristin, prednison CHOP , cyclophosphamid, vincristin, prednison [COP] , vincristine, doxorubicin, prednison, etoposid, cyclophosphamid, bleomycin VAPEC-B ). Alemtuzumab (Campath), et monoklonalt antistof, der angriber hvide blodlegemer, er blevet brugt til behandling med større succes end tidligere muligheder.
Nogle mennesker, der med succes reagerer på behandling, gennemgår også stamcelletransplantation for at konsolidere responsen.
Ung myelomonocytisk
Behandling af juvenil myelomonocytisk leukæmi kan omfatte miltomi , kemoterapi og knoglemarvstransplantation .
Tænder
Inden tandlægearbejde anbefales det at konsultere personens læge. Tandlægearbejde anbefales inden kemoterapi eller strålebehandling. Dem i remission kan behandles normalt.
Prognose
Behandlingens succes afhænger af typen af leukæmi og personens alder. Resultaterne er blevet bedre i den udviklede verden. Den gennemsnitlige femårige overlevelsesrate er 61% i USA. Hos børn under 15 år er den femårige overlevelsesrate større (60 til 85%), afhængigt af typen af leukæmi. Hos børn med akut leukæmi, der er kræftfrie efter fem år, er det usandsynligt, at kræften vender tilbage.
Resultaterne afhænger af, om det er akut eller kronisk, den specifikke unormale type hvide blodlegemer, tilstedeværelsen og sværhedsgraden af anæmi eller trombocytopeni , graden af vævsabnormalitet, tilstedeværelsen af metastase og lymfeknuder og knoglemarvsinfiltration , tilgængelighed af behandlinger og sundhedsvæsenets kompetencer. Behandlingsresultater kan være bedre, når mennesker behandles på større centre med større erfaring.
Epidemiologi
I 2010 døde globalt cirka 281.500 mennesker af leukæmi. I 2000 udviklede cirka 256.000 børn og voksne rundt om i verden en form for leukæmi, og 209.000 døde af det. Dette repræsenterer omkring 3% af de næsten syv millioner dødsfald på grund af kræft det år og ca. 0,35% af alle dødsfald som følge af enhver årsag. Af de seksten forskellige steder, kroppen sammenlignede, var leukæmi den 12. mest almindelige klasse af neoplastisk sygdom og den 11. mest almindelige årsag til kræftrelateret død. Leukæmi forekommer mere almindeligt i den udviklede verden .
Forenede Stater
Omkring 245.000 mennesker i USA er ramt af en eller anden form for leukæmi, herunder dem, der har opnået remission eller helbredelse. Satserne fra 1975 til 2011 er steget med 0,7% om året blandt børn. Ca. 44.270 nye tilfælde af leukæmi blev diagnosticeret i 2008 i USA. Dette repræsenterer 2,9% af alle kræftformer (undtagen simple kræftformer i basalceller og pladeceller) i USA og 30,4% af alle blodkræftformer .
Blandt børn med en eller anden form for kræft har omkring en tredjedel en type leukæmi, oftest akut lymfoblastisk leukæmi . En type leukæmi er den næsthyppigste kræftform hos spædbørn (under 12 måneder) og den mest almindelige kræftform hos ældre børn. Drenge er noget mere tilbøjelige til at udvikle leukæmi end piger, og hvide amerikanske børn er næsten dobbelt så tilbøjelige til at udvikle leukæmi end sorte amerikanske børn. Kun omkring 3% kræftdiagnoser blandt voksne er for leukæmier, men fordi kræft er meget mere almindelig blandt voksne, diagnosticeres mere end 90% af alle leukæmier hos voksne.
Race er en risikofaktor i USA. Hispanics , især dem under 20 år, har størst risiko for leukæmi, mens hvide , indianere , asiatiske amerikanere og indfødte i Alaska har større risiko end afroamerikanere .
Flere mænd end kvinder får diagnosen leukæmi og dør af sygdommen. Omkring 30 procent flere mænd end kvinder har leukæmi.
Storbritannien
Samlet set er leukæmi den ellevte mest almindelige kræft i Storbritannien (omkring 8.600 mennesker blev diagnosticeret med sygdommen i 2011), og det er den niende mest almindelige årsag til kræftdød (omkring 4.800 mennesker døde i 2012).
Historie
Leukæmi blev først beskrevet af anatom og kirurg Alfred-Armand-Louis-Marie Velpeau i 1827. En mere fuldstændig beskrivelse blev givet af patolog Rudolf Virchow i 1845. Omkring ti år efter Virchows fund fandt patolog Franz Ernst Christian Neumann , at knoglemarven på en afdød person med leukæmi blev farvet "snavset grøn-gul" i modsætning til den normale røde. Dette fund gjorde det muligt for Neumann at konkludere, at et knoglemarvsproblem var ansvarlig for det unormale blod hos mennesker med leukæmi.
I 1900 blev leukæmi betragtet som en familie af sygdomme i modsætning til en enkelt sygdom. I 1947 troede Boston -patolog Sidney Farber fra tidligere forsøg, at aminopterin , en folinsyre efterligner, potentielt kunne helbrede leukæmi hos børn. Størstedelen af de børn med ALLE, der blev testet, viste tegn på forbedring i deres knoglemarv, men ingen af dem blev faktisk helbredt. Dette førte imidlertid til yderligere forsøg.
I 1962 brugte forskerne Emil J. Freireich, Jr. og Emil Frei III kombinationskemoterapi til at forsøge at helbrede leukæmi. Testene lykkedes med nogle mennesker, der overlevede længe efter testene.
Etymologi
Iagttagelse af et unormalt stort antal hvide blodlegemer i en blodprøve fra en person kaldte Virchow tilstanden Leukämie på tysk , som han dannede af de to græske ord leukos ( λευκός ), der betyder "hvid" og haima ( αἷμα ), hvilket betyder "blod".
Samfund og kultur
Ifølge Susan Sontag blev leukæmi ofte romantiseret i fiktion fra det 20. århundrede, fremstillet som en ren og glædelig sygdom, hvis retfærdige, uskyldige og milde ofre dør unge eller på det forkerte tidspunkt. Som sådan var det den kulturelle efterfølger til tuberkulose , der havde denne kulturelle position, indtil det blev opdaget at være en infektionssygdom. Romantikromanen Love Story fra 1970 er et eksempel på denne romantisering af leukæmi.
I USA bruges omkring 5,4 milliarder dollar på behandling om året.
Forskningsretninger
Der foretages betydelig forskning i årsager, forekomst, diagnose, behandling og prognose for leukæmi. Hundredvis af kliniske forsøg planlægges eller udføres på et givet tidspunkt. Undersøgelser kan fokusere på effektive behandlingsmidler, bedre måder at behandle sygdommen på, forbedre livskvaliteten for mennesker eller passende pleje i remission eller efter helbredelse.
Generelt er der to typer leukæmiforskning: klinisk eller translationel forskning og grundforskning . Klinisk/translationel forskning fokuserer på at studere sygdommen på en defineret og generelt umiddelbart anvendelig måde, såsom at teste et nyt lægemiddel hos mennesker. Derimod studerer videnskabelig grundforskning sygdomsprocessen på afstand, såsom at se, om et mistænkt kræftfremkaldende stof kan forårsage leukæmiske ændringer i isolerede celler i laboratoriet, eller hvordan DNA ændrer sig inde i leukæmiceller, efterhånden som sygdommen skrider frem. Resultaterne fra grundforskningsundersøgelser er generelt mindre umiddelbart nyttige for mennesker med sygdommen.
Behandling gennem genterapi forfølges i øjeblikket. En sådan fremgangsmåde anvendte genetisk modificerede T-celler , kendt som kimære antigenreceptor-T-celler (CAR-T-celler), til at angribe kræftceller. I 2011, et år efter behandlingen, blev to af de tre personer med fremskreden kronisk lymfatisk leukæmi rapporteret at være kræftfri, og i 2013 rapporteredes tre af fem personer, der havde akut lymfatisk leukæmi, at være i remission i fem måneder til to år . Efterfølgende undersøgelser med en række forskellige CAR-T-typer er fortsat lovende. Fra 2018 er to CAR-T-behandlinger blevet godkendt af Food and Drug Administration . CAR-T-behandling har betydelige bivirkninger, og tab af antigenet, som CAR-T-cellerne er målrettet mod, er en fælles mekanisme for tilbagefald. Stamcellerne, der forårsager forskellige typer leukæmi, undersøges også.
Graviditet
Leukæmi er sjældent forbundet med graviditet, og rammer kun ca. 1 ud af 10.000 gravide. Hvordan det håndteres afhænger primært af typen af leukæmi. Næsten alle leukæmier, der forekommer hos gravide, er akutte leukæmier. Akutte leukæmier kræver normalt hurtig, aggressiv behandling på trods af betydelige risici for graviditetstab og fosterskader , især hvis kemoterapi gives i den udviklingsfølsomme første trimester . Kronisk myelogen leukæmi kan behandles med relativ sikkerhed når som helst under graviditeten med interferon-alfa- hormoner. Behandling af kroniske lymfocytiske leukæmier, som er sjældne hos gravide, kan ofte udskydes til efter graviditetens afslutning.
Se også
- Akut erythroid leukæmi
- Antileukæmiske lægemidler , medicin, der bruges til at dræbe leukæmiceller
- Kræftrelateret træthed
- Hæmatologiske sygdomme , den store klasse af blodrelaterede lidelser, herunder leukæmi
- Multipelt myelom
Referencer
eksterne links
| Klassifikation | |
|---|---|
| Eksterne ressourcer |
|