Lungekræft -Lung cancer
| Lungekræft | |
|---|---|
| Andre navne | Lungekarcinom |
 | |
| Et røntgenbillede af thorax , der viser en tumor i lungen (markeret med pil) | |
| Specialitet | Onkologi , pulmonologi |
| Symptomer | Hoste (inklusive ophostning af blod ), vægttab , åndenød , brystsmerter |
| Sædvanlig begyndelse | ~70 år |
| Typer | Småcellet lungekarcinom (SCLC), ikke-småcellet lungekarcinom (NSCLC) |
| Risikofaktorer | |
| Diagnostisk metode | Medicinsk billeddannelse , vævsbiopsi |
| Forebyggelse | Ikke rygning, undgå radongas , asbest , passiv rygning eller andre former for eksponering for luftforurening . |
| Behandling | Kirurgi , kemoterapi , strålebehandling |
| Prognose | Fem-års overlevelsesrate : 10 til 20% (de fleste lande), 33% (Japan), 27% (Israel), 25% (Republikken Korea) |
| Frekvens | 3,3 millioner berørt fra 2015 |
| Dødsfald: Døde | 1,8 millioner (2020) |
Lungekræft , også kendt som lungekarcinom , da omkring 98-99% af alle lungekræftformer er karcinomer, er en ondartet lungetumor karakteriseret ved ukontrolleret cellevækst i lungevæv . Lungecarcinomer stammer fra transformerede, ondartede celler, der stammer fra epitelceller, eller fra væv sammensat af epitelceller. Andre lungekræftformer, såsom de sjældne sarkomer i lungen, genereres af den ondartede transformation af bindevæv (dvs. nerve, fedt, muskler, knogler), som opstår fra mesenkymale celler. Lymfomer og melanomer (fra lymfoid- og melanocytcellelinjer) kan også sjældent resultere i lungekræft.
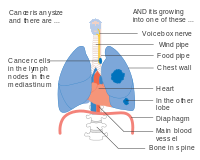
Med tiden kan denne ukontrollerede vækst spredes ud over lungen – enten ved direkte forlængelse, ved at komme ind i lymfekredsløbet eller via den hæmatogene, blodbårne spredning – processen kaldet metastase – ind i nærliggende væv eller andre, fjernere dele af kroppen. De fleste kræftformer , der starter i lungerne, kendt som primær lungekræft, er karcinomer . De to hovedtyper er småcellet lungekarcinom (SCLC) og ikke-småcellet lungekarcinom (NSCLC). De mest almindelige symptomer er hoste (inklusive ophostning af blod ), vægttab, åndenød og brystsmerter .
Langt de fleste (85%) af tilfældene af lungekræft skyldes langvarig tobaksrygning . Omkring 10-15% af tilfældene forekommer hos personer, der aldrig har røget. Disse tilfælde er ofte forårsaget af en kombination af genetiske faktorer og eksponering for radongas , asbest , passiv rygning eller andre former for luftforurening . Lungekræft kan ses på røntgenbilleder af thorax og computertomografi (CT) scanninger. Diagnosen bekræftes ved biopsi , som normalt udføres ved bronkoskopi eller CT-vejledning.
Den vigtigste metode til forebyggelse er at undgå risikofaktorer, herunder rygning og luftforurening. Behandling og langsigtede resultater afhænger af kræfttypen, stadiet (spredningsgraden) og personens generelle helbred. De fleste tilfælde kan ikke helbredes. Almindelige behandlinger omfatter kirurgi , kemoterapi og strålebehandling . NSCLC behandles nogle gange med kirurgi, hvorimod SCLC normalt reagerer bedre på kemoterapi og strålebehandling.
På verdensplan i 2020 forekom lungekræft hos 2,2 millioner mennesker og resulterede i 1,8 millioner dødsfald. Det er den hyppigste årsag til kræftrelateret død hos både mænd og kvinder. Den mest almindelige alder ved diagnosen er 70 år. I de fleste lande er den femårige overlevelsesrate omkring 10 til 20 %, mens den i Japan er 33 %, i Israel 27 % og i Republikken Korea 25 %. Resultaterne er typisk værre i udviklingslandene.
tegn og symptomer
Tegn og symptomer, der kan tyde på lungekræft omfatter:
- Luftvejssymptomer: hoste , hoste blod op , hvæsende vejrtrækning eller åndenød
- Systemiske symptomer: vægttab, svaghed , feber eller klumper af neglene
- Symptomer på grund af kræftmassen, der presser på tilstødende strukturer: brystsmerter , knoglesmerter , obstruktion af vena cava superior eller synkebesvær
Hvis kræften vokser i luftvejene , kan den blokere luftstrømmen og forårsage åndedrætsbesvær. Obstruktionen kan også føre til ophobning af sekret bag blokeringen og øge risikoen for lungebetændelse .
Mange af symptomerne på lungekræft (dårlig appetit, vægttab, feber, træthed) er ikke specifikke. Hos mange mennesker har kræften allerede spredt sig ud over det oprindelige sted, når de har symptomer og søger lægehjælp. Symptomer, der tyder på tilstedeværelsen af metastatisk sygdom, omfatter vægttab, knoglesmerter og neurologiske symptomer (hovedpine, besvimelse , kramper eller svaghed i lemmer). Fælles steder for spredning omfatter hjernen, knoglerne, binyrerne , modsatte lunger, lever , hjertesækken og nyrer . Omkring 10 % af mennesker med lungekræft har ikke symptomer ved diagnosen; disse kræftformer findes i øvrigt ved rutinemæssig røntgen af thorax .
Afhængigt af typen af tumor kan paraneoplastiske fænomener – symptomer, der ikke skyldes den lokale tilstedeværelse af kræft – i begyndelsen tiltrække opmærksomhed på sygdommen. I lungekræft kan disse fænomener omfatte hypercalcæmi , syndrom af uhensigtsmæssigt antidiuretisk hormon (unormalt koncentreret urin og fortyndet blod), ektopisk ACTH - produktion eller Lambert-Eatons myastheniske syndrom (muskelsvaghed på grund af autoantistoffer ). Tumorer i toppen af lungen , kendt som Pancoast-tumorer , kan invadere den lokale del af det sympatiske nervesystem , hvilket resulterer i Horners syndrom (tab af øjenlåget og en lille pupil på den side) samt beskadigelse af plexus brachialis .
Årsager
Kræft udvikler sig efter genetiske skader på DNA og epigenetiske ændringer. Disse ændringer påvirker cellens normale funktioner , herunder celleproliferation , programmeret celledød ( apoptose ) og DNA-reparation . Efterhånden som flere skader akkumuleres, øges risikoen for kræft.
Rygning
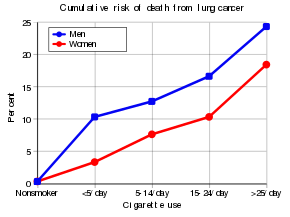
Tobaksrygning er langt den største bidragyder til lungekræft. Cigaretrøg indeholder mindst 73 kendte kræftfremkaldende stoffer , herunder benzo[ a ]pyren , NNK , 1,3-butadien og en radioaktiv isotop af polonium – polonium-210 . I hele den udviklede verden blev 90 % af lungekræftdødsfaldene hos mænd og 70 % af dem hos kvinder i 2000 tilskrevet rygning. Rygning tegner sig for omkring 85% af lungekræfttilfældene. Vaping kan være en risikofaktor for lungekræft, men mindre end for cigaretter, og yderligere forskning er nødvendig på grund af den tid, det kan tage for lungekræft at udvikle sig efter en eksponering for kræftfremkaldende stoffer.
Passiv rygning – indånding af røg fra andres rygning – er en årsag til lungekræft hos ikke-rygere. En passiv ryger kan defineres som en person, der enten bor eller arbejder sammen med en ryger. Undersøgelser fra USA, Storbritannien og andre europæiske lande har konsekvent vist en betydeligt øget risiko blandt dem, der er udsat for passiv rygning. Risikoen for at udvikle lungekræft stiger med 25-28%. Undersøgelser af sidestrømsrøg (hovedkomponenten i passiv rygning; omkring 85%) tyder på, at det er farligere end direkte almindelig røg.
Marihuanarøg indeholder mange af de samme kræftfremkaldende stoffer som dem, der findes i tobaksrøg, men effekten af at ryge cannabis på risikoen for lungekræft er ikke klar. En gennemgang fra 2013 fandt ikke en øget risiko fra let til moderat brug. En gennemgang fra 2014 viste, at rygning af cannabis fordoblede risikoen for lungekræft, selvom cannabis i mange lande er almindeligt blandet med tobak.
Radongas
Radon er en farveløs og lugtfri gas , der dannes ved nedbrydning af radioaktivt radium , som igen er nedbrydningsproduktet af uran , der findes i jordskorpen . Strålingshenfaldsprodukterne ioniserer genetisk materiale, hvilket forårsager mutationer, der nogle gange bliver kræftfremkaldende. Radon er den næsthyppigste årsag til lungekræft i USA, der forårsager omkring 21.000 dødsfald hvert år. Risikoen stiger 8-16 % for hver 100 Bq / m³ stigning i radonkoncentrationen. Radongasniveauerne varierer efter lokalitet og sammensætningen af den underliggende jord og klipper. Omkring et ud af 15 hjem i USA har radonniveauer over den anbefalede retningslinje på 4 picocuries pr. liter (pCi/l) (148 Bq/m³).
Asbest
Asbest kan forårsage en række lungesygdomme såsom lungekræft. Tobaksrygning og eksponering for asbest har tilsammen synergistiske effekter på udviklingen af lungekræft. Hos rygere, der arbejder med asbest, er risikoen for lungekræft øget 45 gange i forhold til den generelle befolkning. Asbest kan også forårsage kræft i lungehinden , kaldet lungehindekræft - som faktisk er forskellig fra lungekræft.
Luftforurening
Udendørs luftforurenende stoffer , især kemikalier frigivet fra afbrænding af fossile brændstoffer , øger risikoen for lungekræft. Fine partikler (PM 2,5 ) og sulfataerosoler , som kan frigives i trafikudstødningsgasser , er forbundet med en let øget risiko. For nitrogendioxid øger en trinvis stigning på 10 dele pr. milliard risikoen for lungekræft med 14 %. Udendørs luftforurening anslås at forårsage 1-2 % af lungekræfttilfældene.
Foreløbige beviser understøtter en øget risiko for lungekræft fra indendørs luftforurening i forhold til afbrænding af træ , trækul , møg eller afgrøderester til madlavning og opvarmning. Kvinder, der udsættes for indendørs kulrøg, har omtrent dobbelt så stor risiko, og mange af biprodukterne fra afbrænding af biomasse er kendte eller formodede kræftfremkaldende stoffer. Denne risiko påvirker omkring 2,4 milliarder mennesker verden over, og det menes at resultere i 1,5 % af lungekræftdødsfaldene.
Genetik
Omkring 8 % af lungekræfttilfældene er forårsaget af arvelige (genetiske) faktorer. Hos pårørende til mennesker, der er diagnosticeret med lungekræft, er risikoen fordoblet, sandsynligvis på grund af en kombination af gener . Polymorfier på kromosom 5, 6 og 15 er blevet identificeret og er forbundet med en øget risiko for lungekræft. Enkeltnukleotidpolymorfier af generne, der koder for nikotinacetylcholinreceptoren (nAChR) - CHRNA5 , CHRNA3 og CHRNB4 - er af dem, der er forbundet med en øget risiko for lungekræft, såvel som RGS17 - et gen, der regulerer G-proteinsignalering . Nyere genetiske undersøgelser har identificeret 18 følsomhedsloci, der opnår genomomspændende betydning. Disse loci fremhæver en heterogenitet i genetisk modtagelighed på tværs af de histologiske undertyper af lungecancer, hvilket igen identificerer de cholinerge nikotinreceptorer, f.eks. CHRNA2.
Andre årsager
Talrige andre stoffer, erhverv og miljøeksponeringer er blevet forbundet med lungekræft. Det Internationale Agentur for Kræftforskning udtaler, at der findes "tilstrækkeligt bevis" til at vise, at følgende er kræftfremkaldende i lungerne:
- Nogle metaller ( aluminiumproduktion , cadmium- og cadmiumforbindelser, chrom(VI) forbindelser, beryllium- og berylliumforbindelser, jern- og stålfundering , nikkelforbindelser , arsen og uorganiske arsenforbindelser og underjordisk hæmatitminedrift )
- Nogle forbrændingsprodukter (ufuldstændig forbrænding, kul (indendørs emissioner fra husholdningernes kulafbrænding), kulforgasning , kultjærebeg , koksproduktion , sod og dieselmotorudstødning )
- Ioniserende stråling ( røntgen og gamma )
- Nogle giftige gasser ( methylether (teknisk kvalitet) og bis-(chlormethyl)ether , svovlsennep , MOPP ( vincristin-prednison-nitrogen sennep-procarbazin-blanding ) og dampe fra maling )
- Gummiproduktion og krystallinsk silicastøv
- En lille stigning i risikoen for lungekræft ses hos mennesker ramt af systemisk sklerose .
Patogenese
I lighed med mange andre kræftformer initieres lungekræft enten ved aktivering af onkogener eller inaktivering af tumorsuppressorgener . Kræftfremkaldende stoffer forårsager mutationer i disse gener, der inducerer udviklingen af kræft.
Mutationer i K-ras proto-onkogen bidrager til omkring 10-30% af lungeadenokarcinomer . Næsten 4% af ikke-småcellede lungekarcinomer involverer et EML4-ALK - tyrosinkinasefusionsgen .
Epigenetiske ændringer såsom ændring af DNA-methylering , histonhalemodifikation eller mikroRNA - regulering kan resultere i inaktivering af tumorsuppressorgener. Det er vigtigt, at kræftceller udvikler resistens mod oxidativt stress , hvilket gør dem i stand til at modstå og forværre inflammatoriske tilstande, der hæmmer immunsystemets aktivitet mod tumoren.
Den epidermale vækstfaktorreceptor (EGFR) regulerer celleproliferation, apoptose , angiogenese og tumorinvasion. Mutationer og amplifikation af EGFR er almindelige ved NSCLC, og de danner grundlag for behandling med EGFR-hæmmere. Her2/neu påvirkes sjældnere. Andre gener, der ofte muteres eller amplificeres, omfatter c-MET , NKX2-1 , LKB1 , PIK3CA og BRAF .
Oprindelsescellelinjerne er ikke fuldt ud forstået . Mekanismen kan involvere unormal aktivering af stamceller . I de proksimale luftveje er stamceller, der udtrykker keratin 5 , mere tilbøjelige til at blive påvirket, hvilket typisk fører til planocellulært lungekarcinom . I de mellemste luftveje omfatter implicerede stamceller klubceller og neuroepitelceller, der udtrykker klubcelle-sekretorisk protein . SCLC kan stamme fra disse cellelinjer eller neuroendokrine celler , og det kan udtrykke CD44 .
Metastase af lungekræft kræver overgang fra epitelcelle til mesenkymal celletype. Dette kan forekomme gennem aktivering af signalveje såsom Akt / GSK3Beta , MEK-ERK , Fas og Par6.
Diagnose


Udførelse af et røntgenbillede af thorax (røntgenbillede) er et af de første undersøgelsestrin, hvis en person rapporterer symptomer, der kan tyde på lungekræft. Røntgenbilledet kan afsløre en tydelig masse, udvidelsen af mediastinum (antyder spredning til lymfeknuder der), atelektase (lungekollaps), konsolidering ( lungebetændelse ) eller pleural effusion . Computertomografi (CT) billeddannelse af brystet bruges ofte til diagnose og kan afsløre en spikuleret masse, som i høj grad tyder på lungekræft. CT-billeddannelse bruges også til at give mere information om sygdommens type og omfang. Bronkoskopisk eller CT-guidet biopsi bruges ofte til at prøve tumoren til histopatologi .
Lungekræft kan ofte optræde som en solitær lungeknude på et røntgenbillede af thorax. Imidlertid er differentialdiagnosen bred, og mange andre sygdomme kan også give dette udseende, herunder metastatisk cancer, hamartomer og infektiøse granulomer forårsaget af tuberkulose , histoplasmose eller coccidioidomycosis . Lungekræft kan også være et tilfældigt fund , som en solitær lungeknude på et røntgenbillede af thorax eller CT-scanning udført af en ikke-relateret årsag. Den endelige diagnose af lungekræft er baseret på histologisk undersøgelse af det mistænkelige væv i sammenhæng med de kliniske og radiologiske træk.
Retningslinjer for klinisk praksis anbefaler specifikke frekvenser (foreslåede tidsintervaller mellem tests) for lungeknudeovervågning. CT-billeddannelse foreslås ikke brugt i længere tid eller hyppigere end angivet i de kliniske retningslinjer, da enhver yderligere overvågning udsætter mennesker for øget stråling og er dyr.
Klassifikation
| Histologisk type | Incidens pr. 100.000 om året |
|---|---|
| Alle typer | 66,9 |
| Adenocarcinom | 22.1 |
| Planocellulært karcinom | 14.4 |
| Småcellet karcinom | 9.8 |
Lungekræft er klassificeret efter histologisk type . Denne klassifikation er vigtig for at bestemme både håndteringen og forudsigelsen af sygdommens udfald. Lungekræft er karcinomer - maligniteter, der opstår fra epitelceller . Lungekarcinomer er kategoriseret efter størrelsen og udseendet af de ondartede celler set af en histopatolog under et mikroskop. Til terapeutiske formål skelnes der mellem to brede klasser: ikke-småcellet lungekarcinom (NSCLC) og småcellet lungekarcinom (SCLC).
Ikke-småcellet lungekarcinom
De tre hovedundertyper af NSCLC er adenokarcinom , pladecellekarcinom og storcellet karcinom . Sjældne undertyper omfatter pulmonalt enterisk adenokarcinom .
Næsten 40 % af lungekræfttilfældene er adenocarcinomer, som normalt kommer fra perifert lungevæv. Selvom de fleste tilfælde af adenocarcinom er forbundet med rygning, er det også den mest almindelige form for lungekræft blandt personer, der har røget færre end 100 cigaretter i deres levetid ("aldrig-rygere") og tidligere rygere med en beskeden rygehistorie. En undertype af adenokarcinom, bronchioloalveolært karcinom , er mere almindelig hos kvindelige aldrig-rygere og kan have en bedre langtidsoverlevelse.
Planocellulært karcinom forårsager omkring 30% af lungekræft. De forekommer typisk tæt på store luftveje. Et hult hulrum og tilhørende celledød findes almindeligvis i midten af tumoren.
Omkring 10 til 15 % af lungekræfttilfældene er storcellet karcinom. Disse er så navngivet, fordi kræftcellerne er store med overskydende cytoplasma , store kerner og iøjnefaldende nukleoler .
Småcellet lungekarcinom
Ved SCLC indeholder cellerne tætte neurosekretoriske granula ( vesikler indeholdende neuroendokrine hormoner ), som giver denne tumor en endokrin eller paraneoplastisk syndromassociation . De fleste tilfælde opstår i de større luftveje (primære og sekundære bronkier ). Omkring 60-70 % har omfattende sygdom (som ikke kan målrettes inden for et enkelt stråleterapifelt) ved præsentationen.
Andre
Fire hoved histologiske undertyper er anerkendt, selvom nogle kræftformer kan indeholde en kombination af forskellige undertyper, såsom adenosquamous carcinoma . Sjældne undertyper omfatter carcinoide tumorer , bronchial kirtel carcinomer og sarcomatoid carcinomer .
Metastase
| Histologisk type | Napsin-A | TTF-1 |
|---|---|---|
| Planocellulært karcinom | Negativ | Negativ |
| Adenocarcinom | Positiv | Positiv |
| Småcellet karcinom | Negativ | Positiv |
Lungerne er et almindeligt sted for spredning af tumorer fra andre dele af kroppen. Disse tumorer kaldes metastaser eller sekundære tumorer. Det mest almindelige udseende på røntgen af thorax er tilstedeværelsen af flere knuder i de nedre lapper.
Primære lungekræftformer metastaserer også oftest til hjernen, knoglerne, leveren og binyrerne . Immunfarvning af en biopsi hjælper normalt med at bestemme den oprindelige kilde. Tilstedeværelsen af Napsin-A , TTF-1 , CK7 og CK20 hjælper med at bekræfte undertypen af lungekarcinom. SCLC, der stammer fra neuroendokrine celler, kan udtrykke CD56 , neuralcelleadhæsionsmolekyle , synaptophysin eller chromogranin .
Iscenesættelse
Lungekræftstadieinddeling er en vurdering af graden af spredning af kræften fra dens oprindelige kilde . Det er en af de faktorer, der påvirker både prognosen og den potentielle behandling af lungekræft.
Evalueringen af NSCLC-stadieinddeling bruger TNM-klassifikationen (tumor, knude, metastase). Dette er baseret på størrelsen af den primære tumor, lymfeknudepåvirkning og fjernmetastaser.
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ved hjælp af TNM-deskriptorerne tildeles en gruppe, der spænder fra okkult cancer, gennem stadier 0, IA (en-A), IB, IIA, IIB, IIIA, IIIB og IV (fire). Denne fasegruppe hjælper med valg af behandling og estimering af prognose.
| TNM | Scenegruppe |
|---|---|
| T1a–T1b N0 M0 | IA |
| T2a N0 M0 | IB |
| T1a–T2a N1 M0 | IIA |
| T2b N0 M0 | |
| T2b N1 M0 | IIB |
| T3 N0 M0 | |
| T1a–T3 N2 M0 | IIIA |
| T3 N1 M0 | |
| T4 N0–N1 M0 | |
| N3 M0 | IIIB |
| T4 N2 M0 | |
| M1 | IV |
SCLC er traditionelt blevet klassificeret som "begrænset stadie" (begrænset til halvdelen af brystet og inden for rammerne af et enkelt tolerabelt stråleterapiområde ) eller "ekstensivt stadium" (mere udbredt sygdom). TNM-klassificeringen og -grupperingen er imidlertid nyttige til at estimere prognose.
For både NSCLC og SCLC er de to generelle typer af stadieinddelingsevalueringer klinisk stadieinddeling og kirurgisk stadieinddeling. Klinisk stadieinddeling udføres før endelig operation. Den er baseret på resultaterne af billeddannelsesundersøgelser (såsom CT-scanninger og PET-scanninger ) og biopsiresultater. Kirurgisk stadieinddeling evalueres enten under eller efter operationen. Den er baseret på de kombinerede resultater af kirurgiske og kliniske fund, herunder kirurgisk prøveudtagning af thoraxlymfeknuder.
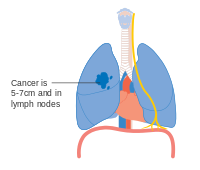
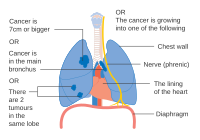
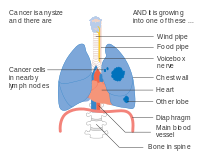
- Diagrammer over hovedtræk ved iscenesættelse
En mulighed for stadium IIB lungekræft, med T2b; men hvis tumor er inden for 2 cm fra carina , er dette stadium 3
Forebyggelse

Rygeforebyggelse og rygestop er effektive måder til at reducere risikoen for lungekræft.
Rygeforbud
Mens industrielle og indenlandske kræftfremkaldende stoffer i de fleste lande er blevet identificeret og forbudt, er tobaksrygning stadig udbredt. Eliminering af tobaksrygning er et primært mål i forebyggelsen af lungekræft, og rygestop er et vigtigt forebyggende redskab i denne proces.
Politiske indgreb for at mindske passiv rygning i offentlige områder såsom restauranter og arbejdspladser er blevet mere almindelige i mange vestlige lande . Bhutan har haft et fuldstændigt rygeforbud siden 2005, mens Indien indførte et forbud mod offentlig rygning i oktober 2008. Verdenssundhedsorganisationen har opfordret regeringer til at indføre et totalt forbud mod tobaksreklamer for at forhindre unge i at begynde at ryge. De vurderer, at sådanne forbud har reduceret tobaksforbruget med 16 %, hvor de er indført.
Screening
Kræftscreening bruger medicinske tests til at opdage sygdom hos store grupper af mennesker, der ikke har nogen symptomer. For personer med høj risiko for at udvikle lungekræft kan computertomografi (CT) screening opdage kræft og give en person muligheder for at reagere på det på en måde, der forlænger livet. Denne form for screening reducerer risikoen for død som følge af lungekræft med en absolut mængde på 0,3% ( relativ mængde på 20%). Højrisikopersoner er personer i alderen 55-74, der har røget tilsvarende mængder af en pakke cigaretter dagligt i 30 år inklusive tid inden for de seneste 15 år.
CT-screening er forbundet med en høj andel af falsk positive tests, hvilket kan resultere i unødvendig behandling. For hver nøjagtig positiv scanning er der omkring 19 falsk positive scanninger. Andre bekymringer omfatter strålingseksponering og omkostningerne ved test sammen med opfølgning. Forskning har ikke fundet, at to andre tilgængelige tests - sputumcytologi eller thorax røntgen ( CXR ) screeningstests - har nogen fordel.
United States Preventive Services Task Force anbefaler årlig screening ved hjælp af lavdosis CT hos dem, der har en samlet rygehistorie på 30 pakkeår og er mellem 55 og 80 år, indtil en person ikke har røget i mere end 15 år. Deres anbefaling udelukker dem med andre helbredsproblemer, der ville gøre behandling af lungekræft, hvis de blev fundet, ikke en mulighed. Den engelske nationale sundhedstjeneste var i 2014 ved at genoverveje beviserne for screening.
Andre forebyggelsesstrategier
Langvarig brug af supplerende A- vitamin , B-vitaminer , D-vitamin eller E-vitamin reducerer ikke risikoen for lungekræft. C- vitamintilskud kan reducere risikoen for lungekræft. Nogle undersøgelser har fundet, at vitamin A, B og E kan øge risikoen for lungekræft hos dem, der har en historie med rygning.
Nogle undersøgelser tyder på, at folk, der spiser mad med en højere andel af grøntsager og frugt, har en tendens til at have en lavere risiko, men dette kan skyldes forvirring – med den lavere risiko faktisk på grund af sammenhængen mellem en høj frugt- og grøntsagsdiæt med mindre rygning . Adskillige strenge undersøgelser har ikke vist en klar sammenhæng mellem kost og risiko for lungekræft, selvom meta-analyse, der tegner sig for rygestatus, kan vise fordele ved en sund kost.
Ledelse
Behandling af lungekræft afhænger af kræftens specifikke celletype, hvor langt den har spredt sig og personens præstationsstatus . Almindelige behandlinger omfatter palliativ pleje , kirurgi , kemoterapi og strålebehandling . Målrettet behandling af lungekræft vokser i betydning for fremskreden lungekræft. Derudover foreslås nogle gange rygestop og motion.
Kirurgi
Hvis undersøgelser bekræfter NSCLC, vurderes stadiet for at bestemme, om sygdommen er lokaliseret og modtagelig for operation, eller om den har spredt sig til det punkt, hvor den ikke kan helbredes kirurgisk. CT-scanning og PET-CT, ikke-invasive tests, kan bruges til at udelukke malignitet eller involvering af mediastinal lymfeknuder . Hvis der er mistanke om mediastinal lymfeknudeinvolvering ved brug af PET-CT, kan noderne udtages (ved hjælp af en biopsi) for at hjælpe med iscenesættelse, en PET-CT-scanning er ikke nøjagtig nok til at blive brugt alene. Teknikker, der bruges til at opnå en prøve, omfatter transthorax nålespiration , transbronchial nålespiration (med eller uden endobronchial ultralyd ), endoskopisk ultralyd med nålespiration, mediastinoskopi og thorakoskopi . Blodprøver og lungefunktionsundersøgelser bruges til at vurdere, om en person er rask nok til operation. Hvis lungefunktionsprøver afslører dårlig respiratorisk reserve, er operation muligvis ikke mulig.
I de fleste tilfælde af tidligt stadium af NSCLC er fjernelse af en lungelap ( lobektomi ) den foretrukne kirurgiske behandling. Hos personer, der er uegnede til en fuld lobektomi , kan der udføres en mindre sublobar excision (kileresektion) . Kileresektion har dog en højere risiko for recidiv end lobektomi. Radioaktiv jod brachyterapi ved kanten af kileudskæring kan reducere risikoen for tilbagefald. Sjældent udføres fjernelse af en hel lunge ( pneumonektomi ). Videoassisteret thorakoskopisk kirurgi (VATS) og VATS-lobektomi bruger en minimalt invasiv tilgang til lungekræftkirurgi. VATS lobektomi er lige så effektiv sammenlignet med konventionel åben lobektomi med mindre postoperativ sygdom.
Ved SCLC anvendes typisk kemoterapi eller strålebehandling, eller nogle gange begge dele. Operationens rolle i SCLC bliver dog genovervejet. Kirurgi kan forbedre resultaterne, når de føjes til kemoterapi og stråling i tidligt stadie af SCLC.
Effektiviteten af lungekræftkirurgi (resektion) for personer med stadium I – IIA NSCLC er ikke klar, men svag evidens tyder på, at en kombineret tilgang til lungekræftresektion og fjernelse af de mediastinale lymfeknuder (mediastinal lymfeknudedissektion) kan forbedre overlevelsen sammenlignet med lungeresektion og en prøve af mediastinale noder (ikke en fuldstændig knudedissektion).
Strålebehandling

Strålebehandling gives ofte sammen med kemoterapi og kan bruges med helbredende hensigt til personer med NSCLC, som ikke er kvalificerede til operation. Denne form for højintensiv strålebehandling kaldes radikal strålebehandling. En forfining af denne teknik er kontinuert hyperfraktioneret accelereret strålebehandling (CHART), hvor en høj dosis strålebehandling gives på kort tid. Radiokirurgi refererer til strålebehandlingsteknikken til at give en præcis højdosis strålebehandling, der styres af en computer. Postoperativ ( adjuverende ) thoraxstrålebehandling anvendes generelt ikke efter kurativ operation for NSCLC. Nogle mennesker med mediastinal N2-lymfeknudepåvirkning kan have gavn af postoperativ strålebehandling.
For potentielt helbredelige SCLC-tilfælde behandlet med kirurgi anbefales postoperativ thoraxstrålebehandling. Det ideelle tidspunkt for disse behandlinger (det optimale tidspunkt at give strålebehandling og kemoterapi for at forbedre overlevelse) er ikke kendt.
Hvis kræftvækst blokerer en kort del af bronkierne, kan brachyterapi (lokaliseret strålebehandling) gives direkte inde i luftvejen for at åbne passagen. Sammenlignet med ekstern strålebehandling tillader brachyterapi en reduktion i behandlingstid og reduceret strålingseksponering for sundhedspersonale. Evidensen for brachyterapi er imidlertid mindre end for ekstern strålebehandling.
Profylaktisk kraniebestråling er en type strålebehandling til hjernen, der bruges til at reducere risikoen for metastaser. PCI bruges i SCLC. Ved sygdom i begrænset stadie øger PCI treårs overlevelse fra 15 % til 20 %; ved omfattende sygdom stiger et års overlevelse fra 13 % til 27 %. For personer, der har NSCLC og en enkelt hjernemetastase, er det ikke klart, om operation er mere effektiv end radiokirurgi.
Nylige forbedringer i målretning og billeddannelse har ført til udviklingen af stereotaktisk stråling i behandlingen af tidligt stadie af lungekræft. I denne form for strålebehandling afgives høje doser over et antal sessioner ved hjælp af stereotaktiske målretningsteknikker. Dets anvendelse er primært hos patienter, der ikke er kirurgiske kandidater på grund af medicinske komorbiditeter .
For både NSCLC- og SCLC-patienter kan mindre doser af stråling til brystet bruges til symptomkontrol ( palliativ strålebehandling). Brugen af højere doser af strålebehandling til palliativ behandling er ikke vist at forlænge overlevelsen.
Kemoterapi
Kemoterapibehandlingen afhænger af tumortypen. SCLC, selv relativt tidligt stadie af sygdom, behandles primært med kemoterapi og stråling. Ved SCLC er cisplatin og etoposid mest almindeligt anvendt. Kombinationer med carboplatin , gemcitabin , paclitaxel , vinorelbin , topotecan og irinotecan anvendes også. Ved avanceret NSCLC forbedrer kemoterapi overlevelsen og bruges som førstelinjebehandling, forudsat at personen er rask nok til behandlingen. Typisk bruges to lægemidler, hvoraf det ene ofte er platinbaseret (enten cisplatin eller carboplatin). Andre almindeligt anvendte lægemidler er gemcitabin, paclitaxel, docetaxel , pemetrexed , etoposid eller vinorelbin. Platinbaserede lægemidler og kombinationer, der inkluderer platinterapi, ser ikke ud til at være mere gavnlige til at forlænge overlevelse sammenlignet med andre ikke-platinlægemidler og kan føre til en højere risiko for alvorlige bivirkninger, såsom kvalme, opkastning, anæmi og trombocytopeni, især hos personer over 70 år. Evidensen er utilstrækkelig til at afgøre, hvilken kemoterapitilgang der er forbundet med den højeste livskvalitet. Der mangler også evidens for at afgøre, om behandling af personer med NSCLC en anden gang, når den første runde af kemoterapi ikke var vellykket (second-line kemoterapi), forårsager mere fordel eller skade.
Adjuverende kemoterapi refererer til brugen af kemoterapi efter tilsyneladende helbredende kirurgi for at forbedre resultatet. Ved NSCLC udtages prøver af nærliggende lymfeknuder under operationen for at hjælpe med iscenesættelse. Hvis stadium II eller III sygdom bekræftes, forbedrer adjuverende kemoterapi (inklusive eller ikke inklusive postoperativ strålebehandling) overlevelsen med 4 % efter fem år. Kombinationen af vinorelbin og cisplatin er mere effektiv end ældre regimer. Adjuverende kemoterapi til personer med stadium IB-kræft er kontroversiel, da kliniske forsøg ikke klart har vist en overlevelsesfordel. Kemoterapi før operation i NSCLC, der kan fjernes kirurgisk, kan forbedre resultaterne.
Kemoterapi kan kombineres med palliativ behandling i behandlingen af NSCLC. I fremskredne tilfælde forbedrer passende kemoterapi den gennemsnitlige overlevelse i forhold til understøttende behandling alene, samt forbedrer livskvaliteten . Med tilstrækkelig fysisk kondition giver opretholdelse af kemoterapi under lungekræftpalliation 1,5 til 3 måneders forlængelse af overlevelse, symptomatisk lindring og en forbedring af livskvaliteten, med bedre resultater set med moderne midler. NSCLC Meta-Analyses Collaborative Group anbefaler, at hvis modtageren ønsker og kan tåle behandling, så kan kemoterapi overvejes ved fremskreden NSCLC.
Målrettet og immunterapi
Adskillige lægemidler, der retter sig mod molekylære veje i lungekræft, er tilgængelige, især til behandling af fremskreden sygdom. Erlotinib , gefitinib og afatinib hæmmer tyrosinkinase ved den epidermale vækstfaktorreceptor (EGFR). Disse EGFR-hæmmere kan hjælpe med at forsinke spredningen af kræftceller for mennesker med EGFR M+ lungekræft og kan forbedre en persons livskvalitet. EGFR-hæmmere har ikke vist sig at hjælpe mennesker med at overleve længere. For personer med EGFR-mutationer kan behandling med gefitinib resultere i en forbedret livskvalitet sammenlignet med behandling med kemoterapi. Denosumab , et monoklonalt antistof rettet mod receptoraktivator af nuklear faktor kappa-B-ligand , kan være nyttig i behandlingen af knoglemetastaser .

Immunterapi kan bruges til både SCLC og NSCLC. NSCLC-celler, der udtrykker programmeret dødsligand 1 (PD-L1), kunne interagere med programmeret dødsreceptor 1 (PD-1) udtrykt på overfladen af T-celler og resultere i nedsat tumorcelledrab af immunsystemet. Atezolizumab er et anti-PD-L1 monoklonalt antistof. Nivolumab og Pembrolizumab er anti-PD-1 monoklonale antistoffer. Ipilimumab er et monoklonalt antistof, der retter sig mod cytotoksisk T-lymfocyt-associeret protein 4 (CTLA-4) på overfladen af T-celler. Bevacizumab er et monoklonalt antistof, der retter sig mod vaskulær endotelvækstfaktor i kredsløbet og fungerer som en angiogenesehæmmer. Multiple fase 3 kliniske forsøg med immunterapi i første linje til behandling af NSCLC blev offentliggjort, inklusive Pembrolizumab i KEYNOTE-024, KEYNOTE-042, KEYNOTE-189 og KEYNOTE-407; Nivolumab og Ipilimumab i CHECKMATE-227 og CHECKMATE 9LA; og Atezolizumab i IMpower110, IMpower130 og IMpower150.

Vaccinebaseret immunterapibehandling efter operation eller strålebehandling fører muligvis ikke til forbedret overlevelse for personer med stadium I-III NSCLC.
Bronkoskopi
Adskillige behandlinger kan gives via bronkoskopi til håndtering af luftvejsobstruktion eller blødning. Hvis en luftvej bliver blokeret af kræftvækst, omfatter mulighederne stiv bronkoskopi, ballonbronkoplastik, stenting og mikrodebridement. Laserfotosektion involverer levering af laserlys inde i luftvejen via et bronkoskop for at fjerne den obstruerende tumor.
Palliativ pleje
Palliativ pleje, når den tilføjes til sædvanlig kræftbehandling, gavner mennesker, selv når de stadig modtager kemoterapi. Disse tilgange tillader yderligere diskussion af behandlingsmuligheder og giver mulighed for at nå frem til velovervejede beslutninger. Palliativ pleje kan undgå uhensigtsmæssig, men dyr pleje, ikke kun i slutningen af livet, men også under hele sygdomsforløbet. For personer, der har mere fremskreden sygdom, kan hospicepleje også være passende.
Non-invasive indgreb
Den mest effektive intervention for at undgå dødsfald af lungekræft er at holde op med at ryge; selv folk, der allerede har lungekræft, opfordres til at holde op med at ryge. Der er ingen klar evidens for, hvilket rygestopprogram , der er mest effektivt for mennesker, der er blevet diagnosticeret med lungekræft.
Nogle svage beviser tyder på, at visse støttende behandlingsinterventioner ( ikke- invasive ), der fokuserer på velvære for mennesker med lungekræft, kan forbedre livskvaliteten. Interventioner såsom sygeplejerskeopfølgninger, psykoterapi , psykosocial terapi og uddannelsesprogrammer kan være gavnlige, men beviserne er ikke stærke (der er behov for yderligere forskning). Rådgivning kan hjælpe folk med at klare følelsesmæssige symptomer relateret til lungekræft. Zoneterapi kan være effektiv på kort sigt, men der er behov for mere forskning. Der er ikke fundet evidens for, at ernæringsinterventioner eller træningsprogrammer for en person med lungekræft resulterer i en forbedring af livskvaliteten, som er relevante eller varer meget længe.
Motionstræning kan være til gavn for personer med NSCLC, som er ved at komme sig efter lungeoperationer. Derudover kan træning være til gavn for personer med NSCLC, som har modtaget strålebehandling, kemoterapi, kemoradioterapi eller palliativ behandling. Motionstræning før lungekræftoperation kan også forbedre resultaterne. Det er uklart, om træningstræning eller træningsprogrammer er gavnlige for mennesker, der har fremskreden lungekræft. En hjemmebaseret komponent i et personligt fysisk rehabiliteringsprogram kan være nyttig til restitution. Det er uklart, om hjemmebaseret præhabilitering (før operation) fører til færre uønskede hændelser eller indlæggelsestid. Fysisk rehabilitering med en hjemmebaseret komponent kan forbedre restitutionen efter behandling og den generelle lungesundhed.
Prognose
| Klinisk fase | Fem års overlevelse (%) | |
|---|---|---|
| Ikke-småcellet lungekarcinom | Småcellet lungekarcinom | |
| IA | 50 | 38 |
| IB | 47 | 21 |
| IIA | 36 | 38 |
| IIB | 26 | 18 |
| IIIA | 19 | 13 |
| IIIB | 7 | 9 |
| IV | 2 | 1 |
Af alle mennesker med lungekræft i USA overlever omkring 17% til 20% i mindst fem år efter diagnosen. I England og Wales blev den samlede femårsoverlevelse for lungekræft mellem 2013 og 2017 anslået til 13,8 %. Resultaterne er generelt værre i udviklingslandene . På grund af sen opdagelse er lungekræftstadiet ofte fremskreden på diagnosetidspunktet. Ved præsentationen har omkring en tredjedel af tilfældene af NSCLC metastatisk sygdom, og 60-70% af SCLC har omfattende sygdom. Overlevelsen for lungekræft falder, efterhånden som stadiet ved diagnosen bliver mere avanceret; de engelske data tyder på, at omkring 70 % af patienterne overlever mindst et år, når de diagnosticeres på det tidligste stadie, men dette falder til kun 14 % for dem, der er diagnosticeret med den mest fremskredne sygdom (stadie IV).
Prognostiske faktorer ved NSCLC omfatter tilstedeværelse af pulmonale symptomer, stor tumorstørrelse (>3 cm), ikke-pladecelletype (histologi), spredningsgrad (stadie) og metastaser til flere lymfeknuder og vaskulær invasion . For personer med inoperabel sygdom er resultaterne værre hos dem med dårlig præstationsstatus og vægttab på mere end 10 %. Prognostiske faktorer i småcellet lungekræft omfatter præstationsstatus, biologisk køn, sygdomsstadie og involvering af centralnervesystemet eller leveren på diagnosetidspunktet.
For NSCLC opnås den bedste prognose med fuldstændig kirurgisk resektion af stadium-IA sygdom med op til 70 % femårs overlevelse. Mennesker med omfattende SCLC har en gennemsnitlig fem-års overlevelsesrate på mindre end 1 %. Den gennemsnitlige overlevelsestid for sygdom i begrænset stadie er 20 måneder med en femårs overlevelsesrate på 20 %. Prognosen for patienter med NSCLC blev væsentligt forbedret i de sidste år med introduktionen af immunterapi. Patienter med tumor PDL-1 udtrykt over halvdelen eller flere af tumorcellerne opnåede en median samlet overlevelse på 30 måneder med pembrolizumab. Flere fase 3-forsøg, der giver immunterapi i første linje til patienter med ikke-småcellet lungekræft, er blevet offentliggjort.
Ifølge data leveret af National Cancer Institute er medianalderen ved diagnosticering af lungekræft i USA 70 år, og medianalderen ved døden er 72 år. I USA er det mere sandsynligt, at folk med sygeforsikring får et bedre resultat.
Epidemiologi
På verdensplan er lungekræft den mest almindelige kræftform blandt mænd for både incidens og dødelighed , og blandt kvinder har den tredjehøjeste forekomst (efter bryst- og tyktarmskræft ) og næsthøjeste dødelighed (efter brystkræft). I 2020 blev der fundet 2,2 millioner nye tilfælde på verdensplan, og 1,8 millioner dødsfald skyldtes lungekræft, hvilket repræsenterer 18,0 % af alle dødsfald som følge af kræft. De højeste priser er i Mikronesien, Polynesien, Europa, Asien, Nordamerika og Europa. Priserne i Afrika og Mellemamerika er meget lavere.
Mennesker, der har en lang historie med rygning, har den højeste risiko for at udvikle lungekræft, og risikoen stiger med varigheden af rygning. Forekomsten blandt mænd steg indtil midten af 1980'erne og er faldet siden da. Hos kvinder steg forekomsten indtil slutningen af 1990'erne og har siden været stabil.
For hver 3-4 millioner cigaretter, der røges, kan der opstå én lungekræftdød. Påvirkningen af " Big Tobacco " spiller en væsentlig rolle i rygning. Unge ikke-rygere, der ser tobaksreklamer, er mere tilbøjelige til at ryge. Passiv rygnings rolle bliver i stigende grad anerkendt som en risikofaktor for lungekræft, hvilket resulterer i politiske indgreb for at mindske ikke-rygeres uønskede eksponering for andres tobaksrøg.
Fra 1960'erne begyndte antallet af lungeadenokarcinomer at stige i forhold til andre former for lungekræft, delvist på grund af introduktionen af filtercigaretter. Brugen af filtre fjerner større partikler fra tobaksrøg og reducerer dermed aflejring i større luftveje. Rygeren er dog nødt til at inhalere dybere for at modtage den samme mængde nikotin , hvilket øger partikelaflejringen i små luftveje, hvor adenocarcinom har tendens til at opstå. Hyppigheden af lungeadenokarcinom fortsætter med at stige.
Forenede Stater
I USA har både sorte mænd og sorte kvinder en højere forekomst. Livstidsrisikoen for at udvikle lungekræft er 8 % hos mænd og 6 % hos kvinder.
Også i USA har militærveteraner en 25-50% højere forekomst af lungekræft, primært på grund af højere rygning. Under Anden Verdenskrig og Koreakrigen spillede asbest også en rolle, og Agent Orange kan have forårsaget nogle problemer under Vietnamkrigen .
Det Forenede Kongerige
Lungekræft er den tredjehyppigste kræftsygdom i Storbritannien (47.968 mennesker blev diagnosticeret med sygdommen i 2017), og det er den mest almindelige årsag til kræftrelateret død (omkring 34.600 mennesker døde i 2018).
Andre lande
Forekomsten af lungekræft er i øjeblikket lavere i udviklingslandene. Med øget rygning i udviklingslandene forventes satserne at stige i de næste par år, især i både Kina og Indien.
Historie
Lungekræft var ualmindeligt før fremkomsten af cigaretrygning; det blev ikke engang anerkendt som en udpræget sygdom før 1761. Forskellige aspekter af lungekræft blev beskrevet yderligere i 1810. Ondartede lungetumorer udgjorde kun 1 % af alle kræftformer set ved obduktion i 1878, men var steget til 10-15 % pr. begyndelsen af 1900-tallet. Caserapporter i den medicinske litteratur talte kun 374 på verdensplan i 1912, men en gennemgang af obduktioner viste, at forekomsten af lungekræft var steget fra 0,3 % i 1852 til 5,66 % i 1952. I Tyskland i 1929 anerkendte læge Fritz Lickint sammenhængen mellem rygning og lungekræft, hvilket førte til en aggressiv antirygekampagne . The British Doctors' Study , udgivet i 1950'erne, var det første solide epidemiologiske bevis på sammenhængen mellem lungekræft og rygning. Som følge heraf anbefalede USA's Surgeon General i 1964, at rygere skulle holde op med at ryge.
Forbindelsen med radongas blev først erkendt blandt minearbejdere i Ertsbjergene nær Schneeberg, Sachsen . Der er blevet udvundet sølv siden 1470, og disse miner er rige på uran, med dets medfølgende radium og radongas. Minearbejdere udviklede en uforholdsmæssig mængde af lungesygdomme, der til sidst blev anerkendt som lungekræft i 1870'erne. På trods af denne opdagelse fortsatte minedriften ind i 1950'erne på grund af USSR 's efterspørgsel efter uran. Radon blev bekræftet som en årsag til lungekræft i 1960'erne.
Den første vellykkede pneumonektomi for lungekræft blev udført i 1933. Palliativ strålebehandling har været brugt siden 1940'erne. Radikal strålebehandling, som oprindeligt blev brugt i 1950'erne, var et forsøg på at bruge større stråledoser hos patienter med relativt tidligt stadie af lungekræft, men som ellers var uegnede til operation. I 1997 blev CHART set som en forbedring i forhold til konventionel radikal strålebehandling. Med SCLC var de første forsøg i 1960'erne på kirurgisk resektion og radikal strålebehandling uden succes. I 1970'erne blev vellykkede kemoterapiregimer udviklet.
Forskningsvejledninger
Jagten på nye behandlingsmuligheder fortsætter. Mange kliniske forsøg, der involverer strålebehandling, kirurgi, EGFR-hæmmere, mikrotubuli-hæmmere og immunterapi er i gang.
Forskningsretninger for behandling af lungekræft omfatter immunterapi , som tilskynder kroppens immunsystem til at angribe tumorcellerne, epigenetik og nye kombinationer af kemoterapi og strålebehandling, både alene og sammen. Mange af disse nye behandlinger virker gennem blokade af immunkontrolpunkter , der forstyrrer kræftens evne til at undvige immunsystemet .
Ipilimumab blokerer signalering gennem en receptor på T-celler kendt som CTLA-4 , som dæmper immunsystemet. Det er blevet godkendt af US Food and Drug Administration til behandling af melanom og gennemgår kliniske forsøg for både NSCLC og SCLC.
Andre immunterapibehandlinger interfererer med bindingen af programmeret celledød 1 (PD-1) protein med dets ligand PD-1 ligand 1 (PD-L1), og er blevet godkendt som første- og efterfølgende linjebehandlinger for forskellige undergrupper af lungecancer. . Signalering gennem PD-1 inaktiverer T-celler. Nogle kræftceller ser ud til at udnytte dette ved at udtrykke PD-L1 for at slukke for T-celler, der kan genkende dem som en trussel. Monoklonale antistoffer rettet mod både PD-1 og PD-L1, såsom pembrolizumab , nivolumab , atezolizumab og durvalumab , er i øjeblikket i kliniske forsøg til behandling af lungekræft.
Epigenetik er studiet af små molekylære modifikationer - eller "tags" - der binder til DNA og modificerer genekspressionsniveauer . Målretning af disse tags med lægemidler kan dræbe kræftceller. Tidlig forskning i NSCLC ved hjælp af lægemidler rettet mod epigenetiske modifikationer viser, at blokering af mere end én af disse tags kan dræbe kræftceller med færre bivirkninger. Undersøgelser viser også, at det kan forbedre effektiviteten ved at give folk disse lægemidler før standardbehandling. Kliniske forsøg er i gang for at evaluere, hvor godt disse lægemidler dræber lungekræftceller hos mennesker. Adskillige lægemidler, der retter sig mod epigenetiske mekanismer, er under udvikling. Histon-deacetylase-hæmmere under udvikling omfatter valproinsyre , vorinostat , belinostat , panobinostat , entinostat og romidepsin . DNA-methyltransferase -hæmmere under udvikling omfatter decitabin , azacytidin og hydralazin .
TRACERx-projektet ser på, hvordan NSCLC udvikler sig og udvikler sig, og hvordan disse tumorer bliver resistente over for behandling. Projektet vil se på tumorprøver fra 850 personer med NSCLC på forskellige stadier, herunder diagnose, efter første behandling, efterbehandling og tilbagefald. Ved at studere prøver på forskellige punkter i tumorudvikling håber forskerne at identificere de ændringer, der driver tumorvækst og resistens mod behandling. Resultaterne af dette projekt vil hjælpe forskere og læger med at få en bedre forståelse af NSCLC og potentielt føre til udvikling af nye behandlinger for sygdommen.
For lungekræfttilfælde, der udvikler resistens over for epidermal vækstfaktorreceptor (EGFR) og anaplastisk lymfomkinase (ALK) tyrosinkinasehæmmere , er nye lægemidler under udvikling. EGFR-hæmmere omfatter erlotinib , gefitinib , afatinib og icotinib (den sidste er kun tilgængelig i Kina). En alternativ signalvej, c-Met , kan hæmmes af tivantinib og onartuzumab . Nye ALK-hæmmere omfatter crizotinib og ceritinib . Hvis MAPK/ERK-vejen er involveret, kan BRAF -kinasehæmmeren dabrafenib og MAPK/MEK-hæmmeren trametinib være gavnlige.
PI3K-vejen er blevet undersøgt som et mål for lungekræftbehandling. De mest lovende strategier til at målrette denne vej ser ud til at være selektiv inhibering af et eller flere medlemmer af klasse I PI3K'erne og co-målrettet inhibering af denne vej med andre såsom MEK.
Lungekræftstamceller er ofte resistente over for konventionel kemoterapi og strålebehandling. Dette kan føre til tilbagefald efter behandling. Nye tilgange retter sig mod protein- eller glycoproteinmarkører , der er specifikke for stamcellerne. Sådanne markører inkluderer CD133 , CD90 , ALDH1A1 , CD44 og ABCG2 . Signaleringsveje såsom Hedgehog , Wnt og Notch er ofte impliceret i selvfornyelsen af stamcellelinjer. Således kan behandlinger rettet mod disse veje hjælpe med at forhindre tilbagefald.
Se også
Referencer
eksterne links
- Lungekræft hos Curlie