N -Formylmethionin -leucyl -phenylalanin - N-Formylmethionine-leucyl-phenylalanine
|
|
| Navne | |
|---|---|
|
Foretrukket IUPAC -navn
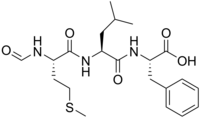
(2 S ) -2-{(2 S ) -2-[(2 S ) -2-Formamido-4- (methylsulfanyl) butanamido] -4-methylpentanamido} -3-phenylpropansyre |
|
| Andre navne
Kemotaktisk peptid
F -Met -Leu -Phe L -Penylalanin, N -( N -( N -formyl -L -methionyl) -L -leucyl) -fMLP |
|
| Identifikatorer | |
|
3D -model ( JSmol )
|
|
| ChemSpider | |
| MeSH | N-Formylmethionin+Leucyl-Phenylalanin |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Ejendomme | |
| C 21 H 31 N 3 O 5 S | |
| Molar masse | 437,56 g · mol −1 |
|
Medmindre andet er angivet, angives data for materialer i deres standardtilstand (ved 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Infobox referencer | |
N- Formylmethionyl-leucyl-phenylalanin ( fMLF , fMLP eller N- formyl-met-leu-phe ) er et N - formyleret tripeptid og undertiden ganske enkelt omtalt som kemotaktisk peptid er en kraftig polymorfonuklær leukocyt (PMN) kemotaktisk faktor og er også en makrofagaktivator .
fMLF er den prototypiske repræsentant for den N -formylerede oligopeptidfamilie af kemotaktiske faktorer. Disse oligopeptider vides at være eller efterligne virkningerne af N -formyloligopeptiderne, der (a) frigives af vævsbakterier, (b) tiltrækker og aktiverer leukocytter i cirkulation ved at binde til specifikke G -proteinkoblede receptorer på disse celler, og (c) derved lede den inflammatoriske respons til steder for bakteriel invasion. fMLF er involveret i den medfødte immunitetsmekanisme til værtsforsvar mod patogener .
fMLF førte til den første opdagelse af en leukocytreceptor for en kemotaktisk faktor, definerede tre forskellige typer fMLF-receptorer, der har komplementære og/eller modsatrettede virkninger på inflammatoriske reaktioner samt mange andre aktiviteter, og hjalp med at definere stimulus-respons-koblingsmekanismer ved at hvilke forskellige kemotaktiske faktorer og deres G -proteinkoblede receptorer inducerer cellulær funktion.
Opdagelse
I 1887 observerede Élie Metchnikoff , at leukocytter isoleret fra forskellige dyrs blod blev tiltrukket mod visse bakterier. Denne attraktion blev snart foreslået at skyldes opløselige elementer frigivet af bakterierne (se Harris for en gennemgang af dette område frem til 1953). Peter Ward, Elmer Becker, Henry Showell og kolleger viste, at disse elementer blev fremstillet af en række voksende grampositive bakterier og gramnegative bakterier og havde lav molekylvægt , dvs. under 3600 Dalton (enhed) s . Yderligere undersøgelser af Schiffmann og kollegier viste, at kulturer med voksende Escherichia coli frigav oligopeptider på mellem 150 og 1500 dalton, der syntes at have en fri carboxylsyregruppe, men ikke en fri amingruppe .
I betragtning af disse spor og viden om, at bakterier transskriberer (se transkription (genetik) ) proteiner, der starter med N -formylmethionin, hvorimod eukaryote celler for det meste initierer proteinsyntese med ikke -formyleret methionin, teoretiserede Schiffmann, Corcoran og Wahl og viste derefter, at N -formyl -methionin og en række N -formyl -methionyldipeptider og tripeptider stimulerede kemotaxi af neutrofiler isoleret fra peritoneale eksudater fra kaniner såvel som af makrofager isoleret fra peritoneale ekssudater fra marsvin. I yderligere undersøgelser af forskellige N -formylerede oligopeptider viste fMLF sig at være den mest potente i stimulering af kanotneutrofil kemotaksi. fMLF og en prøveudtagning af andre, mindre potente, N -formyl oligopeptider viste sig derefter at stimulere en lang række kaninneutrofile funktioner, såsom: den forbigående auto -aggregering af disse celler i suspension og lige så forbigående fald i cirkulerende neutrofiler, når de injiceres i kanin vener (disse svar skyldes en stigning i neutrofil adhæsivitet til hinanden og/eller vaskulært endotel); frigivelse (se degranulering ) af intracellulære granulatbundne enzymer og andre antimikrobielle cytotoksiske molekyler; og produktion og frigivelse af cytotoksiske reaktive oxygenarter, såsom Superoxid og hydrogenperoxid . Alle disse svar er en del af det medfødte immunsystems første forsvarslinje mod bakterielle invasioner.
Opfølgningsundersøgelser fandt ud af, at generne i mitokondrier og chloroplaster organeller i Eukaryote- celler, herunder menneskers, som i modsætning til nukleare gener koder for N- formyl-methioninproteiner, frigiver N- formyl-methionylholdige peptider med kemotaktiske aktiviteter, der præcist efterligner dem for fMLF chemotaxis Disse organelle-afledte formylerede peptider er sande analoger af fMLF, der fungerer gennem fMLF-receptorer for at rekruttere cirkulerende blodleukocytter til og derved starte inflammationsreaktioner på steder med celleskader og vævsdestruktion, der ikke er forårsaget af bakterier. fMLF og andre N -formylerede oligopeptider viste sig at være tilsvarende aktive i humane neutrofiler. Den høje grad af strukturel specificitet af en bred serie af formylerede peptider til stimulering af disse neutrofile reaktioner, den specifikke binding af N -formylerede oligopeptider til neutrofiler med affiniteter, der parallellerede deres stimulerende potenser, evnen af t -carbobenzoxy -phenylalanyl -methionin til at binde sig til men ikke stimulere neutrofiler og derved blokere neutrofilbindingen og stimulerende aktiviteten af N-formylerede oligopeptider og de formylerede oligopeptiders evne til at desensibilisere (dvs. ikke reagerer) neutrofile funktionelle reaktioner på sig selv, men har ingen eller en mindre evne til at desensibilisere for en række andre kemotaktiske stimuli gav stærkt antydende bevis på, at de formylerede peptider virkede på celler gennem et fælles, dedikeret receptorsystem, der adskilte sig fra andre kemotaktiske faktorreceptorer.
Receptorer
De ovennævnte undersøgelser fører til den endelige kloning af den humane Formylpeptidreceptor 1 , en G -proteinkoblet receptor, der binder fMLF og andre formylerede oligopeptider til at formidle deres stimulerende virkninger på human- og kaninneutrofiler. Efterfølgende blev Formylpeptidreceptor 2 og Formylpeptidreceptor 3 også klonet baseret på lighederne i deres aminosyresekvens til formylpeptidreceptor 1. Formylpeptidreceptorer 2 og 3 har meget forskellige evner til at binde og reagere på formylerede oligopeptider inklusive fMLF sammenlignet med formylpeptidreceptor 1 og sammenlignet med hinanden og har meget forskellige funktioner end formylpeptidreceptor 1.
Referencer
eksterne links
- N-Formylmethionin Leucyl-Phenylalanine på US National Library of Medicine Medical Subject Headings (MeSH)
