NMDA -receptor - NMDA receptor

Den N -methyl- D -aspartat- receptor (også kendt som NMDA-receptoren eller NMDAR ), er en glutamatreceptor og ionkanal findes i neuroner . NMDA -receptoren er en af tre typer ionotrope glutamatreceptorer , de to andre er AMPA- og kainatreceptorer . Afhængigt af dens underenhedssammensætning, dets ligander er glutamat og glycin (eller D -serin ). Imidlertid er bindingen af liganderne typisk ikke tilstrækkelig til at åbne kanalen, da den kan blokeres af Mg 2+ -ioner, som kun fjernes, når neuronen er tilstrækkeligt depolariseret. Således fungerer kanalen som en "tilfældighedsdetektor", og først når begge disse betingelser er opfyldt, åbnes kanalen, og den tillader positivt ladede ioner (kationer) at strømme gennem cellemembranen . NMDA -receptoren menes at være meget vigtig for at kontrollere synaptisk plasticitet og formidle lærings- og hukommelsesfunktioner .
NMDA -receptoren er ionotrop , hvilket betyder, at det er et protein, der tillader passage af ioner gennem cellemembranen. NMDA-receptoren er dette navn, fordi den agonist molekyle N -methyl- D -aspartat (NMDA) binder selektivt til det, og ikke til andre glutamatreceptorer . Aktivering af NMDA -receptorer resulterer i åbning af ionkanalen, der ikke er selektiv til kationer , med et kombineret reverseringspotentiale nær 0 mV. Mens åbningen og lukningen af ionkanalen primært er lukket af ligandbinding, er strømmen gennem ionkanalen spændingsafhængig. Ekstracellulære magnesium (Mg 2+ ) og zink (Zn 2+ ) ioner kan binde til bestemte steder på receptoren og blokere passage af andre kationer gennem den åbne ionkanal. Depolarisering af cellen løsner og afviser Mg 2+ og Zn 2+ -ionerne fra poren, hvilket tillader en spændingsafhængig strøm af natrium (Na + ) og calcium (Ca 2+ ) ioner ind i cellen og kalium (K + ) ud af cellen. Ca 2+ flux gennem NMDA -receptorer anses især for at være kritisk i synaptisk plasticitet, en cellulær mekanisme til læring og hukommelse, på grund af proteiner, der binder til og aktiveres af Ca 2+ ioner.
NMDA -receptorens aktivitet påvirkes af mange psykoaktive lægemidler, såsom phencyclidin (PCP), alkohol ( ethanol ) og dextromethorphan (DXM). De bedøvelsesmæssige og smertestillende virkninger af lægemidlerne ketamin og lattergas skyldes delvist deres virkninger på NMDA -receptoraktivitet. Imidlertid overaktivering af NMDAR øger cytosoliske koncentrationer af calcium og zink , som i væsentlig grad bidrager til neural død , der findes at være forhindret af cannabinoider , med krav om en HINT1 protein til at modvirke de toksiske virkninger af NMDAR-medieret NO produktion og zink frigivelse , gennem aktivering af CB1 -receptoren . Udover at forhindre methamphetamin (Meth) induceret neurotoksicitet via hæmning af nitrogenoxidsyntase (nNOS) ekspression og astrocytaktivering ses det at reducere methamphetamin induceret hjerneskade gennem henholdsvis CB1-afhængige og uafhængige mekanismer, og hæmning af methamphetamin induceret astrogliose er sandsynligvis forekomme gennem en CB2 -receptorafhængig mekanisme for THC . Siden 1989 er memantin blevet anerkendt som en ikke -konkurrencedygtig antagonist af NMDA -receptoren, der kommer ind i receptorens kanal, efter at den er blevet aktiveret og derved blokerer ionstrømmen.
Overaktivering af receptoren, der forårsager overdreven tilstrømning af Ca 2+, kan føre til excitotoksicitet, hvilket antydes at være involveret i nogle neurodegenerative lidelser. Blokering af NMDA -receptorer kunne derfor i teorien være nyttig til behandling af sådanne sygdomme. Imidlertid kan hypofunktion af NMDA -receptorer (på grund af glutathionmangel eller andre årsager) være involveret i forringelse af synaptisk plasticitet og kan have andre negative konsekvenser. Hovedproblemet med anvendelsen af NMDA -receptorantagonister til neurobeskyttelse er, at NMDA -receptorens fysiologiske handlinger er afgørende for normal neuronal funktion. For at være klinisk nyttige skal NMDA -antagonister blokere overdreven aktivering uden at forstyrre normale funktioner. Memantine har denne ejendom.
Historie
Opdagelsen af NMDA -receptorer blev efterfulgt af syntese og undersøgelse af N -methyl -D -asparaginsyre (NMDA) i 1960'erne af Jeff Watkins og kolleger. I begyndelsen af 1980'erne viste NMDA -receptorer at være involveret i flere centrale synaptiske veje. Receptorsubenhedens selektivitet blev opdaget i begyndelsen af 1990'erne, hvilket førte til anerkendelse af en ny klasse af forbindelser, der selektivt hæmmer NR2B -underenheden. Disse resultater førte til en kraftig kampagne i medicinalindustrien. Fra dette blev det anset for, at NMDA -receptorer var forbundet med en række neurologiske lidelser, såsom epilepsi , Parkinsons , Alzheimers , Huntingtons og andre CNS -lidelser.
I 2002 blev det opdaget af Hilmar Bading og medarbejdere, at de cellulære konsekvenser af NMDA-receptorstimulering afhænger af receptorens placering på den neuronale celleoverflade. Synaptiske NMDA-receptorer fremmer genekspression, plasticitetsrelaterede hændelser og erhvervet neurobeskyttelse . Ekstrasynaptiske NMDA -receptorer fremmer dødssignalering; de forårsager transskriptionel lukning, mitokondriel dysfunktion og strukturel opløsning. Denne patologiske triade af ekstrasynaptisk NMDA -receptorsignalering repræsenterer et fælles omdannelsespunkt i ætiologien for flere akutte og kroniske neurodegenerative tilstande. Det molekylære grundlag for toksisk ekstrasynaptisk NMDA-receptorsignalering blev afdækket af Hilmar Bading og kolleger i 2020. Ekstrasynaptiske NMDA-receptorer danner et dødssignalkompleks med TRPM4. NMDAR/TRPM4 -interaktionsinterfacehæmmere (også kendt som 'grænsefladehæmmere') forstyrrer NMDAR/TRPM4 -komplekset og afgift ekstrasynaptiske NMDA -receptorer.
Et tilfældigt fund blev fundet i 1968, da en kvinde tog amantadin som influenzalægemiddel og oplevede bemærkelsesværdig remission af sine Parkinsons symptomer. Dette fund, rapporteret af Scawab et al., Var begyndelsen på medicinsk kemi af adamantanderivater i forbindelse med sygdomme, der påvirker CNS. Inden dette fund var memantine, et andet adamantanderivat, blevet syntetiseret af Eli Lilly og Company i 1963. Formålet var at udvikle et hypoglykæmisk lægemiddel, men det viste ingen sådan effekt . Det var først i 1972, at en mulig terapeutisk betydning af memantin blev opdaget for behandling af neurodegenerative lidelser. Fra 1989 er memantin blevet anerkendt som en ikke -konkurrencedygtig antagonist af NMDA -receptoren.
Struktur
Funktionelle NMDA -receptorer er heterotetramere sammensat af to GluN1 og typisk to GluN2 -underenheder. Der er en GluN1, fire GluN2 og to GluN3 -underenheder, der koder for gener, og hvert gen kan producere mere end én splejsningsvariant.
- GluN1 - GRIN1
- GluN2
- GluN3
Gating
NMDA -receptoren er en glutamat- og ionkanalproteinreceptor , der aktiveres, når glycin og glutamat binder sig til den. Receptoren er et heteromert kompleks, der interagerer med flere intracellulære proteiner af tre forskellige underenheder: GluN1, GluN2 og GluN3. GluN1 har otte forskellige isoformer på grund af alternativ splejsning af genet GRIN1. Der er fire forskellige GluN2 -underenheder (AD) og to forskellige Glun3 -underenheder (A og B). Seks separate gener koder for GluN2 og GluN3. Alle underenhederne deler en fælles membrantopologi, der er domineret af en stor ekstracellulær N-terminal, et membranområde, der omfatter tre transmembransegmenter, en genindtrængende poreløjfe, en ekstracellulær sløjfe mellem transmembransegmenterne, der strukturelt ikke er velkendte, og en intracellulær C-terminal, som er forskellige i størrelse afhængigt af underenheden og giver flere interaktionssteder med mange intracellulære proteiner. Figur 1 viser en grundlæggende struktur for GluN1/GluN2 -underenheder, der danner bindingsstedet for memantin, Mg 2+ og ketamin .
Mg 2+ blokerer NMDA-receptorkanalen på en spændingsafhængig måde. Kanalerne er også meget gennemtrængelige for Ca 2+ . Aktivering af receptoren afhænger af glutamatbinding, D -serin eller glycinbinding på dets GluN1 -bundne bindingssted og AMPA -receptor -medieret depolarisering af den postsynaptiske membran, som aflaster den spændingsafhængige kanalblok af Mg 2+ . Aktivering og åbning af receptorkanalen tillader således strømmen af K + , Na + og Ca 2+ ioner, og tilstrømningen af Ca 2+ udløser intracellulære signalveje. Allosteriske receptorbindingssteder for zink, proteiner og polyaminerne spermidin og spermin er også modulatorer for NMDA -receptorkanalerne.
GluN2B -underenheden har været involveret i modulering af aktivitet såsom læring, hukommelse, bearbejdning og fodring adfærd, samt været impliceret i antallet af menneskelige forstyrrelser. Den grundlæggende struktur og funktioner forbundet med NMDA -receptoren kan tilskrives GluN2B -underenheden. For eksempel dannes glutamatbindingsstedet og kontrollen af Mg 2+ -blokken af GluN2B -underenheden. De høje affinitet sites for glycin -antagonist er også udelukkende vises af GluN1 / GluN2B receptoren.
GluN1/GluN2B transmembransegmenter anses for at være den del af receptoren, der danner bindelommerne for ikke -konkurrerende NMDA -receptorantagonister, men transmembransegmentets strukturer er ikke fuldstændigt kendt som angivet ovenfor. Det hævdes, at tre bindingssteder i receptoren, A644 på GluNB -underenheden og A645 og N616 på GluN1 -underenheden, er vigtige for binding af memantin og beslægtede forbindelser som vist i figur 2.
NMDA -receptoren danner en heterotetramer mellem to GluN1- og to GluN2 -underenheder (underenhederne blev tidligere betegnet GluN1 og GluN2), to obligatoriske GluN1 -underenheder og to regionalt lokaliserede GluN2 -underenheder. En beslægtet genfamilie af GluN3 A- og B -underenheder har en hæmmende virkning på receptoraktivitet. Flere receptor isoformer med særskilte hjerne fordelinger og funktionelle egenskaber opstår ved selektiv splejsning af GluN1 transkripter og differentiel ekspression af de GluN2 subunits.
Hver receptorsubenhed har et modulært design, og hvert strukturelt modul repræsenterer også en funktionel enhed:
- Det ekstracellulære domæne indeholder to kugleformede strukturer: et modulerende domæne og et ligandbindende domæne. GluN1-underenheder binder co-agonisten glycin og GluN2-underenheder binder neurotransmitteren glutamat.
- De agonist-bindende modul links til en membran domæne, der består af tre transmembrane segmenter og en indadgående loop minder om selektiviteten filter af kaliumkanaler .
- De membran domæne bidrager rester til kanalporen og er ansvarlig for receptorens høj ensartet ledningsevne , høj calciumpermeabilitet, og spændingsafhængig magnesiumblokken.
- Hver underenhed har et omfattende cytoplasmatisk domæne , som indeholder rester, der direkte kan modificeres af en række proteinkinaser og proteinphosphataser , samt rester, der interagerer med et stort antal struktur-, adapter- og stilladsproteiner.
Glycinbindingsmodulerne i GluN1- og GluN3-underenhederne og glutamatbindingsmodulet i GluN2A-underenheden er udtrykt som opløselige proteiner, og deres tredimensionelle struktur er blevet løst ved atomopløsning ved røntgenkrystallografi . Dette har afsløret en fælles fold med aminosyre-bindende bakterielle proteiner og med glutamat-bindende modul af AMPA-receptorer og kainat-receptorer.
Handlingsmekanisme
Overaktivering af NMDA -receptorer, hvilket forårsager overdreven tilstrømning af Ca 2+ kan føre til excitotoksicitet. Excitotoksicitet antydes at være involveret i nogle neurodegenerative lidelser, såsom Alzheimers sygdom, Parkinsons sygdom og Huntingtons sygdom. Blokering af NMDA -receptorer kunne derfor i teorien være nyttig til behandling af sådanne sygdomme. Det er imidlertid vigtigt at bevare fysiologisk NMDA -receptoraktivitet, mens man forsøger at blokere dets overdrevne, excitotoksiske aktivitet. Dette kan muligvis opnås ved ikke -konkurrerende antagonister, der blokerer receptorernes ionkanal, når den er overdrevent åben.
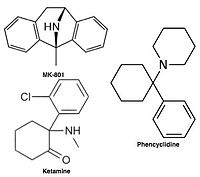
Ukonkurrerende NMDA -receptorantagonister eller kanalblokkere, kommer ind i NMDA -receptorens kanal, efter at den er blevet aktiveret og blokerer derved ionstrømmen. MK-801 , ketamin , amantadin og memantin er eksempler på sådanne antagonister, se figur 1. En antagonists off-rate fra receptorkanalen er en vigtig faktor, da for langsom off-rate kan forstyrre receptorens normale funktion og også hurtig off-rate kan give ineffektiv blokade af en alt for åben receptor.
Memantine er et eksempel på en ikke-konkurrencedygtig kanalblokker af NMDA-receptoren med en relativt hurtig off-rate og lav affinitet. Ved fysiologisk pH er dens amingruppe positivt ladet, og dens receptorantagonisme er spændingsafhængig. Det efterligner derved den fysiologiske funktion af Mg 2+ som kanalblokker. Memantine blokerer kun NMDA -receptorassocierede kanaler under langvarig aktivering af receptoren, da den forekommer under excitotoksiske forhold, ved at udskifte magnesium på bindingsstedet. Under normal receptoraktivitet forbliver kanalerne kun åbne i flere millisekunder, og under disse omstændigheder er memantine ude af stand til at binde i kanalerne og forstyrrer derfor ikke normal synaptisk aktivitet.
Varianter
GluN1
Der er otte varianter af GluN1 -underenheden produceret ved alternativ splejsning af GRIN1 :
- GluN1-1a, GluN1-1b; GluN1-1a er den mest udbredte form.
- GluN1-2a, GluN1-2b;
- GluN1-3a, GluN1-3b;
- GluN1-4a, GluN1-4b;
GluN2
Mens en enkelt GluN2 -underenhed findes i hvirvelløse organismer, udtrykkes fire forskellige isoformer af GluN2 -underenheden i hvirveldyr og henvises til med nomenklaturen GluN2A gennem GluN2D (kodet af GRIN2A , GRIN2B , GRIN2C , GRIN2D ). Stærke beviser viser, at generne, der koder for GluN2 -underenhederne hos hvirveldyr, har gennemgået mindst to runder med genduplikation. De indeholder bindingsstedet for glutamat . Endnu vigtigere har hver GluN2-underenhed et andet intracellulært C-terminalt domæne, der kan interagere med forskellige sæt signalmolekyler. I modsætning til GluN1 -underenheder udtrykkes GluN2 -underenheder differentielt på tværs af forskellige celletyper og udviklingsmæssige tidspunkter og styrer de elektrofysiologiske egenskaber ved NMDA -receptoren. I klassiske kredsløb er GluN2B hovedsageligt til stede i umodne neuroner og på ekstrasynaptiske steder og indeholder bindingsstedet for den selektive inhibitor ifenprodil . I pyramidale cellesynapser i den nyudviklede dorsolaterale præfrontale cortex af primater er GluN2B imidlertid udelukkende inden for den postsynaptiske densitet og formidler højere kognitive operationer, f.eks. Arbejdshukommelse. Dette er i overensstemmelse med ekspansionen i GluN2B -handlinger og udtryk på tværs af det kortikale hierarki hos aber og mennesker og på tværs af primat cortex evolution.
GluN2B til GluN2A switch
Mens GluN2B er fremherskende i den tidlige postnatale hjerne, stiger antallet af GluN2A -underenheder under tidlig udvikling; til sidst bliver GluN2A -underenheder flere end GluN2B. Dette kaldes GluN2B-GluN2A-udviklingsomskifteren og er bemærkelsesværdig på grund af de forskellige kinetik, hver GluN2-underenhed bidrager til receptorfunktion. For eksempel fører større forhold mellem GluN2B -underenheden til NMDA -receptorer, der forbliver åbne længere i forhold til dem med mere GluN2A. Dette kan til dels stå for større hukommelsesevner i den umiddelbare postnatale periode sammenlignet med sent i livet, hvilket er princippet bag genetisk ændrede ' doogie mus '. Det detaljerede tidsforløb for denne switch i det humane lillehjerne er blevet estimeret ved hjælp af ekspressionsmikroarray og RNA seq og er vist i figuren til højre.
Der er tre hypotetiske modeller til at beskrive denne switch -mekanisme:
- Stigning i synaptisk GluN2A sammen med fald i GluN2B
- Ekstrasynaptisk forskydning af GluN2B væk fra synapsen med stigning i GluN2A
- Forøgelse af GluN2A fortynding af antallet af GluN2B uden faldet af sidstnævnte.
GluN2B- og GluN2A -underenhederne har også forskellige roller i formidling af excitotoksisk neuronal død. Det udviklingsmæssige skift i underenhedssammensætning menes at forklare udviklingsmæssige ændringer i NMDA -neurotoksicitet. Homozygot forstyrrelse af genet for GluN2B i mus forårsager perinatal dødelighed , hvorimod afbrydelse af GluN2A -genet producerer levedygtige mus, skønt med nedsat hippocampus plasticitet. En undersøgelse tyder på, at reelin kan spille en rolle i NMDA -receptormodning ved at øge GluN2B -underenhedens mobilitet.
GluN2B til GluN2C switch
Granulacelleforstadier (GCP'er) i lillehjernen efter at have gennemgået symmetrisk celledeling i det ydre granulacellag (EGL), vandrer ind i det indre granulacellag (IGL), hvor de nedregulerer GluN2B og aktiverer GluN2C, en proces, der er uafhængig af neuregulin beta -signalering gennem ErbB2- og ErbB4 -receptorer.
Rolle i excitotoksicitet
NMDA -receptorer er blevet impliceret af en række undersøgelser for at være stærkt involveret i excitotoksicitet . Fordi NMDA -receptorer spiller en vigtig rolle i neurons sundhed og funktion , har der været megen diskussion om, hvordan disse receptorer kan påvirke både cellens overlevelse og celledød. Nylige beviser understøtter hypotesen om, at overstimulering af ekstrasynaptiske NMDA -receptorer har mere at gøre med excitotoksicitet end stimulering af deres synaptiske modstykker. Selvom stimulering af ekstrasynaptiske NMDA -receptorer ser ud til at bidrage til celledød, er der desuden tegn på, at stimulering af synaptiske NMDA -receptorer bidrager til cellens sundhed og levetid. Der er rigeligt med beviser for at understøtte NMDA -receptorernes dobbelte karakter baseret på placering, og hypotesen, der forklarer de to forskellige mekanismer, er kendt som "lokaliseringshypotesen".
Forskellige kaskadeveje
For at understøtte lokaliseringshypotesen ville det være nødvendigt at vise forskellige cellulære signalveje aktiveret af NMDA -receptorer baseret på dets placering i cellemembranen. Eksperimenter er designet til udelukkende at stimulere enten synaptiske eller ikke-synaptiske NMDA-receptorer. Disse typer af eksperimenter har vist, at forskellige veje aktiveres eller reguleres afhængigt af placeringen af signalets oprindelse. Mange af disse veje bruger de samme proteinsignaler , men reguleres modsat af NMDAR afhængigt af dets placering. For eksempel forårsagede synaptisk NMDA-excitation et fald i den intracellulære koncentration af p38 mitogenaktiveret proteinkinase ( p38MAPK ). Ekstrasynaptisk stimulering NMDAR regulerede p38MAPK på den modsatte måde, hvilket forårsagede en stigning i intracellulær koncentration. Eksperimenter af denne type er siden blevet gentaget med resultaterne, der indikerer, at disse forskelle strækker sig over mange veje forbundet med celleoverlevelse og excitotoksicitet.
To specifikke proteiner er blevet identificeret som en vigtig vej, der er ansvarlig for disse forskellige cellulære responser ERK1/2 og Jacob. ERK1/2 er ansvarlig for fosforylering af Jacob, når den ophidses af synaptiske NMDAR'er. Disse oplysninger transporteres derefter til kernen . Fosforylering af Jacob finder ikke sted med ekstrasynaptisk NMDA -stimulering. Dette gør det muligt for transkriptionsfaktorer i kernen at reagere forskelligt baseret på fosforyleringstilstanden for Jacob.
Neural plasticitet
NMDA -receptorer er også forbundet med synaptisk plasticitet. Ideen om, at både synaptiske og ekstrasynaptiske NMDA-receptorer kan påvirke langsigtet potentiering (LTP) og langvarig depression (LTD) forskelligt, er også blevet undersøgt. Eksperimentelle data tyder på, at ekstrasynaptiske NMDA -receptorer hæmmer LTP, mens de producerer LTD. Inhibering af LTP kan forhindres ved indførelse af en NMDA -antagonist . En theta burst -stimulering, der normalt inducerer LTP med synaptiske NMDAR'er, når det anvendes selektivt på ekstrasynaptiske NMDAR'er, producerer et LTD. Eksperimenter indikerer også, at ekstrasynaptisk aktivitet ikke er nødvendig for dannelsen af LTP. Derudover er både synaptisk og ekstrasynaptisk involveret i at udtrykke et fuldt LTD.
De forskellige underenheders rolle
En anden faktor, der synes at påvirke NMDAR -induceret toksicitet, er den observerede variation i underenhedens makeup. NMDA -receptorer er heterotetramere med to GluN1 -underenheder og to variable underenheder. To af disse variable underenheder, GluN2A og GluN2B, har fortrinsvis ført til henholdsvis celleoverlevelse og celledødskaskader. Selvom begge underenheder findes i synaptiske og ekstrasynaptiske NMDAR'er, er der tegn på, at GluN2B -underenheden forekommer hyppigere i ekstrasynaptiske receptorer. Denne observation kunne hjælpe med at forklare den dualistiske rolle, som NMDA -receptorer spiller i excitotoksicitet.
På trods af de overbevisende beviser og den relative enkelhed af disse to teorier, der arbejder sammen, er der stadig uenighed om betydningen af disse påstande. Nogle problemer med at bevise disse teorier opstår med vanskeligheden ved at bruge farmakologiske midler til at bestemme undertyperne af specifikke NMDAR'er. Derudover forklarer teorien om underenhedsvariation ikke, hvordan denne effekt kan dominere, da det er udbredt, at den mest almindelige tetramer, der består af to GluN1 -underenheder og en af hver underenhed GluN2A og GluN2B, udgør en høj procentdel af NMDAR'erne .
Excitotoksicitet i kliniske omgivelser
Eksitotoksicitet har været antaget at spille en rolle i de degenerative egenskaber ved neurodegenerative tilstande siden slutningen af 1950'erne. NMDA -receptorer synes at spille en vigtig rolle i mange af disse degenerative sygdomme, der påvirker hjernen. Især excitotoksiske hændelser, der involverede NMDA -receptorer, har været forbundet med Alzheimers sygdom og Huntingtons sygdom samt med andre medicinske tilstande som slagtilfælde og epilepsi. Behandling af disse tilstande med en af de mange kendte NMDA -receptorantagonister fører imidlertid til en række uønskede bivirkninger, hvoraf nogle kan være alvorlige. Disse bivirkninger observeres til dels, fordi NMDA -receptorerne ikke bare signalerer celledød, men også spiller en vigtig rolle i dets vitalitet. Behandling af disse tilstande kan findes ved at blokere NMDA -receptorer, der ikke findes ved synapsen. Én klasse af excitotoksicitet ved sygdom inkluderer gain-of-function mutationer i GRIN2B og GRIN1 forbundet med kortikale misdannelser, såsom polymicrogyria .
Ligander
Agonister


Aktivering af NMDA -receptorer kræver binding af glutamat eller aspartat (aspartat stimulerer ikke receptorerne så stærkt). Derudover kræver NMDAR'er også bindingen af co-agonisten glycin for effektiv åbning af ionkanalen, som er en del af denne receptor.
D -Serine har også vist sig at co -agonisere NMDA -receptoren med endnu større styrke end glycin. Det produceres af serin racemase og er beriget i de samme områder som NMDA -receptorer. Fjernelse af D -serin kan blokere NMDA -medieret excitatorisk neurotransmission på mange områder. For nylig er det blevet vist, at D -serin kan frigives både af neuroner og astrocytter for at regulere NMDA -receptorer.
NMDA-receptor (NMDAR) -medierede strømme er direkte relateret til membrandepolarisering. NMDA -agonister udviser derfor hurtig Mg 2+ -bindingskinetik, hvilket øger sandsynligheden for åben kanal med depolarisering. Denne egenskab er grundlæggende for NMDA -receptorens rolle i hukommelse og læring , og det er blevet foreslået, at denne kanal er et biokemisk substrat for hebbisk læring , hvor den kan fungere som en tilfældighedsdetektor for membrandepolarisering og synaptisk transmission.
Eksempler
Nogle kendte NMDA -receptoragonister omfatter:
- Alanin ( D -alanin , L -alanin ) -endogen agonist på glycin -stedet
- Aspartinsyre (aspartat) - endogen glutamat -agonist
- Glutaminsyre (glutamat) - endogen glutamat -agonist
- Glycin - endogen glyon -site -agonist
- Homocysteinsyre - endogen glutamat -agonist
- Ibotensyre - naturligt forekommende glutamat -agonist fundet i Amanita muscaria
- Milacemid - syntetisk glycin -agonist; prodrug af glycin
- Kinolinsyre (quinolinat) - endogen glutamat -agonist
- Sarcosine - endogen glyon -site -agonist
- Serin ( D -serin , L -serin ) -endogen agonist på glycin -stedet
- Spermidin - endogen polyamin -agonist
- Spermin - endogen polyamin -site -agonist
- Tetrazolylglycin - agonist for syntetisk glutamatsted
Positive allosteriske modulatorer omfatter:
- Cerebrosterol - endogen svag positiv allosterisk modulator
- Kolesterol - endogen svag positiv allosterisk modulator
- Dehydroepiandrosteron (DHEA) - endogen svag positiv allosterisk modulator
- Dehydroepiandrosteronsulfat (DHEA-S)-endogen svag positiv allosterisk modulator
- Nebostinel (neboglamin) - syntetisk positiv allosterisk modulator af glycinstedet
- Pregnenolonsulfat - endogen svag positiv allosterisk modulator
Neramexane
Et eksempel på memantin derivatet er neramexan som blev opdaget ved at studere antal aminoalkylgrupper cyclohexaner , med memantin som skabelon, som NMDA-receptorantagonister. Neramexan, som kan ses i figur 6, binder sig til det samme sted som memantin i den NMDA -receptorassocierede kanal og med sammenlignelig affinitet. Det viser også meget lignende biotilgængelighed og blokering af kinetik in vivo som memantin. Neramexane gik til kliniske forsøg for fire indikationer, herunder Alzheimers sygdom.
Delvise agonister

N -Methyl- D -asparaginsyre (NMDA), som NMDA-receptoren blev opkaldt efter, er en partiel agonist for den aktive eller glutamat genkendelsessted.
3,5 -Dibromo -L -phenylalanin, et naturligt forekommende halogeneret derivat af L -phenylalanin , er en svag delvis NMDA -receptoragonist, der virker på glycinstedet. 3,5-Dibromo- L -phenylalanin er blevet foreslået som en ny terapeutisk lægemiddelkandidat til behandling af neuropsykiatriske lidelser og sygdomme såsom skizofreni og neurologiske lidelser såsom iskæmisk slagtilfælde og epileptiske anfald .
Andre svage partielle agonister på glycinstedet i NMDA-receptoren, såsom rapastinel (GLYX-13) og apimostinel (NRX-1074), ses nu til udvikling af nye lægemidler med antidepressiv og analgetisk virkning uden åbenlyse psykotomimetiske aktiviteter.
Eksempler
- Aminocyclopropankarboxylsyre (ACC) - delvis agonist på syntetisk glycinsted
- Cycloserine ( D -cycloserin ) -naturligt forekommende delvis agonist på glycinstedet fundet i Streptomyces orchidaceus
- HA-966 -syntetisk glycin-sted svag partiel agonist
- Homoquinolinsyre - syntetisk glutamatsted delvis agonist
- N -Methyl- D -asparaginsyre (NMDA) - syntetisk glutamat websted partiel agonist
Positive allosteriske modulatorer omfatter:
- Apimostinel (NRX-1074) -syntetisk svag partiel agonist af et allosterisk sted på glycinstedet
- Rapastinel (GLYX-13)-syntetisk svag partiel agonist af et allosterisk sted på glycinstedet
Antagonister

Antagonister til NMDA -receptoren bruges som bedøvelsesmidler til dyr og undertiden mennesker og bruges ofte som rekreative lægemidler på grund af deres hallucinogene egenskaber ud over deres unikke virkninger ved forhøjede doser, såsom dissociation . Når visse NMDA -receptorantagonister gives til gnavere i store doser, kan de forårsage en form for hjerneskade kaldet Olneys læsioner . NMDA -receptorantagonister, der har vist sig at forårsage Olneys læsioner, omfatter ketamin , phencyclidin og dextrorphan (en metabolit af dextromethorphan ) samt nogle NMDA -receptorantagonister, der kun bruges i forskningsmiljøer. Indtil videre er den offentliggjorte forskning om Olneys læsioner uafklarende i dens forekomst på humane eller abehjernevæv med hensyn til en stigning i tilstedeværelsen af NMDA -receptorantagonister.
De fleste NMDAR-antagonister er ikke- konkurrencedygtige eller ikke-konkurrerende blokkere af kanalporen eller er antagonister af glycin-ko-reguleringsstedet i stedet for antagonister for det aktive/glutamat-sted.
Eksempler
Almindelige midler, hvor NMDA -receptorantagonisme er den primære eller vigtigste virkningsmekanisme:
- 4-Chlorokynurenine (AV-101)-glycin -stedantagonist ; prodrug af 7-chlorokynureninsyre
- 7-Chlorokynurenic acid -glycin site antagonist
- Agmatine - endogen polyamin -stedantagonist
- Argiotoxin-636 -naturligt forekommende dizocilpine eller beslægtet stedantagonist fundet i Argiope gift
- AP5 - antagonist af glutamatsted
- AP7 - antagonist til glutamatsted
- CGP-37849 -antagonist af glutamatsted
- Delucemine (NPS-1506)-dizocilpin eller beslægtet stedantagonist ; afledt af argiotoxin-636
- Dextromethorphan (DXM) - dizocilpinsite -antagonist; prodrug af dextrorphan
- Dextrorphan (DXO) - dizocilpinsite -antagonist
- Dexanabinol -dizocilpinerelateret stedantagonist
- Diethylether - ukendt stedantagonist
- Diphenidin - dizocilpin -antagonist
- Dizocilpine (MK-801) -dizocilpin -antagonist
- Eliprodil - ifenprodil site antagonist
- Esketamin - dizocilpin -antagonist
- Hodgkinsine - en udefineret stedantagonist
- Ifenprodil - ifenprodil site antagonist
- Kaitocephalin - naturligt forekommende antagonist på glutamatstedet fundet i Eupenicillium shearii
- Ketamin - dizocilpin -antagonist
- Kynureninsyre - endogen glycin -stedantagonist
- Lanicemin -lav-fangende dizocilpinsite-antagonist
- LY-235959-antagonist af glutamatsted
- Memantine -lav-fangende dizocilpinsite-antagonist
- Methoxetamin - dizocilpin -antagonist
- Midafotel - antagonist for glutamatsted
- Dinitrogenoxid (N 2 O) - en udefineret stedantagonist
- PEAQX - antagonist til glutamatsted
- Perzinfotel - antagonist af glutamatsted
- Phencyclidine (PCP) - dizocilpin -antagonist
- Phenylalanin - en naturligt forekommende aminosyre, glycin -stedantagonist
- Psychotridine - udefineret stedantagonist
- Selfotel - antagonist for glutamatsted
- Tiletamin - dizocilpin -antagonist
- Traxoprodil - antagonist af ifenprodil -sted
- Xenon - ukendt stedantagonist
Nogle almindelige midler, hvor svag NMDA -receptorantagonisme er en sekundær eller yderligere handling, omfatter:
- Amantadine - et antiviralt og antiparkinsonisk lægemiddel; lav-fangende dizocilpinsite-antagonist
- Atomoxetine - en noradrenalin genoptagelseshæmmer, der bruges til behandling af ADHD
- Dextropropoxyphene - et opioid analgetikum
- Ethanol ( alkohol ) - et euforiserende , beroligende og angstdæmpende anvendt rekreativt; ukendt stedantagonist
- Guaifenesin - en slimløsende
- Huperzin A - en naturligt forekommende acetylcholinesteraseinhibitor og potentiel antidemens middel
- Ibogaine - et naturligt forekommende hallucinogen og anti -vanedannende middel
- Ketobemidon - et opioid analgetikum
- Methadon - et opioid analgetikum
- Minocyclin - et antibiotikum
- Tramadol - et atypisk opioid analgetikum og serotoninfrigivende middel
Nitromemantin
NMDA-receptoren reguleres via nitrosylering, og aminoadamantan kan bruges som en målrettet shuttle til at bringe nitrogenoxid (NO) tæt på stedet i NMDA-receptoren, hvor den kan nitrosylere og regulere ionkanalkonduktiviteten. En NO -donor, der kan bruges til at reducere NMDA -receptoraktivitet, er alkylnitrat nitroglycerin. I modsætning til mange andre NO -donorer har alkylnitrater ikke potentielle NO -associerede neurotoksiske virkninger. Alkylnitrater donerer NO i form af en nitrogruppe som set i figur 7, -NO 2 -, som er en sikker donor, der undgår neurotoksicitet. Nitrogruppen skal målrettes mod NMDA -receptoren, ellers kan der opstå andre effekter af NO, såsom dilatation af blodkar og deraf følgende hypotension . Nitromemantin er en anden generations derivat af memantin, det reducerer excitotoksicitet medieret af overaktivering af det glutamatergiske system ved at blokere NMDA-receptor uden at gå på kompromis med sikkerheden. Foreløbige undersøgelser af dyremodeller viser, at nitromemantiner er mere effektive end memantin som neurobeskyttelsesmidler, både in vitro og in vivo. Memantine og nyere derivater kan blive meget vigtige våben i kampen mod neuronal skade.
Negative allosteriske modulatorer omfatter:
- 25-Hydroxycholesterol -endogen svag negativ allosterisk modulator
- Conantokins - naturligt forekommende negative allosteriske modulatorer af polyaminstedet fundet i Conus geografus
Modulatorer
Eksempler
NMDA -receptoren moduleres af en række endogene og eksogene forbindelser:
- Aminoglycosider har vist sig at have en lignende virkning som polyaminer, og dette kan forklare deres neurotoksiske virkning.
- CDK5 regulerer mængden af NR2B -indeholdende NMDA -receptorer på den synaptiske membran og påvirker dermed synaptisk plasticitet .
- Polyaminer aktiverer ikke direkte NMDA-receptorer, men virker i stedet for at forstærke eller hæmme glutamat-medierede reaktioner.
- Reelin modulerer NMDA -funktion gennem Src -familiens kinaser og DAB1 . markant forbedring af LTP i hippocampus .
- Src kinase forbedrer NMDA -receptorstrømme.
- Na + , K + og Ca 2+ passerer ikke kun gennem NMDA -receptorkanalen, men modulerer også aktiviteten af NMDA -receptorer.
- Zn 2+ og Cu 2+ blokerer generelt NMDA-strømaktivitet på en ikke-konkurrencedygtig og spændingsuafhængig måde. Zink kan imidlertid forstærke eller hæmme strømmen afhængigt af den neurale aktivitet.
- Pb 2+ er en stærk NMDAR -antagonist. Presynaptiske underskud som følge af Pb 2+ eksponering under synaptogenese medieres af forstyrrelse af NMDAR-afhængig BDNF-signalering.
- Proteiner fra den store histokompatibilitetskompleks klasse I er endogene negative regulatorer af NMDAR-medierede strømme i den voksne hippocampus og er nødvendige for passende NMDAR-inducerede ændringer i AMPAR- handel og NMDAR-afhængig synaptisk plasticitet og indlæring og hukommelse .
- NMDA -receptorernes aktivitet er også påfaldende følsom over for ændringer i pH og delvis hæmmet af den omgivende koncentration af H + under fysiologiske betingelser. Inhiberingsniveauet af H + reduceres kraftigt i receptorer, der indeholder NR1a -undertypen, som indeholder den positivt ladede indsats Exon 5. Effekten af denne indsats kan efterlignes af positivt ladede polyaminer og aminoglycosider, hvilket forklarer deres virkningsmåde.
- NMDA-receptorfunktionen er også stærkt reguleret af kemisk reduktion og oxidation via det såkaldte "redox-modulerende sted." Gennem dette websted forbedrer reduktanter dramatisk NMDA -kanalaktiviteten, hvorimod oxidanter enten vender virkningerne af reduktanter eller nedtrykker native reaktioner. Det antages generelt, at NMDA -receptorer moduleres af endogene redoxmidler, såsom glutathion , liponsyre og det essentielle næringsstof pyrroloquinolinquinon .
Udvikling af NMDA -receptorantagonister
Hovedproblemet med udviklingen af NMDA -antagonister til neurobeskyttelse er, at fysiologisk NMDA -receptoraktivitet er afgørende for normal neuronal funktion. Fuldstændig blokering af al NMDA -receptoraktivitet resulterer i bivirkninger såsom hallucinationer , uro og anæstesi . For at være klinisk relevant skal en NMDA -receptorantagonist begrænse sin handling til blokering af overdreven aktivering uden at begrænse receptorens normale funktion. Figur 3 viser forenklede modeller af forskellige typer NMDA -receptorantagonister, som vil blive diskuteret yderligere.
Konkurrencedygtige NMDA -receptorantagonister
Konkurrencedygtige NMDA -receptorantagonister, som blev udviklet først, er ikke en god mulighed, fordi de konkurrerer og binder til det samme sted (NR2 -underenhed) på receptoren som agonisten, glutamat og derfor også blokerer normal funktion. De vil blokere sunde områder i hjernen, før de påvirker patologiske områder, fordi sunde områder indeholder lavere niveauer af agonister end patologiske områder. Disse antagonister kan forskydes fra receptoren ved høj koncentration af glutamat, som kan eksistere under excitotoksiske omstændigheder.
Ikke -konkurrerende NMDA -receptorantagonister
Ukonkurrerende NMDA -receptorantagonister blokerer inden for ionkanalen på Mg 2+ -stedet (poreregionen ) og forhindrer overdreven tilstrømning af Ca 2+ . Ikke -konkurrencedygtig antagonisme refererer til en type blok, som en øget koncentration af glutamat ikke kan overvinde, og er afhængig af forudgående aktivering af receptoren af agonisten, dvs. den kommer først ind i kanalen, når den åbnes af agonist.
På grund af disse negative bivirkninger af højaffinitetsblokkere fortsatte søgningen efter klinisk succesrige NMDA -receptorantagonister til neurodegenerative sygdomme og fokuserede på at udvikle lavaffinitetsblokkere. Affiniteten kunne imidlertid ikke være for lav og opholdstid ikke for kort (som set med Mg 2+ ), hvor membrandepolarisering lindrer blokken. Opdagelsen var derved udvikling af en konkurrencedygtig antagonist med længere opholdstid end Mg 2+ i kanalen, men kortere end MK-801. På den måde ville det opnåede lægemiddel kun blokere overdrevent åbne NMDA -receptorassocierede kanaler, men ikke normal neurotransmission. Memantine er det stof. Det er et derivat af amantadin, der først var et anti-influenzamiddel, men senere ved et tilfælde blev opdaget at have effekt ved Parkinsons sygdom. Kemiske strukturer af memantin og amantadin kan ses i figur 5. Forbindelsen blev først antaget at være dopaminerg eller antikolinerg, men blev senere fundet at være en NMDA -receptorantagonist.
Memantine er det første lægemiddel, der er godkendt til behandling af alvorlig og mere avanceret Alzheimers sygdom , som for eksempel antikolinerge lægemidler ikke gør meget godt for. Det hjælper genopretning af synaptisk funktion og forbedrer på den måde nedsat hukommelse og indlæring. I 2015 er memantine også i forsøg med terapeutisk betydning ved yderligere neurologiske lidelser.
Mange anden generations memantinderivater har været under udvikling, der kan vise endnu bedre neurobeskyttende virkninger, hvor hovedtanken er at bruge andre sikre, men effektive modulerende steder på NMDA-receptoren ud over den tilhørende ionkanal.
Strukturaktivitetsforhold (SAR)
Memantin (1-amino-3,5-dimethyladamantan) er et aminoalkylcyclohexanderivat og en atypisk lægemiddelforbindelse med ikke-plan, tredimensionel tricyklisk struktur. Figur 8 viser SAR for aminoalkylcyclohexanderivat. Memantine har flere vigtige funktioner i sin struktur for sin effektivitet:
- Tre -ring struktur med en brohovedamin, -NH 2
- -NH 2 -gruppen protoneres under kroppens fysiologiske pH for at bære en positiv ladning, -NH 3+
- To methyl (CH 3 ) sidegrupper der tjener til at forlænge opholdstiden og forøgelse stabilitet samt affinitet for NMDA-receptoren kanal sammenlignet med amantadin (1-adamantanamin).
På trods af den lille strukturelle forskel mellem memantin og amantadin, to adamantanderivater, er affiniteten for bindingsstedet for NR1/NR2B -underenheden meget større for memantin. I patch-clamp målinger har memantine en IC 50 på (2,3+0,3) μM, mens amantadin har en IC 50 på (71,0+11,1) μM. Bindingsstedet med den højeste affinitet kaldes det dominerende bindingssted. Det involverer en forbindelse mellem amingruppen af memantin og NR1-N161-bindingslommen i NR1/NR2B-underenheden. Methylsidegrupperne spiller en vigtig rolle i at øge affiniteten til de åbne NMDA -receptorkanaler og gøre det til et meget bedre neurobeskyttende lægemiddel end amantadin. Bindingslommerne til methylgrupperne anses for at være ved NR1-A645 og NR2B-A644 i NR1/NR2B. Bindingslommerne er vist i figur 2. Memantin binder på eller i nærheden af Mg 2+ -stedet inde i den NMDA -receptorassocierede kanal. -NH 2 -gruppen på memantin, som er protoneret under kroppens fysiologiske pH, repræsenterer den region, der binder sig ved eller i nærheden af Mg 2+ -stedet. Tilføje to methylgrupper til -N på memantin struktur har vist sig at nedsætte affinitet, hvilket giver en IC 50 -værdi på (28,4 + 1,4) uM.
Anden generations derivat af memantin; nitromemantin
Flere derivater af Nitromemantine, en anden generations derivat af memantin, er blevet syntetiseret for at udføre et detaljeret strukturaktivitetsforhold (SAR) for disse nye lægemidler. En klasse, der indeholdt en nitro (NO 2 ) gruppe modsat brohovedaminen (NH 2 ), viste et lovende resultat. Nitromemantine udnytter memantin bindingssted på NMDA-receptoren at målrette NO x (X = 1 eller 2) gruppe for interaktion med S- nitrosylering / redox site uden for memantin bindingsstedet. Forlængelse af memantins sidekæder kompenserer for den værre lægemiddelaffinitet i kanalen forbundet med tilføjelsen af –ONO 2 -gruppen
Terapeutisk anvendelse
Excitotoksicitet antydes at være involveret i nogle neurodegenerative lidelser, såsom Alzheimers sygdom, Parkinsons sygdom, Huntingtons sygdom og amyotrofisk lateral sklerose . Blokering af NMDA -receptorer kunne derfor i teorien være nyttig til behandling af sådanne sygdomme. Det er imidlertid vigtigt at bevare fysiologisk NMDA -receptoraktivitet, mens man forsøger at blokere dets overdrevne, excitotoksiske aktivitet. Dette kan muligvis opnås ved ikke -konkurrerende antagonister, der blokerer receptorernes ionkanal, når den er overdrevent åben
Memantine er et eksempel på en ikke -konkurrencedygtig NMDA -receptorantagonist, der har godkendt indikation for den neurodegenerative sygdom Alzheimers sygdom. I 2015 er memantin stadig i kliniske forsøg for yderligere neurologiske sygdomme.
Receptor modulering
NMDA-receptoren er en uspecifik kationkanal, der kan tillade passage af Ca 2+ og Na + ind i cellen og K + ud af cellen. Det excitatoriske postsynaptiske potentiale (EPSP) frembragt ved aktivering af en NMDA -receptor øger koncentrationen af Ca 2+ i cellen. Ca 2+ kan igen fungere som en anden messenger i forskellige signalveje . NMDA -receptorkationskanalen blokeres imidlertid af Mg 2+ ved hvilemembranpotentiale. Magnesiumblokeringen er ikke øjeblikkelig. For at fjerne blokering af alle tilgængelige kanaler skal den postsynaptiske celle depolariseres i en tilstrækkelig lang periode (i skalaen på millisekunder).
Derfor fungerer NMDA -receptoren som en "molekylær tilfældighedsdetektor ". Dens ionkanal åbner kun, når følgende to betingelser er opfyldt: glutamat er bundet til receptoren, og den postsynaptiske celle depolariseres (hvilket fjerner Mg 2+, der blokerer kanalen). Denne egenskab ved NMDA-receptoren forklarer mange aspekter af langsigtet potentiering (LTP) og synaptisk plasticitet .
NMDA -receptorer moduleres af en række endogene og eksogene forbindelser og spiller en nøglerolle i en lang række fysiologiske (f.eks. Hukommelse ) og patologiske processer (f.eks. Excitotoksicitet ).
Klinisk betydning
NMDAR -antagonister som ketamin , esketamin , tiletamin , phencyclidin , lattergas og xenon bruges som generel bedøvelse . Disse og lignende lægemidler som dextromethorphan og methoxetamin producerer også dissociative , hallucinogene og euforiserende virkninger og bruges som rekreative lægemidler .
NMDAR-hæmmere, herunder ketamin, esketamin ( JNJ -54135419), rapastinel (GLYX-13), apimostinel (NRX-1074), 4-chlorokynurenin (AV-101) og rislenemdaz (CERC-301, MK-0657), er under udvikling til behandling af stemningsforstyrrelser , herunder alvorlig depressiv lidelse og behandlingsresistent depression . Derudover bruges ketamin allerede til dette formål som en off-label terapi i nogle klinikker.
Forskning tyder på, at tianeptin producerer antidepressive virkninger gennem indirekte ændringer og hæmning af glutamatreceptoraktivitet og frigivelse af BDNF , hvilket igen påvirker neural plasticitet . Tianeptin virker også på NMDA- og AMPA -receptorerne . I dyremodeller hæmmer tianeptin de patologiske stressinducerede ændringer i glutamatergisk neurotransmission i amygdala og hippocampus.
Memantine , en lavfældig NMDAR-antagonist, er godkendt i USA og Europa til behandling af moderat til svær Alzheimers sygdom og har nu modtaget en begrænset anbefaling fra Storbritanniens National Institute for Health and Care Excellence til patienter, der ikke lykkes andre behandlingsmuligheder.
Cochlear NMDAR er målet for intens forskning for at finde farmakologiske løsninger til behandling af tinnitus . NMDAR'er er forbundet med en sjælden autoimmun sygdom, anti-NMDA receptor encephalitis (også kendt som NMDAR encephalitis), der normalt opstår på grund af krydsreaktivitet af antistoffer produceret af immunsystemet mod ektopisk hjernevæv, såsom dem, der findes i teratom . Disse er kendt som anti-glutamatreceptorantistoffer .
Sammenlignet med dopaminerge stimulanser som metamfetamin kan NMDAR -antagonisten phencyclidin producere en bredere vifte af symptomer, der ligner skizofreni hos raske frivillige, i det, der har ført til glutamathypotesen om skizofreni . Eksperimenter, hvor gnavere behandles med NMDA -receptorantagonist, er i dag den mest almindelige model, når det kommer til testning af nye skizofreni -behandlinger eller udforskning af den nøjagtige mekanisme for lægemidler, der allerede er godkendt til behandling af skizofreni.
NMDAR antagonister, f.eks eliprodil , gavestinel , licostinel , og selfotel er blevet grundigt undersøgt til behandling af excitotoksicitet medieret neurotoksicitet i situationer som iskæmisk slagtilfælde og traumatisk hjerneskade , men var mislykket i kliniske forsøg , der anvendes i små doser for at undgå sedation, men NMDAR -antagonister kan blokere spredning af depolarisationer hos dyr og hos patienter med hjerneskade. Denne anvendelse er endnu ikke blevet testet i kliniske forsøg.
Se også
Referencer
eksterne links
-
 Medier relateret til NMDA -receptor på Wikimedia Commons
Medier relateret til NMDA -receptor på Wikimedia Commons - NMDA receptor farmakologi
- Motorisk diskordineringsresultater fra kombineret genforstyrrelse af NMDA -receptoren NR2A og NR2C -underenheder, men ikke fra enkelt afbrydelse af NR2A- eller NR2C -underenheden
- Et skematisk diagram opsummerer tre potentielle modeller for skift af NR2A- og NR2B -underenheder ved udvikling af synapser
- Drosophila NMDA -receptor 1 - Den interaktive flue