Oxyanion - Oxyanion
En oxyanion eller oxoanion er en ion med den generiske formel A.
xOz -
y(hvor A betegner en grundstof og O betegner et oxygen- atom). Oxyanioner dannes af et stort flertal af de kemiske grundstoffer . Formlerne for enkle oxyanioner bestemmes af oktetreglen . Den tilsvarende oxy syre i en oxyanion er forbindelsen H
zEN
xO
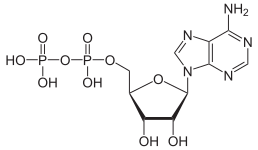
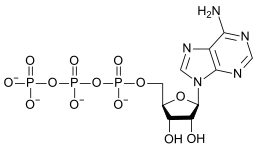
y. Strukturerne af kondenserede oxyanioner kan rationaliseres med hensyn til AO n polyhedrale enheder med deling af hjørner eller kanter mellem polyhedre. Oxyanionerne (specifikt phosphat- og polyphosphatestere) adenosinmonophosphat ( AMP ), adenosindiphosphat ( ADP ) og adenosintriphosphat (ATP) er vigtige i biologien.
Monomeriske oxyanioner
Formlen for monomere oxyanioner, AOm -
n, dikteres af oxidationstilstanden for elementet A og dets placering i det periodiske system . Elementerne i den første række er begrænset til et maksimalt koordinationsnummer på 4. Imidlertid har ingen af de første rækkeelementer en monomer oxyanion med dette koordinationsnummer. I stedet karbonat ( CO2−
3) og nitrat ( NO-
3) har en trigonal plan struktur med π-binding mellem det centrale atom og iltatomerne. Denne π-binding foretrækkes af ligheden i det centrale atom og ilt.
Oxyanionerne af anden række elementer i gruppen oxidationstrin er tetraedrisk . Tetrahedral SiO
4enheder findes i olivinmineraler , [Mg, Fe] SiO
4, men anionen har ikke en separat eksistens, da iltatomerne er omgivet tetraedrisk af kationer i fast tilstand. Phosphat ( PO3−
4), Sulfat ( SO2-
4og perchlorat ( ClO-
4) ioner kan findes som sådan i forskellige salte. Mange oxyanioner af elementer i lavere oxidationstilstand overholder oktetreglen, og dette kan bruges til at rationalisere de vedtagne formler. For eksempel har klor (V) to valenselektroner, så det kan rumme tre elektronpar fra bindinger med oxidioner. Opladningen på ionen er +5 - 3 × 2 = -1, og formlen er således ClO-
3. Strukturen af ionen forudsiges af VSEPR- teorien at være pyramideformet med tre bindende elektronpar og et ensomt par. På lignende måde har oxyanionen af chlor (III) formlen ClO-
2og er bøjet med to ensomme par og to bindingspar.
| Oxidationstilstand | Navn | Formel | Billede |
|---|---|---|---|
| +1 | Den hypochlorit ion | ClO - |

|
| +3 | Den chlorit -ion |
ClO- 2 |

|
| +5 | Den chlorat ion |
ClO- 3 |

|
| +7 | Den perchlorat ion |
ClO- 4 |

|
I den tredje og efterfølgende række i det periodiske system er 6-koordinering mulig, men isolerede oktaedriske oxyanioner kendes ikke, fordi de ville have for høj elektrisk ladning. Molybdæn (VI) danner således ikke MoO6-
6, men danner den tetraedriske molybdatanion , MoO2-
4. MoO 6- enheder findes i kondenserede molybdatater. Fuldt protonerede oxyanioner med en oktaedrisk struktur findes i sådanne arter som Sn (OH)2-
6og Sb (OH)-
6. Derudover kan ortoperiodat kun delvist protoneres med H
3IO2-
6|| ⇌ || H
2IO3-
6|| + H + , der har p K en = 11,60.
Navngivning
Navngivningen af monomere oxyanioner følger følgende regler.
- Hvis det centrale atom ikke er i gruppe VII eller VIII
| Centralt atomoxidationsnummer | Navngivningsordning | Eksempler |
|---|---|---|
| = Gruppe nummer | * -ate |
Borate ( BO3− 3), Carbonat ( CO2− 3), Nitrat ( NO- 3), Fosfat ( PO3− 4), Sulfat ( SO2- 4), Chromate ( CrO2- 4), Arsenat ( ASO3− 4), Ferrate ( FeO2- 4) |
| = Gruppe nummer - 2 | * -ite |
Nitrit ( NO- 2), Phosphit ( PO3− 3), Sulfit ( SO2− 3), Arsenite ( AsO3− 3) |
| = Gruppe nummer - 4 | hypo - * - ite |
Hypophosphit ( PO3− 2), Hyposulfit ( SO2− 2) |
- Hvis det centrale atom er i gruppe VII eller VIII
| Centralt atomoxidationsnummer | Navngivningsordning | Eksempler |
|---|---|---|
| = Gruppe nummer | per - * - spiste |
Perchlorat ( ClO- 4), Perbromat ( BrO- 4), Periodate ( IO- 4), Permanganat ( MnO- 4), Perxenat ( XeO4- 6) |
| = Gruppe nummer - 2 | * -ate |
Chlorat ( ClO- 3), Bromate ( BrO- 3), Iodate ( IO- 3) |
| = Gruppe nummer - 4 | * -ite |
Chlorit ( ClO- 2), Bromit ( BrO- 2) |
| = Gruppe nummer - 6 | hypo - * - ite | Hypochlorit (ClO - ), Hypobromit (BrO - ) |
Kondensreaktioner
I vandig opløsning kan oxyanioner med høj ladning gennemgå kondensationsreaktioner, såsom ved dannelsen af dichromationen , Cr
2O2−
7:
- 2 CrO2-
4+ 2 H + ⇌ Cr
2O2−
7+ H 2 O
Drivkraften for denne reaktion er reduktionen af elektrisk ladningstæthed på anionen og eliminering af H + ionen . Mængden af rækkefølge i opløsningen mindskes og frigiver en vis mængde entropi, som gør Gibbs fri energi mere negativ og favoriserer den fremadrettede reaktion. Det er et eksempel på en syrebasereaktion med den monomere oxyanion, der fungerer som en base, og den kondenserede oxyanion fungerer som dens konjugatsyre . Den omvendte reaktion er en hydrolysereaktion , da et vandmolekyle , der fungerer som en base, er delt. Yderligere kondens kan forekomme, især med anioner med højere ladning, som det forekommer med adenosinphosphater.

|
|
|
| AMP | ADP | ATP |
Omdannelsen af ATP til ADP er en hydrolysereaktion og er en vigtig energikilde i biologiske systemer.
Dannelsen af de fleste silikatmineraler kan ses som et resultat af en de-kondensationsreaktion, hvor silica reagerer med et basisk oxid, en syre-base-reaktion i Lux-Flood- forstand.
- CaO (base) + SiO 2 (syre) → Casio 3
Strukturer og formler af polyoxyanioner
En polyoxyanion er en polymer oxyanion, hvor flere oxyanionmonomerer, sædvanligvis betragtes som MO n polyhedre, er forbundet ved at dele hjørner eller kanter. Når to hjørner af en polyhedron deles, kan den resulterende struktur være en kæde eller en ring. Korte kæder forekommer for eksempel i polyfosfater . Inosilicates, såsom pyroxener , har en lang kæde af SiO 4 tetraeder hver deling to hjørner. Samme struktur forekommer i såkaldte meta-vanadater, såsom ammoniummetavanadat , NH 4 VO 3 .
Formlen for oxyanion SiO2−
3opnås som følger: hver nominel siliciumion (Si 4+ ) er bundet til to nominelle oxidioner (O 2− ) og har en halv andel i to andre. Således er støkiometri og ladning givet ved:
- Støkiometri: Si + 2 + (2 × 1 ⁄ 2 ) O = SiO 3
- Charge: 4 + (2 x -2) + (2 × ( 1 / 2 × -2)) = -2.
En ring kan ses som en kæde, hvor de to ender er blevet samlet. Cyklisk triphosphat , P
3O3−
9 er et eksempel.
Når tre hjørner deles, strækker strukturen sig i to dimensioner. I amfiboler (hvoraf asbest er et eksempel) er to kæder forbundet sammen ved at dele et tredje hjørne på alternative steder langs kæden. Dette resulterer i en ideel formel Si
4O6−
11og en lineær kædestruktur, der forklarer fibrøs natur af disse mineraler. Deling af alle tre hjørner kan resultere i en arkstruktur, som i glimmer , Si
2O2−
5, hvor hvert silicium har et ilt til sig selv og en halv andel i tre andre. Krystallinsk glimmer kan spaltes i meget tynde ark.
Deling af alle fire hjørner af tetraederne resulterer i en 3-dimensionel struktur, såsom i kvarts . Aluminosilicater er mineraler, hvor noget silicium erstattes af aluminium. Imidlertid er oxidationstilstanden af aluminium en mindre end silicium, så udskiftningen skal ledsages af tilføjelsen af en anden kation. Antallet af mulige kombinationer af en sådan struktur er meget stort, hvilket delvis er grunden til, at der er så mange aluminosilikater.
Octahedral MO 6 enheder er almindelige i oxyanioner af større overgangsmetaller. Nogle forbindelser, såsom salte af den kæde-polymere ion, Mo
2O2−
7indeholder endda både tetraedriske og oktaedriske enheder. Kantdeling er almindelig i ioner, der indeholder oktaedriske byggesten, og oktaederne forvrænges normalt for at reducere belastningen ved de brodannende iltatomer. Dette resulterer i 3-dimensionelle strukturer kaldet polyoxometalater . Typiske eksempler forekommer i Keggin-strukturen af phosphomolybdat- ionen. Kantdeling er et effektivt middel til at reducere elektrisk ladningstæthed, som det kan ses med den hypotetiske kondensationsreaktion, der involverer to oktaeder:
- 2 MOn -
6+ 4 H + → Mo
2O( n −4) -
10+ 2 H20
Her reduceres den gennemsnitlige ladning på hvert M-atom med 2. Effektiviteten ved kantdeling demonstreres ved følgende reaktion, der opstår, når en alkalisk vandig opløsning af molybdat syrnes.
- 7 MoO2-
4+ 8 H + ⇌ Mo
7O6-
24+4 H 2 O
Den tetraedriske molybdation omdannes til en klynge af 7 kantbundne oktaeder, der giver en gennemsnitlig ladning på hvert molybdæn på 6 ⁄ 7 . Heptamolybdat-klyngen er så stabil, at klynger med mellem 2 og 6 molybdatenheder ikke er blevet detekteret, selvom de skal dannes som mellemprodukter.
Heuristisk for surhedsgrad
PKa for de relaterede syrer kan gættes fra antallet af dobbeltbindinger til ilt. Således er perchlorsyre en meget stærk syre, mens hypochlorsyre er meget svag. En simpel regel fungerer normalt inden for ca. 1 pH-enhed.
Syre-base egenskaber
De fleste oxyanioner er svage baser og kan protoneres for at give syrer eller syresalte. F.eks. Kan phosphationen successivt protoneres til dannelse af phosphorsyre.
-
PO3−
4+ H + ⇌ HPO2-
4 -
HPO2-
4+ H + ⇌ H
2PO-
4 -
H
2PO-
4+ H + ⇌ H 3 PO 4
Omfanget af protonering i vandig opløsning vil afhænge af syredissociationskonstanterne og pH . For eksempel har AMP (adenosinmonophosphat) ap K en værdi på 6,21, så ved pH 7 vil den være ca. 10% protoneret. Ladningsneutralisering er en vigtig faktor i disse protoneringsreaktioner. I modsætning hertil er de univalente anioner perchlorat og permanganationer meget vanskelige at protonere, og de tilsvarende syrer er derfor stærke syrer .
Selvom syrer, såsom phosphorsyre skrives som H 3 PO 4 , er protonerne bundet til oxygenatomer danner hydroxylgrupper, så formlen også kan skrives som OP (OH) 3 for bedre at afspejle strukturen. Svovlsyre kan skrives som O 2 S (OH) 2 ; dette er molekylet observeret i gasfasen.
Den phosphit ion, PO3−
3, er en stærk base , og bærer derfor altid mindst en proton. I dette tilfælde er protonen fæstnet direkte til phosphoratomet med strukturen HPO2−
3. Ved dannelse af denne ion opfører phosphitionen sig som en Lewis-base og donerer et par elektroner til Lewis-syren, H + .
Som nævnt ovenfor er en kondensationsreaktion også en syrebasereaktion. I mange systemer kan der forekomme både protonerings- og kondensationsreaktioner. Tilfældet med chromation giver et relativt simpelt eksempel. I overvejelsesdiagrammet for kromat, vist til højre, står pCr for den negative logaritme af kromkoncentrationen, og pH står for den negative logaritme af H + ionkoncentrationen. Der er to uafhængige ligevægte. Ligevægtskonstanter er defineret som følger.
CrO2-
4+ H + ⇌ HCrO-
4log K 1 = 5,89 2 HCrO-
4⇌ Cr
2O2−
7+ H 2 Olog K 2 = 2,05
Overvejelsesdiagrammet fortolkes som følger.
- Kromationen , CrO2-
4er den dominerende art ved høj pH. Efterhånden som pH stiger, bliver kromationen stadig mere dominerende, indtil den er den eneste art i opløsninger med pH> 6,75. - Ved pH <p K 1 brint chromation, HCrO-
4 er fremherskende i fortyndet opløsning. - Dichromationen, Cr
2O2−
7, er fremherskende i mere koncentrerede opløsninger, undtagen ved høj pH.
Arten H 2 Cro 4 og HCR
2O-
7 er ikke vist, da de kun dannes ved meget lav pH.
Overvejelsesdiagrammer kan blive meget komplicerede, når mange polymere arter kan dannes, såsom i vanadater , molybdatater og wolframater . En anden komplikation er, at mange af de højere polymerer dannes ekstremt langsomt, således at ligevægt muligvis ikke opnås selv i måneder, hvilket fører til mulige fejl i ligevægtskonstanterne og overvejelsesdiagrammet.







![{\ displaystyle K_ {1} = {\ frac {[\ mathrm {HCrO_ {4} ^ {-}}]} {[\ mathrm {CrO_ {4} ^ {2-}}] [\ mathrm {H ^ { +}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)
![K_ {2} = {\ frac {[{\ mathrm {Cr_ {2} O_ {7} ^ {{2 -}}}}}} {[{\ mathrm {HCrO_ {4} ^ {-}}}] ^ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)