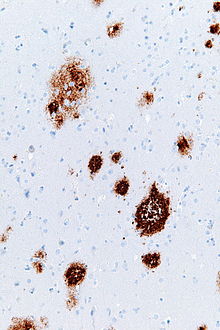
Amyloid plaketter - Amyloid plaques
Amyloide plaques (også kendt som neuritiske plaques , Aβ plaques eller senile plaques ) er ekstracellulære aflejringer af amyloid beta (Aβ) proteinet hovedsageligt i den grå substans i hjernen. Degenerative neuronale elementer og en overflod af mikroglia og astrocytter kan være forbundet med amyloide plaques. Nogle plaque forekommer i hjernen som følge af ældning (ældning), men et stort antal plaketter og neurofibrillære sammenfiltringer er karakteristiske træk ved Alzheimers sygdom . Unormale neuritter i amyloide plaques er snoede, ofte hævede axoner og dendritter . Neuritterne indeholder en række forskellige organeller og celleaffald, og mange af dem inkluderer karakteristiske parrede spiralformede filamenter , den ultrastrukturelle komponent i neurofibrillære tangles. Pladerne er meget variable i form og størrelse; i vævsafsnit, der er immunfarvet for Aβ, omfatter de en log-normal størrelsesfordelingskurve med et gennemsnitligt plakområde på 400-450 kvadrat mikrometer (µm²). De mindste plaketter (mindre end 200 µm²), som ofte består af diffuse aflejringer af Aβ, er særlig talrige. Pladernes tilsyneladende størrelse påvirkes af typen af pletter, der bruges til at detektere dem, og af det plan, hvorigennem de skæres til analyse under mikroskopet. Plakker dannes, når Aβ folder sig sammen og aggregerer til oligomerer og længere polymerer , hvis sidstnævnte er karakteristisk for amyloid . Misfoldet og aggregeret Aβ menes at være neurotoksisk , især i dets oligomere tilstand.
Historie
I 1892 beskrev Paul Blocq og Gheorghe Marinescu først tilstedeværelsen af plaketter i gråt stof. De omtalte plaketterne som 'knuder af neuroglial sklerose'. I 1898 rapporterede Emil Redlich plak hos tre patienter, hvoraf to havde klinisk verificeret demens . Redlich brugte udtrykket 'miliersklerose' til at beskrive plak, fordi han mente, at de lignede hirsefrø, og han var den første, der omtalte læsionerne som 'plaques'. I begyndelsen af det 20. århundrede noterede Oskar Fischer deres lighed med actinomyces 'Drusen' (geode-lignende læsioner), hvilket fik ham til at kalde den degenerative proces 'drusige Nekrose'. Alois Alzheimer krediteres ofte for først at knytte plaketter til demens i en præsentation fra 1906 (udgivet i 1907), men denne korte rapport fokuserede hovedsageligt på neurofibrillære tangles, og plaques blev kun kort nævnt. Alzheimers første indholdsmæssige beskrivelse af plaques dukkede op i 1911. I modsætning hertil offentliggjorde Oskar Fischer en række omfattende undersøgelser af plaketter og demens i 1907, 1910 og 1912. I 1911 foreslog Max Bielschowsky plaque-aflejringer amyloid-karakter. Dette blev senere bekræftet af Paul Divry, der viste, at plaketter, der er bejdset med farvestoffet Congo Red, viser den optiske egenskab ved dobbeltbrydning , som er karakteristisk for amyloider generelt. I 1911 introducerede Teofil Simchowicz udtrykket 'senile plaques' for at betegne deres hyppige tilstedeværelse i ældre individer. I 1968 bekræftede en kvantitativ analyse af Gary Blessed, Bernard Tomlinson og Martin Roth sammenhængen mellem senile plaketter med demens . Henryk Wisniewski og Robert Terry opfandt udtrykket 'neuritiske plaques' i 1973 for at betegne plaketter, der omfatter unormale neuronale processer (neuritter). Et vigtigt fremskridt i 1984 og 1985 var identifikationen af Aβ som proteinet, der danner plader. Denne opdagelse førte til generering af nye værktøjer til undersøgelse af plak, især antistoffer mod Aβ, og præsenterede et molekylært mål for udviklingen af potentielle terapier mod Alzheimers sygdom. Kendskab til aminosyresekvensen for Aβ gjorde det også muligt for forskere at opdage genetiske mutationer, der forårsager autosomalt dominerende Alzheimers sygdom, som alle øger sandsynligheden for, at Aβ vil aggregeres i hjernen.
Generationen af amyloid beta
Amyloid beta (Aβ) er et lille protein, oftest 40 eller 42 aminosyrer i længden, der frigives fra et længere moderprotein kaldet Aβ-precursor protein (APP). APP produceres af mange celletyper i kroppen, men det er især rigeligt i neuroner . Det er et single-pass transmembranprotein , det vil sige, det passerer en gang gennem cellemembraner . Aβ -segmentet af APP er dels inden for membranen og dels uden for membranen. For at frigøre Aβ spaltes APP sekventielt af to enzymer : for det første af beta-sekretase (eller β-amyloid-spaltende enzym (BACE)) uden for membranen og for det andet af gamma-sekretase (γ-sekretase), et enzymkompleks inden i membranen . De sekventielle virkninger af disse sekretaser resulterer i Aβ -proteinfragmenter, der frigives til det ekstracellulære rum Udladningen af Aβ øges af synapsenes aktivitet . Ud over Aβ -peptider, der er 40 eller 42 aminosyrer lange, genereres der også flere mindre rigelige Aβ -fragmenter. Aβ kan modificeres kemisk på forskellige måder, og proteinets længde og kemiske modifikationer kan påvirke både dets tendens til at aggregeres og dets toksicitet.
Identifikation

Amyloidplakker er synlige med lysmikroskopet ved hjælp af en række farvningsteknikker, herunder sølvpletter , Congorød , Thioflavin , cresylviolet , PAS-reaktion og luminescerende konjugerede oligothiophener (LCO'er). Disse metoder pletter ofte forskellige komponenter i plaques, og de varierer i deres følsomhed Plaques kan også visualiseres immunhistokemisk med antistoffer rettet mod Aβ eller andre komponenter i læsionerne. Immunhistokemiske pletter er især nyttige, fordi de både er følsomme og specifikke for antigener, der er forbundet med plak.
Sammensætning
Aβ -aflejringer, der omfatter amyloidplakker, er varierende i størrelse og udseende. Under lysmikroskopet spænder de fra små, sprøde akkumuleringer, der er et par mikrometer i diameter til meget større tætte eller diffuse masser. Såkaldte 'klassiske plaques' består af en kompakt Aβ-amyloidkerne, der er omgivet af en corona af noget mindre tæt pakket Aβ. Klassiske plaketter inkluderer også unormale, hævede neuronale processer ( neuritter ), der stammer fra mange forskellige typer neuroner, sammen med aktiverede astrocytter og mikroglia . Unormale neuritter og aktiverede glialceller er ikke typiske for de fleste diffuse plaques, og det er blevet foreslået, at diffuse aflejringer er et tidligt stadium i udviklingen af plak.
Anatomisk fordeling
Dietmar Thal og hans kolleger har foreslået en sekvens af stadier af plakdannelse i hjernen hos Alzheimer -patienter I fase 1 vises plaques i neocortex ; i fase 2 vises de i allocortex , hippocampusformation og amygdala ; i fase 3 påvirkes de basale ganglier og diencephalon ; i fase 4 vises plaques i midthjernen og medulla oblongata ; og i fase 5 vises de i pons og lillehjerne . I slutstadiet af Alzheimers sygdom kan der således findes plaques i de fleste dele af hjernen. De er ualmindelige i rygmarven .
Dannelse og spredning
Den normale funktion af Aβ er ikke sikker, men plaques opstår, når proteinet folder sig forkert og begynder at akkumulere i hjernen ved en proces med molekylær templating ('seedning'). Mathias Jucker og Lary Walker har sammenlignet denne proces med dannelse og spredning af prioner i sygdomme kendt som spongiform encephalopathies eller prionsygdomme . Ifølge prionparadigmet fejlfelter visse proteiner sig til former, der er rige på beta-ark sekundær struktur . I denne tilstand får de andre proteiner af samme type til at adoptere den samme unormale beta-arkrige struktur. De fejlfoldede proteiner klæber til hinanden og stabler til sidst sammen for at danne oligomerer, der smelter sammen for at danne amyloidfibriller, der er typiske for modne plakker.
Involvering i sygdom
Rigelige Aβ -plaques sammen med neurofibrillære sammenfiltringer bestående af aggregeret tau -protein er de to læsioner, der er nødvendige for den neuropatologiske diagnose af Alzheimers sygdom. Selvom antallet af neurofibrillære sammenfiltringer korrelerer stærkere med graden af demens end antallet af plaques, indikerer genetiske og patologiske fund, at Aβ spiller en central rolle i risikoen, begyndelsen og progressionen af Alzheimers sygdom. Af særlig betydning er de længere (42 aminosyrer) arter af Aβ kendt som Aβ42. Forhøjede niveauer af Aβ samt en stigning i forholdet mellem Aβ42 og 40-aminosyreformen (Aβ40) er vigtige tidlige begivenheder i patogenesen af Alzheimers sygdom.
Indtil for nylig krævede diagnosen Alzheimers sygdom en mikroskopisk analyse af plaketter og sammenfiltringer i hjernevæv, normalt ved obduktion. Imidlertid kan Aβ-plaques (sammen med cerebral Aβ-amyloid angiopati ) nu påvises i hjernen hos levende emner. Dette gøres ved at forberede radiomærkede midler, der selektivt binder til Aβ -aflejringer i hjernen efter at have været infunderet i blodbanen. De ligander krydse blod-hjerne-barrieren og tillægger aggregeret Ap, og deres retention i hjernen bedømmes ved positronemissionstomografi (PET). Derudover kan tilstedeværelsen af plaques og tangles estimeres ved at måle mængderne af Aβ- og tau -proteiner i cerebrospinalvæsken .
Hændelse
Sandsynligheden for at have plak i hjernen øges med stigende alder. Fra en alder af 60 år (10%) til en alder af 80 år (60%) stiger andelen af mennesker med senile plaketter lineært. Kvinder er lidt mere tilbøjelige til at have plak end mænd. Både plaketter og Alzheimers sygdom er også mere almindelige hos ældre med trisomi -21 ( Downs syndrom ). Dette menes at skyldes den overskydende produktion af Aβ, fordi APP -genet er på kromosom 21, som findes som tre kopier i Downs syndrom.
Amyloidplader forekommer naturligt i ældningshjernen hos ikke -menneskelige arter lige fra fugle til store aber. I ikke -menneskelige primater, som er de nærmeste biologiske slægtninge til mennesker, er der fundet plaketter i alle arter undersøgt indtil nu. Neurofibrillære sammenfiltringer er imidlertid sjældne, og ingen ikke -menneskelige arter har vist sig at have demens sammen med den komplette neuropatologi af Alzheimers sygdom.
Forskning
Forskning har været rettet mod at forstå plaques biokemiske , cytologiske og inflammatoriske egenskaber, bestemme, hvordan plaques opstår og formere sig i hjernen, identificere genetiske og miljømæssige risikofaktorer, opdage metoder til at opdage dem i den levende hjerne og udvikle terapeutiske strategier til forebyggelse eller fjerne dem. Forskning om dannelse og spredning af amyloidplakker er blevet fremskyndet af udviklingen af genetisk modificerede musemodeller. På trods af nogle begrænsninger har disse modeller også bidraget til opdagelsen af nye terapeutiske strategier. For eksempel er et voksende udvalg af behandlinger, der reducerer Aβ -niveauer og antallet af plak i hjernen, blevet identificeret ved hjælp af transgene gnavermodeller. Disse strategier omfatter immunterapeutiske fremgangsmåder og inhibitorer af de sekretaser, der frigiver Aβ fra APP. Sådanne behandlinger evalueres nu klinisk til behandling af Alzheimers sygdom. Resultaterne hidtil tyder på, at fjernelse af plak hos patienter med demens er til gavn, muligvis fordi hjernen er alvorligt beskadiget, da tegn og symptomer på Alzheimers sygdom først dukker op. Mikroglia-medieret plakdannelse kan i virkeligheden være gavnlig ved indkapsling af Aβ i tætte plakkerner. Af denne grund mener mange forskere, at tidligere hæmning af Aβ -aggregering og plakdannelse er nødvendig for at bremse eller forhindre tauopati og demens ved Alzheimers sygdom. Anden forskning er rettet mod at forstå den betændelse, der ofte er forbundet med plaketter eller identificere miljømæssige, fysiologiske og genetiske risikofaktorer for plakdannelse og Alzheimers sygdom.
Se også
Referencer
- ^ a b Cras P; Kawai M; Lowery D; Gonzalez-DeWhitt P; Greenberg B; Perry G (september 1991). "Senilplakneuritter ved Alzheimers sygdom akkumulerer amyloidprækursorprotein" . Procedurer fra National Academy of Sciences i Amerikas Forenede Stater . 88 (17): 7552–6. Bibcode : 1991PNAS ... 88.7552C . doi : 10.1073/pnas.88.17.7552 . PMC 52339 . PMID 1652752 .
- ^ Purves, Dale; Augustine, George J .; Fitzpatrick, David; Hall, William C .; LaManita, Anthony-Samuel; White, Leonard E .; Mooney, Richard D .; Platt, Michael L. (2012). Neurovidenskab (5. udgave). Sunderland, MA: Sinauer Associates. s. s. 713. ISBN 978-0-87893-695-3.
- ^ a b c d Dickson DW (1997). "Patogenesen af senile plaques" . J Neuropathol Exp Neurol . 56 (4): 321–339. doi : 10.1097/00005072-199704000-00001 . PMID 9100663 .
- ^ a b c d e f g h i j k l m n o Walker LC (2020). "Aβ -plaques" . Gratis neuropatologi . 1 (31): 31. doi : 10.17879/freeneuropathology-2020-3025 . PMC 7745791 . PMID 33345256 .
- ^ Ballard, C; Gauthier, S; Corbett, A; Brayne, C; Aarsland, D; Jones, E (19. marts 2011). "Alzheimers sygdom". Lancet . 377 (9770): 1019–31. doi : 10.1016/S0140-6736 (10) 61349-9 . PMID 21371747 . S2CID 20893019 .
- ^ Hyman BT; West HL; Rebeck GW; Buldyrev SV; Mantegna RN; Ukleja M; Havlin S; Stanley HE (1995). "Kvantitativ analyse af senile plaques ved Alzheimers sygdom: observation af log-normal størrelsesfordeling og molekylær epidemiologi af forskelle forbundet med apolipoprotein E genotype og trisomi 21 (Downs syndrom)" . Procedurer fra National Academy of Sciences i Amerikas Forenede Stater . 92 (8): 3586–3590. Bibcode : 1995PNAS ... 92.3586H . doi : 10.1073/pnas.92.8.3586 . PMC 42212 . PMID 7724603 .
- ^ a b c Röhr D, Boon BD, et al. (December 2020). "Mærkatfri vibrationsbilleddannelse af forskellige Aβ-plaktyper ved Alzheimers sygdom afslører sekventielle begivenheder i plakudvikling" . Acta Neuropathologica Communications . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Haass C; Selkoe DJ (2007). "Opløselige proteinoligomerer i neurodegeneration: lektioner fra Alzheimers amyloid beta-peptid". Nat Rev Mol Cell Biol . 8 (2): 101–112. doi : 10.1038/nrm2101 . PMID 17245412 . S2CID 32991755 .
- ^ Blocq, Paul; Marinesco, Georges (1892). Sur les lesions et la pathogenie de l'epilepsie dite essentielle . s. 445–6. OCLC 492619936 .
- ^ Buda O; Arsene D; Ceausu M; Dermengiu D; Curca GC (januar 2009). "Georges Marinesco og den tidlige forskning inden for neuropatologi". Neurologi . 72 (1): 88–91. doi : 10.1212/01.wnl.0000338626.93425.74 . PMID 19122036 . S2CID 45428057 .
- ^ Redlich E (1898). "Ueber miliare Sklerose der Hirnrinde bei seniler Atrophie". Jahrbücher für Psychiatrie und Neurologie . 17 : 208–216.
- ^ a b c Goedert M (2009). "Oskar Fischer og studiet af demens" . Hjerne . 132 (4): 1102–1111. doi : 10.1093/brain/awn256 . PMC 2668940 . PMID 18952676 .
- ^ Alzheimer, A (1907). "Uber einen eigenartige Erkranung der Hirnrinde". Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin . 64 : 146–8.
- ^ Divry P (1927). "Etude histo-chimique des plaques séniles". Journal Belge de Neurologie et de Psychiatrie . 9 : 643–657.
- ^ Buxbaum JN; Linke RP (2012). "Amyloidosernes molekylære historie". Journal of Molecular Biology . 421 (2–3): 142–159. doi : 10.1016/j.jmb.2012.01.024 . PMID 22321796 .
- ^ Simchowicz T .: Histologische Studien über die senile Demenz. i: Nissl F., Alzheimer A. (Hrsg.): Histologische und histopathologische Arbeiten über die Grosshirnrinde mit besonderer Berücksichtigung der pathologischen Anatomie der Geisteskrankheiten . Jena: G. Fischer, 1911, s. 267–444.
- ^ Ohry A; Buda O (2015). "Teofil Simchowicz (1879-1957): forskeren, der opfandt senile plaques i neuropatologi". Rumænsk journal for morfologi og embryologi . 56 (4): 1545–1548. PMID 26743308 .
- ^ Grzybowski A; Pieta A; Pugaczewska M (2017). "Teofil Simchowicz (1879-1957)" . Journal of Neurology . 264 (8): 1831–1832. doi : 10.1007/s00415-017-8460-9 . PMC 5533842 . PMID 28315959 .
- ^ Salig G; Tomlinson BE; Roth M (1968). "Sammenhængen mellem kvantitative mål for demens og senil ændring i ældre emners cerebrale grå stof". British Journal of Psychiatry . 114 (512): 797–811. doi : 10.1192/bjp.114.512.797 . PMID 5662937 .
- ^ Wisniewski, Henryk M .; Terry, Robert D. (1973). "Kapitel 1: Ny undersøgelse af patogenesen af den senile plak". I Zimmerman, HM (red.). Fremskridt i neuropatologi, bind 2 . Grune og Stratton. s. 1–26. ISBN 978-0-808-90775-6.
- ^ Glenner GG; Wong CW (1984). "Alzheimers sygdom: første rapport om oprensning og karakterisering af et nyt cerebrovaskulært amyloidprotein". Biokemisk og biofysisk forskningskommunikation . 120 (3): 885–890. doi : 10.1016/s0006-291x (84) 80190-4 . PMID 6375662 .
- ^ Glenner GG; Wong CW (1984). "Alzheimers sygdom og Downs syndrom: deling af et unikt cerebrovaskulært amyloidfibrilprotein". Biokemisk og biofysisk forskningskommunikation . 122 (3): 1131–1135. doi : 10.1016/0006-291x (84) 91209-9 . PMID 6236805 .
- ^ Mestre CL; Simms G; Weinman NA; Multhaup G; McDonald BL; Beyreuther K (1985). "Amyloid plaque -kerneprotein ved Alzheimers sygdom og Downs syndrom" . Procedurer fra National Academy of Sciences USA . 82 (12): 4245–4249. Bibcode : 1985PNAS ... 82.4245M . doi : 10.1073/pnas.82.12.4245 . PMC 397973 . PMID 3159021 .
- ^ a b c Walsh DM; Selkoe DJ (2020). "Amyloid beta-protein og videre: vejen frem i Alzheimers sygdom". Nuværende mening i neurobiologi . 61 : 116–124. doi : 10.1016/j.conb.2020.02.003 . PMID 32197217 . S2CID 214600892 .
- ^ a b c d e f Long JM; Holtzman DM (2019). "Alzheimers sygdom: En opdatering om patobiologi og behandlingsstrategier" . Celle . 179 (2): 312–339. doi : 10.1016/j.cell.2019.09.001 . PMC 6778042 . PMID 31564456 .
- ^ Walker LC (2015). "Proteopatiske stammer og neurodegenerative sygdommers heterogenitet" . Årlig gennemgang af genetik . 50 : 329–346. doi : 10.1146/annurev-genet-120215-034943 . PMC 6690197 . PMID 27893962 .
- ^ Selkoe, DJ (1999). "Kapitel 19: Biologi af β-amyloidprækursorprotein og mekanismen for Alzheimers sygdom". I Terry, RD; Katzman, R; Bick, KL; Sisodia, SS (red.). Alzheimers sygdom . Lippincott Williams og Wilkins. s. 293–310. ISBN 0-7817-1503-2.
- ^ a b c Haass C; Kaether C; Thinakaran G; Sisodia S (2012). "Handel og proteolytisk behandling af APP" . Cold Spring Harbor -perspektiver i medicin . 2 (5: a006270): a006270. doi : 10.1101/cshperspect.a006270 . PMC 3331683 . PMID 22553493 .
- ^ Suh YH; Checler F (september 2002). "Amyloid-prækursorprotein, preseniliner og alfa-synuclein: molekylær patogenese og farmakologiske anvendelser ved Alzheimers sygdom". Farmakologiske anmeldelser . 54 (3): 469–525. doi : 10.1124/pr.54.3.469 . PMID 12223532 . S2CID 86686003 .
- ^ Dunys J; Valverde A; Checler F (2018). "Er N- og C-terminalt afkortede Aβ-arter centrale patologiske udløsere i Alzheimers sygdom?" . Journal of Biological Chemistry . 293 (40): 15419–15428. doi : 10.1074/jbc.R118.003999 . PMC 6177599 . PMID 30143530 .
- ^ Kummer MP; Heneka MT (2014). "Afkortet og modificeret amyloid-beta-art" . Alzheimers forskning og terapi . 6 (3): 28. doi : 10.1186/alzrt258 . PMC 4055046 . PMID 25031638 .
- ^ Lamy C, Duyckaerts C, Delaere P, et al. (1989). "Sammenligning af syv farvningsmetoder for senile plaques og neurofibrillære sammenfiltringer i en potentiel serie på 15 ældre patienter". Neuropatologi og anvendt neurobiologi . 15 (6): 563–78. doi : 10.1111/j.1365-2990.1989.tb01255.x . PMID 2482455 . S2CID 25220224 .
- ^ Klingstedt T; Nilsson KPR (2012). "Luminescerende konjugerede poly- og oligo-thiophener: optiske ligander til spektral tildeling af en overflod af proteinaggregater". Biokemiske samfundstransaktioner . 40 (4): 704–710. doi : 10.1042/BST20120009 . PMID 22817720 .
- ^ Mavrogiorgou P; Gertz HJ; Ferszt R; Wolf R; Bär KJ; Juckel G (december 2011). "Er rutinemetoder gode nok til at plette senile plaketter og neurofibrillære sammenfiltringer i forskellige hjerneområder hos demente patienter?" (PDF) . Psykiatri Danubina . 23 (4): 334–9. PMID 22075733 . Arkiveret fra originalen (PDF) den 2017-08-11 . Hentet 2014-06-22 .
- ^ Braak H; Thal DR; Ghebremedhin E; Del Tredici K (2011). "Stadier af den patologiske proces ved Alzheimers sygdom: alderskategorier fra 1 til 100 år" . Journal of Neuropathology and Experimental Neurology . 70 (11): 960–969. doi : 10.1097/NEN.0b013e318232a379 . PMID 22002422 .
- ^ Thal DR; Rüb O; Orantes M; Braak H (2002). "Faser af Abeta-aflejring i den menneskelige hjerne og dens relevans for udviklingen af AD". Neurologi . 58 (12): 1791–1800. doi : 10.1212/wnl.58.12.1791 . PMID 12084879 . S2CID 41133337 .
- ^ Thal DR; Walter J; Saido TC; Fändrich M (2015). "Neuropatologi og biokemi af Aβ og dets aggregater i Alzheimers sygdom" . Acta Neuropathologica . 129 (2): 167–182. doi : 10.1007/s00401-014-1375-y . PMID 25534025 . S2CID 19701015 .
- ^ a b Jucker, M; Walker, LC (2013). "Selvudbredelse af patogene proteinaggregater i neurodegenerative sygdomme" . Natur . 501 (7465): 45–51. Bibcode : 2013Natur.501 ... 45J . doi : 10.1038/nature12481 . PMC 3963807 . PMID 24005412 .
- ^ Walker LC; Jucker M (2015). "Neurodegenerative sygdomme: Udvidelse af prion -konceptet" . Årlig gennemgang af neurovidenskab . 38 : 87–103. doi : 10.1146/annurev-neuro-071714-033828 . PMC 4803040 . PMID 25840008 .
- ^ Prusiner SB (1998). "Prioner" . Procedurer fra National Academy of Sciences USA . 95 (23): 13363–13383. Bibcode : 1998PNAS ... 9513363P . doi : 10.1073/pnas.95.23.13363 . PMC 33918 . PMID 9811807 .
- ^ Eisenberg D; Jucker M (2015). "Amyloid tilstand af proteiner i menneskelige sygdomme" . Celle . 148 (6): 1188–1203. doi : 10.1016/j.cell.2012.02.022 . PMC 3353745 . PMID 22424229 .
- ^ Nelson PT, Alafuzoff I, Bigio EH, et al. (2012). "Korrelation af Alzheimers sygdom neuropatologiske ændringer med kognitiv status: en gennemgang af litteraturen" . Journal of Neuropathology and Experimental Neurology . 71 (5): 362–381. doi : 10.1097/NEN.0b013e31825018f7 . PMC 3560290 . PMID 22487856 .
- ^ a b Findeis MA (november 2007). "Amyloid beta -peptid 42's rolle i Alzheimers sygdom". Farmakologi og terapi . 116 (2): 266–86. doi : 10.1016/j.pharmthera.2007.06.006 . PMID 17716740 .
- ^ Thal DR, Ronisz A, Tousseyn T, et al. (2019). "Forskellige aspekter af Alzheimers sygdomsrelaterede amyloide β-peptidpatologi og deres forhold til amyloid positronemissionstomografi og demens" . Acta Neuropathologica Communications . 7 (1): 178. doi : 10.1186/s40478-019-0837-9 . PMC 6854805 . PMID 31727169 .
- ^ Mathis CA; Lopresti BJ; Ikonomovic MD; Klunk WE (2017). "PET-sporstoffer med små molekyler til billeddannelse af proteinopatier" . Seminarer i nuklearmedicin . 47 (5): 553–575. doi : 10.1053/j.semnuclmed.2017.06.003 . PMC 5657567 . PMID 28826526 .
- ^ Ritchie C; Smailagic N; Noel-Storr AH; Ukoumunne O; Ladds EC; Martin S (2017). "CSF tau og CSF tau/ABeta -forholdet til diagnosticering af Alzheimers demens og andre demens hos mennesker med let kognitiv svækkelse (MCI)" . Cochrane Database over systematiske anmeldelser . 3 (3): CD010803. doi : 10.1002/14651858.CD010803.pub2 . PMC 6464349 . PMID 28328043 .
- ^ Hansson O; Lehmann S; Otto M; Zetterberg H; Lewczuk P (2019). "Fordele og ulemper ved brugen af CSF Amyloid beta (Abeta) 42/40 -forholdet ved diagnosen Alzheimers sygdom" . Alzheimers forskning og terapi . 11 (1): 34. doi : 10.1186/s13195-019-0485-0 . PMC 6477717 . PMID 31010420 .
- ^ a b Stam FC; Wigboldus JM; Smeulders AW (1986). "Aldersforekomst af senil hjerneamyloidose" (PDF) . Patologi - forskning og praksis . 181 (5): 558–562. doi : 10.1016/S0344-0338 (86) 80149-2 . PMID 3786248 .
- ^ Franke, M (1976). "Statistische Untersuchungen über die senilen Drusen im menschlichen Gehirn / Thesen" . Berlin, Tyskland: Neuropathologische Abteilung. Arkiveret fra originalen 2011-07-19.
- ^ a b Hoved E; Powell D; Guld BT; Schmitt FA (2012). "Alzheimers sygdom i Downs syndrom" . European Journal of Neurodegenerative Disease . 1 (3): 353–364. PMC 4184282 . PMID 25285303 .
- ^ Heuer E; Rosen RF; Cintron A; Walker LC (2012). "Ikke-menneskelige primatmodeller af Alzheimer-lignende cerebral proteopati" . Nuværende farmaceutisk design . 18 (8): 1159–1169. doi : 10.2174/138161212799315885 . PMC 3381739 . PMID 22288403 .
- ^ Walker LC; Jucker M (2017). "Menneskers usædvanlige sårbarhed over for Alzheimers sygdom" . Tendenser inden for molekylær medicin . 23 (6): 534–545. doi : 10.1016/j.molmed.2017.04.001 . PMC 5521004 . PMID 28483344 .
- ^ Jucker M (2010). "Fordelene og begrænsningerne ved dyremodeller til translationel forskning i neurodegenerative sygdomme". Naturmedicin . 16 (11): 1210–1214. doi : 10.1038/nm.2224 . PMID 21052075 . S2CID 30167302 .
- ^ Myers A; McGonigle P (2010). "Oversigt over transgene musemodeller for Alzheimers sygdom". Nuværende protokoller inden for neurovidenskab . 89 (1: e81): 1210–1214. doi : 10.1002/cpns.81 . PMID 31532917 . S2CID 202024310 .
- ^ Huang Y, Happonen KE (april 2021). "Microglia bruger TAM -receptorer til at detektere og opsluge amyloid β -plaques" . Naturimmunologi . 8 (1): 222. doi : 10.1186/s40478-020-01091-5 . PMC 7733282 . PMID 33308303 .
- ^ Heppner FL; Ransohoff RM; Becher B (2015). "Immunangreb: inflammationens rolle i Alzheimers sygdom". Naturanmeldelser Neurovidenskab . 16 (6): 358–372. doi : 10.1038/nrn3880 . PMID 25991443 . S2CID 6116253 .
- ^ De Strooper B; Karran E (2016). "Cellefasen af Alzheimers sygdom" . Celle . 164 (4): 603–615. doi : 10.1016/j.cell.2015.12.056 . PMID 26871627 .
- ^ Killin LOJ; Starr JM; Shiue IJ; Russ TC (2016). "Miljømæssige risikofaktorer for demens: en systematisk gennemgang" . BMC Geriatri . 16 (1): 175. doi : 10.1186/s12877-016-0342-y . PMC 5059894 . PMID 27729011 .
Yderligere læsning
- Jellinger KA (2005). "Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF) . Journal für Neurologie, Neurochirurgie und Psychiatrie . 6 (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV, et al. (Juli 1997). "Aggregering og opdeling af senile plaques ved Alzheimers sygdom" . Procedurer fra National Academy of Sciences i Amerikas Forenede Stater . 94 (14): 7612–6. Bibcode : 1997PNAS ... 94.7612C . doi : 10.1073/pnas.94.14.7612 . PMC 23870 . PMID 9207140 .