Staphylococcus aureus -Staphylococcus aureus
| Staphylococcus aureus | |
|---|---|
|
|
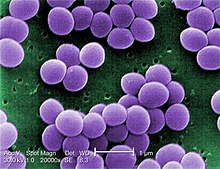
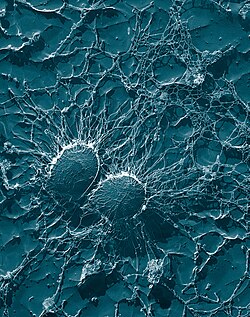
| Scanningselektronmikrograf af S. aureus ; falsk farve tilføjet | |
|
Videnskabelig klassificering |
|
| Domæne: | Bakterie |
| Phylum: | Firmicutes |
| Klasse: | Baciller |
| Bestille: | Bacillaler |
| Familie: | Staphylococcaceae |
| Slægt: | Staphylococcus |
| Arter: |
S. aureus
|
| Binomisk navn | |
|
Staphylococcus aureus
Rosenbach 1884
|
|
| Staphylococcus aureus | |
|---|---|
| Andre navne | Staph aureus , S. aureus |
| Specialitet | Smitsom sygdom |
| Typer | Methicillin-modtagelig Staphylococcus Aureus, Methicillin-resistent Staphylococcus aureus |
| Årsager | Staphylococcus aureus bakterier |
| Differential diagnose | andre bakterielle, virale og svampeinfektioner, |
| Forebyggelse | håndvask, rengøring af overflader |
| Medicin | Antibiotika |
| Frekvens | 20% til 30% af den menneskelige befolkning ofte uden symptomer |
Staphylococcus aureus er en gram-positiv rundformet bakterie , et medlem af Firmicutes , og er et normalt medlem afkroppens mikrobiota , der ofte findes i de øvre luftveje og på huden . Det er ofte positivt for katalase- og nitratreduktion og er en fakultativ anaerobe, der kan vokse uden behov for ilt. Selvom S. aureus normalt fungerer som en kommensal for den humane mikrobiota, kan den også blive et opportunistisk patogen , idet den er en almindelig årsag til hudinfektioner, herunder bylder , luftvejsinfektioner såsom bihulebetændelse og madforgiftning . Patogene stammer ofte fremme infektioner ved at producere virulensfaktorer såsom potente protein toksiner , og ekspressionen af et celleoverfladeprotein , som binder og inaktiverer antistoffer . Fremkomsten af antibiotikaresistente stammer af S. aureus såsom methicillinresistente S. aureus (MRSA) er et verdensomspændende problem inden for klinisk medicin . På trods af megen forskning og udvikling er der ikkegodkendtnogen vaccine mod S. aureus .
Anslået 20% til 30% af den menneskelige befolkning er langsigtede bærere af S. aureus, som kan findes som en del af den normale hudflora , i næseborene og som en normal beboer i den nedre reproduktive kanal hos kvinder. S. aureus kan forårsage en række sygdomme, lige fra mindre hudinfektioner, såsom bumser , impetigo , bylder , cellulitis , folliculitis , carbuncles , skoldet hudsyndrom og bylder til livstruende sygdomme såsom lungebetændelse , meningitis , osteomyelitis , endocarditis , toksisk shock syndrom , bakteriæmi og sepsis . Det er stadig en af de fem mest almindelige årsager til hospitalserhvervede infektioner og er ofte årsag til sårinfektioner efter operationen . Hvert år får omkring 500.000 patienter på hospitaler i USA en stafylokokinfektion, hovedsageligt af S. aureus . Op til 50.000 dødsfald hvert år i USA er forbundet med S. aureus -infektioner.
Historie
Opdagelse
I 1881 opdagede Alexander Ogston , en skotsk kirurg, at Staphylococcus kan forårsage sårinfektioner efter at have bemærket grupper af bakterier i pus fra en kirurgisk byld under en procedure, han udførte. Han kaldte den Staphylococcus efter dens klyngede udseende tydelig under et mikroskop. Derefter i 1884 identificerede den tyske forsker Friedrich Julius Rosenbach Staphylococcus aureus , diskriminerede og adskilte den fra Staphylococcus albus , en beslægtet bakterie. I begyndelsen af 1930'erne begyndte læger at bruge en mere strømlinet test til at påvise tilstedeværelsen af en S. aureus -infektion ved hjælp af koagulasetest , som muliggør påvisning af et enzym produceret af bakterien. Før 1940'erne var S. aureus -infektioner dødelige hos størstedelen af patienterne. Læger opdagede imidlertid, at brug af penicillin kunne helbrede S. aureus -infektioner. Desværre i slutningen af 1940'erne blev penicillinresistens udbredt blandt denne bakteriepopulation, og udbrud af den resistente stamme begyndte at forekomme.
Udvikling
Staphylococcus aureus kan sorteres i ti dominerende menneskelige slægter. Der er også talrige mindre slægter, men disse ses ikke så ofte i befolkningen. Genomer af bakterier inden for samme slægt er for det meste bevaret, med undtagelse af mobile genetiske elementer . Mobile genetiske elementer, der er almindelige i S. aureus, omfatter bakteriofager, patogenicitetsøer , plasmider , transposoner og stafylokokkassettekromosomer. Disse elementer har gjort det muligt for S. aureus at konstant udvikle sig og få nye træk. Der er en stor genetisk variation inden for S. aureus -arten . En undersøgelse af Fitzgerald et al. (2001) afslørede, at cirka 22% af S. aureus- genomet er ikke-kodende og dermed kan variere fra bakterie til bakterie. Et eksempel på denne forskel ses i artens virulens. Kun få stammer af S. aureus er forbundet med infektioner hos mennesker. Dette viser, at der er et stort udvalg af infektiøse evner inden for arten.
Det er blevet foreslået, at en mulig årsag til den store heterogenitet inden for arten kan skyldes dens afhængighed af heterogene infektioner. Dette sker, når flere forskellige typer af S. aureus forårsager en infektion i en vært. De forskellige stammer kan udskille forskellige enzymer eller bringe forskellige antibiotikaresistenser til gruppen, hvilket øger dets patogene evne. Der er således et behov for et stort antal mutationer og erhvervelser af mobile genetiske elementer.
En anden bemærkelsesværdig evolutionær proces inden for S. aureus- arten er dens co-evolution med dens menneskelige værter. Over tid har dette parasitære forhold ført til, at bakterien kan transporteres i nasopharynx hos mennesker uden at forårsage symptomer eller infektion. Dette gør det muligt at passere det i hele den menneskelige befolkning, hvilket øger dets egnethed som art. Imidlertid er kun ca. 50% af den menneskelige befolkning bærere af S. aureus , med 20% som kontinuerlige bærere og 30% som intermitterende. Dette får forskere til at tro, at der er mange faktorer, der afgør, om S. aureus bæres asymptomatisk hos mennesker, herunder faktorer, der er specifikke for en individuel person. Ifølge en undersøgelse fra Hofman et al. Fra 1995 kan disse faktorer omfatte alder, køn, diabetes og rygning. De bestemte også nogle genetiske variationer hos mennesker, der førte til en øget evne for S. aureus til at kolonisere, især en polymorfisme i glucocorticoid -receptorgenet, der resulterer i større produktion af kortikosteroider . Afslutningsvis er der tegn på, at enhver stamme af denne bakterie kan blive invasiv, da denne er stærkt afhængig af menneskelige faktorer.
Selvom S. aureus har hurtige reproduktive og mikro-evolutionære hastigheder, er der flere barrierer, der forhindrer evolution med arten. En sådan barriere er AGR, som er en global accessorisk genregulator inden for bakterierne. Denne sådan regulator er blevet knyttet til bakteriens virulensniveau. Tab af funktionsmutationer inden for dette gen har vist sig at øge egnetheden af den bakterie, der indeholder den. Således må S. aureus foretage en afvejning for at øge deres succes som art og udveksle reduceret virulens med øget lægemiddelresistens. En anden barriere for evolution er Sau1 Type I restriktionsmodifikationssystemet (RM). Dette system eksisterer for at beskytte bakterien mod fremmed DNA ved at fordøje det. Udveksling af DNA mellem den samme slægt er ikke blokeret, da de har de samme enzymer, og RM -systemet ikke genkender det nye DNA som fremmed, men overførsel mellem slægter er blokeret.
Mikrobiologi
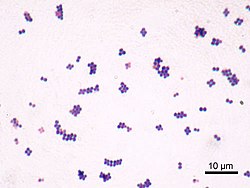
S. aureus ( / ˌ s t æ f ɪ l ə k ɒ k ə s ɔːr i ə s , - l oʊ - / , græsk σταφυλόκοκκος, "drue-klynge bær", latin aureus , "gyldne") er en fakultativ aerob , grampositiv coccal (rund) bakterie også kendt som "golden staph" og "oro staphira". S. aureus er ikke -motil og danner ikke sporer . I medicinsk litteratur omtales bakterien ofte som S. aureus , Staph aureus eller Staph a. . S. aureus fremstår som stafylokokker (druelignende klynger), når de ses gennem et mikroskop, og har store, runde, gylden-gule kolonier, ofte med hæmolyse , når de dyrkes på blodagarplader . S. aureus formerer sig aseksuelt ved binær fission . Fuldstændig adskillelse af dattercellerne medieres af S. aureus autolysin , og i dets fravær eller målrettet inhibering forbliver dattercellerne knyttet til hinanden og fremstår som klynger.
S. aureus er katalasepositiv (hvilket betyder at det kan producere enzymet katalase). Catalase omdanner hydrogenperoxid ( H
2O
2) til vand og ilt. Catalase-aktivitetstest bruges undertiden til at skelne stafylokokker fra enterokokker og streptokokker . Tidligere blev S. aureus differentieret fra andre stafylokokker ved koagulasetesten . Imidlertid er ikke alle S. aureus- stammer koagulasepositive, og forkert artsidentifikation kan påvirke effektive behandlings- og kontrolforanstaltninger.
Staphylococcus adskiller sig fra den tilsvarende navngivne og medicinsk relevante slægt Streptococcus .
Naturlig genetisk transformation er en reproduktiv proces, der involverer DNA -overførsel fra en bakterie til en anden gennem det mellemliggende medium og integration af donorsekvensen i modtagergenomet ved homolog rekombination . S. aureus viste sig at være i stand til naturlig genetisk transformation, men kun ved lav frekvens under de anvendte forsøgsbetingelser. Yderligere undersøgelser antydede, at udviklingen af kompetence til naturlig genetisk transformation kan være væsentligt højere under passende forhold, der endnu ikke er opdaget.
Rolle inden for sundhed
Hos mennesker kan S. aureus være til stede i de øvre luftveje, tarmslimhinde og hud som medlem af den normale mikrobiota . Fordi S. aureus kan forårsage sygdom under visse værts- og miljøforhold, karakteriseres det som en "patobiont".
Rolle i sygdom

Mens S. aureus normalt fungerer som en kommensal bakterie , der asymptomatisk koloniserer omkring 30% af den menneskelige befolkning, kan det nogle gange forårsage sygdom. Især S. aureus er en af de mest almindelige årsager til bakteriæmi og infektiøs endokarditis . Derudover kan det forårsage forskellige hud- og bløddelsinfektioner , især når hud- eller slimhindebarrierer er blevet overtrådt.
S. aureus- infektioner kan spredes ved kontakt med pus fra et inficeret sår, hud-til-hud-kontakt med en inficeret person og kontakt med genstande, der bruges af en inficeret person, såsom håndklæder, lagner, tøj eller atletisk udstyr. Ledproteser sætte en person i særlig risiko for septisk arthritis , stafylokokker endocarditis (infektion i hjerteklapperne), og lungebetændelse .
Forebyggende foranstaltninger omfatter at vaske hænder ofte med sæbe og sørge for at bade eller bade hver dag.
S. aureus er en væsentlig årsag til kroniske biofilminfektioner på medicinske implantater , og undertrykkelsen af toksiner er en del af infektionsvejen.
S. aureus kan ligge i dvale i kroppen i årevis uopdaget. Når symptomerne begynder at vise sig, er værten smitsom i yderligere to uger, og den generelle sygdom varer et par uger. Men hvis den ikke behandles, kan sygdommen være dødelig. Dybt gennemtrængende S. aureus -infektioner kan være alvorlige.
Hudinfektioner
Hudinfektioner er den mest almindelige form for S. aureus -infektion. Dette kan manifestere sig på forskellige måder, herunder små godartede bylder , folliculitis , impetigo , cellulitis og mere alvorlige, invasive bløddelsinfektioner.
S. aureus er ekstremt udbredt hos personer med atopisk dermatitis , mere almindeligt kendt som eksem. Det findes for det meste på frugtbare, aktive steder, herunder armhulerne, håret og hovedbunden. Store bumser, der forekommer i disse områder, kan forværre infektionen, hvis den er skåret. Dette kan føre til stafylokok skoldet hudsyndrom , hvis alvorlige form kan ses hos nyfødte .
Tilstedeværelsen af S. aureus hos personer med atopisk dermatitis er ikke en indikation til behandling med orale antibiotika, da beviser ikke har vist, at dette gavner patienten. Men topiske antibiotika kombineret med corticosteroider har vist sig at forbedre tilstanden. Kolonisering af S. aureus driver betændelse i atopisk dermatitis; S. aureus menes at udnytte defekter i hudbarrieren hos personer med atopisk dermatitis, hvilket udløser cytokinekspression og derfor forværrer symptomer.
Madforgiftning
S. aureus er også ansvarlig for madforgiftning . Det er i stand til at generere toksiner, der producerer madforgiftning i menneskekroppen. Inkubationstiden varer en til seks timer, og selve sygdommen varer fra 30 minutter til 3 dage. Forebyggende foranstaltninger, man kan tage for at forhindre spredning af sygdommen, omfatter at vaske hænder grundigt med sæbe og vand, inden mad tilberedes. Hold dig væk fra mad, hvis du er syg, og brug handsker, hvis der opstår åbne sår på hænder eller håndled, mens du tilbereder mad. Hvis mad opbevares i mere end 2 timer, skal maden holdes under 40 eller over 140 ° F (4,4 eller 60 ° C).
Knogle- og ledinfektioner
S. aureus er bakterien, der er almindeligt ansvarlig for alle større knogle- og ledinfektioner. Dette manifesterer sig i en af tre former: osteomyelitis , septisk arthritis og infektion fra en erstatnings ledoperation.
Bakteriæmi
S. aureus er en førende årsag til infektioner i blodbanen i store dele af den industrialiserede verden. Infektion er generelt forbundet med brud i huden eller slimhinderne på grund af kirurgi, skade eller brug af intravaskulære anordninger, såsom katetre , hæmodialysemaskiner eller injicerede lægemidler. Når bakterierne er kommet ind i blodbanen, kan de inficere forskellige organer og forårsage infektiøs endokarditis , septisk arthritis og osteomyelitis . Denne sygdom er særlig udbredt og alvorlig hos de helt unge og meget gamle.
Uden antibiotikabehandling har S. aureus bacteremia en dødsfaldsprocent på omkring 80%. Med antibiotikabehandling varierer dødeligheden af tilfælde fra 15% til 50% afhængigt af patientens alder og helbred samt antibiotikaresistensen af S. aureus -stammen.
Medicinske implantatinfektioner
S. aureus findes ofte i biofilm dannet på medicinsk udstyr implanteret i kroppen eller på menneskeligt væv. Det findes almindeligt med et andet patogen, Candida albicans , der danner multispecies biofilm. Sidstnævnte mistænkes for at hjælpe S. aureus med at trænge ind i menneskeligt væv. En højere dødelighed er forbundet med multispecies biofilm.
S. aureus biofilm er den overvejende årsag til ortopædiske implantatrelaterede infektioner, men findes også på hjerteimplantater, vaskulære transplantater , forskellige katetre og kosmetiske kirurgiske implantater. Efter implantation bliver overfladen af disse enheder belagt med værtsproteiner, som giver en rig overflade til bakteriel vedhæftning og dannelse af biofilm. Når enheden bliver inficeret, skal den fjernes fuldstændigt, da S. aureus biofilm ikke kan ødelægges ved antibiotikabehandlinger.
Nuværende terapi for S. aureus biofilm-medierede infektioner involverer kirurgisk fjernelse af den inficerede enhed efterfulgt af antibiotikabehandling. Konventionel antibiotikabehandling alene er ikke effektiv til at udrydde sådanne infektioner. Et alternativ til postkirurgisk antibiotikabehandling er anvendelse af antibiotisk fyldte, opløselige calciumsulfatperler, som er implanteret med det medicinske udstyr. Disse perler kan frigive høje doser antibiotika på det ønskede sted for at forhindre den første infektion.
Nye behandlinger for S. aureus biofilm, der involverer nanosølvpartikler, bakteriofager og plante-afledte antibiotika, undersøges. Disse midler har vist hæmmende virkninger mod S. aureus indlejret i biofilm. En klasse af enzymer har vist sig at have biofilm-matrix-nedbrydningsevne, og kan derfor bruges som biofilm-spredningsmidler i kombination med antibiotika.
Dyreinfektioner
S. aureus kan overleve på hunde, katte og heste og kan forårsage humlefod hos kyllinger. Nogle mener, at sundhedspersoners hunde bør betragtes som en betydelig kilde til antibiotikaresistent S. aureus , især i udbrudstider. I en undersøgelse fra 2008 af Boost, O'Donoghue og James fandt man ud af, at omkring 90% af S. aureus koloniserede i hundehunde, der blev præsenteret som resistente over for mindst et antibiotikum. Næseregionen er blevet impliceret som det vigtigste sted for overførsel mellem hunde og mennesker.
S. aureus er en af årsagssygdommene for mastitis hos malkekøer . Dens store polysaccharidkapsel beskytter organismen mod genkendelse af koens immunforsvar .
Virulensfaktorer
Enzymer
S. aureus producerer forskellige enzymer, såsom koagulase (bundne og frie koagulaser), der størkner plasma og dækker bakteriecellen, sandsynligvis for at forhindre fagocytose . Hyaluronidase (også kendt som spredningsfaktor) nedbryder hyaluronsyre og hjælper med at sprede det. Deoxyribonuklease , der nedbryder DNA'et, beskytter S. aureus mod neutrofile ekstracellulære fældemedierede drab. S. aureus producerer også lipase til fordøjelse af lipider, staphylokinase til opløsning af fibrin og hjælp til spredning, og beta-lactamase til lægemiddelresistens.
Toksiner
Afhængig af stammen er S. aureus i stand til at udskille flere eksotoksiner , som kan kategoriseres i tre grupper. Mange af disse toksiner er forbundet med specifikke sygdomme.
- Superantigener
- Antigener kendt som superantigener kan forårsage toksisk shock syndrom (TSS). Denne gruppe omfatter 25 stafylokok -enterotoksiner (SE'er), som er identificeret til dato og navngivet alfabetisk (SEA -SEZ), herunder enterotoksin type B samt toksisk shock syndrom toksin TSST -1, der forårsager TSS forbundet med brug af tamponer . Toksisk choksyndrom er karakteriseret ved feber , erytematøst udslæt , lavt blodtryk , chok , mangel på flere organer og hudskalning . Mangel på antistof mod TSST-1 spiller en rolle i patogenesen af TSS. Andre stammer af S. aureus kan producere et enterotoksin, der er forårsagende middel for en type gastroenteritis . Denne form for gastroenteritis er selvbegrænsende, kendetegnet ved opkastning og diarré 1-6 timer efter indtagelse af toksinet, med genopretning i 8 til 24 timer. Symptomer omfatter kvalme, opkastning, diarré og store mavesmerter.
- Eksfolierende toksiner
- Eksfolierende toksiner er eksotoksiner impliceret i sygdommen stafylokok skoldet hudsyndrom (SSSS), som forekommer hyppigst hos spædbørn og små børn. Det kan også forekomme som epidemier i hospitalsinstitutioner. Den protease aktivitet eksfoliative toksiner forårsager afskalning af den observerede med SSSS hud.
- Andre toksiner
- Staphylococcal toksiner, der virker på cellemembraner, omfatter alfatoksin , betatoksin , deltatoksin og flere tokomponenttoksiner. Stammer af S. aureus kan være vært for fager , såsom profagen Φ-PVL, der producerer Panton-Valentine leukocidin (PVL), for at øge virulens . Bikomponenttoksinet PVL er forbundet med alvorlig nekrotiserende lungebetændelse hos børn. Generne, der koder for komponenterne i PVL, kodes på en bakteriofag, der findes i community-associerede MRSA-stammer.
Lille RNA
Listen over små RNA'er, der er involveret i kontrollen af bakteriel virulens i S. aureus , vokser. Dette kan lettes af faktorer såsom øget biofilmdannelse i nærvær af øgede niveauer af så små RNA'er. For eksempel RNAIII , SPRD , SPRC, RsaE , SprA1, SSR42, ArtR, SprX , og Teg49 .
Strategier for post-transkriptionel regulering efter 3'-oversat region
Mange mRNA'er i S. aureus bærer tre primære utranslaterede regioner (3'UTR) længere end 100 nukleotider , som potentielt kan have en regulatorisk funktion.
Yderligere undersøgelse af i caR mRNA (mRNA, der koder for repressoren af den primære ekspolysaccharidforbindelse i bakteriefilmfilmmatrixen) viste, at 3'UTR -bindingen til 5'UTR'en kan forstyrre translationskomplekset og generere et dobbeltstrenget substrat til RNase III . Interaktionen er mellem UCCCCUG-motivet i 3'UTR og Shine-Dalagarno- regionen ved 5'UTR. Sletning af motivet resulterede i IcaR -repressorakkumulering og hæmning af biofilmudvikling. Biofilmdannelsen er hovedårsagen til Staphylococcus -implantatinfektioner.
Biofilm
Biofilm er grupper af mikroorganismer, såsom bakterier, der fæstner til hinanden og vokser på våde overflader. The S. aureus biofilm er indlejret i en glycocalyx slimlag og kan bestå af teichoic syrer, værtsproteiner, ekstracellulært DNA (eDNA) og polysaccharid intercellulære antigen (PIA). Ikke alle S. aureus biofilm indeholder PIA. S. aureus biofilm er vigtige i sygdomspatogenese, da de kan bidrage til antibiotikaresistens og undgåelse af immunsystemet. S. aureus biofilm har høj resistens over for antibiotikabehandlinger og vært immunrespons. En hypotese til at forklare dette er, at biofilmmatrixen beskytter de indlejrede celler ved at fungere som en barriere for at forhindre antibiotikapenetration. Biofilmmatrixen er imidlertid sammensat med mange vandkanaler, så denne hypotese bliver stadig mindre sandsynlig, men en biofilmmatrix indeholder muligvis antibiotisk nedbrydende enzymer som β-lactamaser, som kan forhindre antibiotikapenetration. En anden hypotese er, at betingelserne i biofilmmatrix favoriserer dannelsen af persisterceller , som er meget antibiotikaresistente, sovende bakterieceller. S. aureus biofilm har også høj resistens over for værtens immunrespons. Selvom den nøjagtige resistensmekanisme er ukendt, har S. aureus biofilm øget vækst under tilstedeværelse af cytokiner produceret af værtens immunrespons. Værtsantistoffer er mindre effektive for S. aureus biofilm på grund af den heterogene antigenfordeling , hvor et antigen kan være til stede i nogle områder af biofilmen, men helt fraværende fra andre områder.
Undersøgelser i biofilmudvikling har vist sig at være relateret til ændringer i genekspression. Der er specifikke gener, der viste sig at være afgørende i de forskellige biofilmvækststadier. To af disse gener inkluderer rocD og gudB, som koder for enzymets ornitin-oxosyretransaminase og glutamatdehydrogenase, som er vigtige for aminosyremetabolisme. Undersøgelser har vist, at biofilmudvikling er afhængig af aminosyrer glutamin og glutamat for korrekte metaboliske funktioner.
Andre immunoevasive strategier
- Protein A.
Protein A er forankret til stafylokok peptidoglycan pentaglycine broer (kæder af fem glycin rester) ved transpeptidase sortase A. Protein A, et IgG -bindende protein, binder til Fc-regionen af et antistof . Faktisk resulterede undersøgelser, der involverede mutation af gener, der koder for protein A, i en sænket virulens af S. aureus målt ved overlevelse i blod, hvilket har ført til spekulationer om, at protein A-bidraget virulens kræver binding af antistof Fc-regioner.
Protein A i forskellige rekombinante former er blevet brugt i årtier til at binde og rense en lang række antistoffer ved immunoaffinitetskromatografi . Transpeptidaser, såsom de sorteraser, der er ansvarlige for forankring af faktorer som protein A til stafylokokpeptidoglycan, undersøges i håb om at udvikle nye antibiotika til at målrette MRSA -infektioner.
- Staphylococcal pigmenter
Nogle stammer af S. aureus er i stand til at producere staphyloxanthin - en gylden-farvet carotenoid pigment . Dette pigment fungerer som en virulensfaktor , primært ved at være en bakteriel antioxidant, som hjælper mikroben med at undslippe de reaktive iltarter, som værtsimmunsystemet bruger til at dræbe patogener.
Mutantstammer af S. aureus modificeret til at mangle staphyloxanthin er mindre tilbøjelige til at overleve inkubation med et oxiderende kemikalie, såsom hydrogenperoxid , end pigmenterede stammer. Mutante kolonier bliver hurtigt dræbt, når de udsættes for menneskelige neutrofiler , mens mange af de pigmenterede kolonier overlever. Hos mus forårsager de pigmenterede stammer langvarige bylder, når de podes i sår, hvorimod sår inficeret med de upigmenterede stammer hurtigt heler.
Disse test tyder på, at Staphylococcus -stammerne anvender staphyloxanthin som et forsvar mod det normale humane immunsystem. Lægemidler designet til at hæmme produktionen af staphyloxanthin kan svække bakterien og forny dens modtagelighed over for antibiotika. På grund af ligheder i biosyntese af staphyloxanthin og humant kolesterol på grund af ligheder viste et lægemiddel, der blev udviklet i forbindelse med kolesterolsænkende terapi, at blokere S. aureus pigmentering og sygdomsprogression i en musinfektionsmodel .
Klassisk diagnose
Afhængigt af den tilstedeværende infektionstype opnås en passende prøve i overensstemmelse hermed og sendes til laboratoriet for endelig identifikation ved hjælp af biokemiske eller enzymbaserede tests. En Gram-plet udføres først for at guide vejen, som skal vise typiske grampositive bakterier, cocci, i klynger. For det andet dyrkes isolatet på mannitolsaltagar , som er et selektivt medium med 7,5% NaCl, der tillader S. aureus at vokse, hvilket producerer gulfarvede kolonier som følge af mannitolfermentering og efterfølgende fald i mediets pH .
Endvidere for differentiering på artsniveau, catalase (positiv for alle Staphylococcus -arter), coagulase ( fibrinkoageldannelse , positiv for S. aureus ), DNAse (clearancezone på DNase -agar), lipase (en gul farve og harsk lugtlugt ), og phosphatase (en lyserød farve) test er alle udført. Ved stafylokokforgiftning kan fagskrivning udføres for at afgøre, om stafylokokker, der blev genvundet fra maden, var infektionskilden.
Hurtig diagnose og indtastning
Nylige aktiviteter og mad, som en patient for nylig har spist, vil blive spurgt om af en læge, og der foretages en fysisk undersøgelse for at gennemgå eventuelle symptomer. Med mere alvorlige symptomer kan blodprøver og afføringskultur være i orden. Diagnostiske mikrobiologilaboratorier og referencelaboratorier er nøglen til at identificere udbrud og nye stammer af S. aureus . Nylige genetiske fremskridt har muliggjort pålidelige og hurtige teknikker til identifikation og karakterisering af kliniske isolater af S. aureus i realtid. Disse værktøjer understøtter infektionsbekæmpelsesstrategier for at begrænse bakteriel spredning og sikre korrekt brug af antibiotika. Kvantitativ PCR bruges i stigende grad til at identificere infektionsudbrud.
Når man observerer udviklingen af S. aureus og dets evne til at tilpasse sig hvert modificeret antibiotikum, anvendes to grundlæggende metoder kendt som "båndbaseret" eller "sekvensbaseret". Med disse to metoder i tankerne udføres andre metoder, f.eks. Multilokus sekvens-typning (MLST), pulserende feltgelelektroforese (PFGE), bakteriofag-typning , spa-locustyping og SCCmec-typning ofte mere end andre. Med disse metoder kan det bestemmes, hvor stammer af MRSA stammer fra, og også hvor de er i øjeblikket.
Med MLST bruger denne typeteknik fragmenter af flere husholdningsgener kendt som aroE, glpF, gmk, pta, tip og yqiL . Disse sekvenser tildeles derefter et nummer, der giver en streng med flere tal, der fungerer som den alleliske profil. Selvom dette er en almindelig metode, er en begrænsning ved denne metode vedligeholdelsen af mikroarrayet, som detekterer nyligt alleliske profiler, hvilket gør det til et dyrt og tidskrævende eksperiment.
Med PFGE er en metode, der stadig bruges meget tilbage til sin første succes i 1980'erne, stadig i stand til at hjælpe med at differentiere MRSA -isolater. For at opnå dette bruger teknikken flere gelelektroforese sammen med en spændingsgradient til at vise klare opløsninger af molekyler. De S. aureus fragmenter derefter overgang ned gelen, der producerer specifikke båndmønstre, som senere sammenligning med andre isolater i håb om at identificere beslægtede stammer. Begrænsninger af metoden omfatter praktiske vanskeligheder med ensartede båndmønstre og PFGE -følsomhed som helhed.
Spa locus typing betragtes også som en populær teknik, der bruger en enkelt locus zone i en polymorf region af S. aureus til at skelne enhver form for mutationer. Selvom denne teknik ofte er billig og mindre tidskrævende, er chancen for at miste diskriminerende magt, der gør det svært at skelne mellem MLST-klonale komplekser, en vigtig begrænsning.
Behandling
For modtagelige stammer er den foretrukne behandling for S. aureus -infektion penicillin . Et antibiotikum stammer fra nogle Penicillium- svampearter , penicillin hæmmer dannelsen af peptidoglycan- tværbindinger, der giver stivhed og styrke i en bakteriel cellevæg . Den fire-ledede β-lactamring af penicillin er bundet til enzym DD-transpeptidase , et enzym, der, når det er funktionelt, tværbinder kæder af peptidoglycan, der danner bakterielle cellevægge. Bindingen af β-lactam til DD-transpeptidase hæmmer enzymets funktionalitet, og det kan ikke længere katalysere dannelsen af tværbindinger. Som et resultat er dannelse af cellevægge og nedbrydning ubalanceret, hvilket resulterer i celledød. I de fleste lande er penicillinresistens imidlertid ekstremt almindelig (> 90%), og førstelinjebehandling er oftest et penicillinaseresistent β-lactam-antibiotikum (f.eks. Oxacillin eller flucloxacillin , som begge har samme virkningsmekanisme) som penicillin) eller vancomycin, afhængigt af lokale resistensmønstre. Kombinationsbehandling med gentamicin kan bruges til behandling af alvorlige infektioner, såsom endokarditis , men brugen af den er kontroversiel på grund af den høje risiko for skader på nyrerne. Behandlingsvarigheden afhænger af infektionsstedet og sværhedsgraden. Adjuktivt rifampicin er historisk blevet brugt til behandling af S aureus -bakteriæmi, men randomiseret kontrolleret forsøg har vist, at dette ikke har nogen generel fordel i forhold til standard antibiotikabehandling.
Antibiotikaresistens i S. aureus var ualmindelig, da penicillin blev introduceret første gang i 1943. Faktisk voksede den originale petriskål, hvorpå Alexander Fleming fra Imperial College London observerede den antibakterielle aktivitet af Penicillium -svampen, en kultur af S. aureus . I 1950 var 40% af hospitals S. aureus- isolater penicillinresistente; i 1960 var dette steget til 80%.
Methicillin-resistente Staphylococcus aureus (MRSA, ofte udtalt / m ɜːr s ə / eller / ɛ m ɑːr ɛ s eɪ / ), er en af en række stærkt frygtede stammer af S. aureus , der er blevet resistente over for de fleste β-lactam antibiotika. Af denne grund bruges vancomycin , et glycopeptidantibiotikum , almindeligvis til bekæmpelse af MRSA. Vancomycin hæmmer syntesen af peptidoglycan, men i modsætning til β-lactam-antibiotika målretter og binder glycopeptidantibiotika til aminosyrer i cellevæggen, hvilket forhindrer dannelse af peptidoglycan-tværbindinger. MRSA-stammer findes oftest forbundet med institutioner som hospitaler, men bliver stadig mere udbredt ved infektioner erhvervet af lokalsamfundet.
Mindre hudinfektioner kan behandles med tredobbelt antibiotisk salve . Et aktuelt middel, der er foreskrevet, er Mupirocin, en proteinsyntesehæmmer, der produceres naturligt af Pseudomonas fluorescens og har oplevet succes til behandling af S. aureus næsevogn.
Antibiotikaresistens
Staphylococcal resistens over for penicillin medieres af penicillinase (en form for beta-lactamase ) produktion: et enzym, der spalter β-lactamringen i penicillinmolekylet, hvilket gør antibiotika ineffektivt. Penicillinase-resistente β-lactam antibiotika, såsom methicillin , nafcillin , oxacillin , cloxacillin , dicloxacillin og flucloxacillin er i stand til at modstå nedbrydning ved stafylokokpenicillinase.
Resistens over for methicillin medieres via mec -operonen , en del af stafylokok -kassettens kromosom -mec (SCC mec ). SCCmec er en familie af mobile genetiske elementer, som er en vigtig drivkraft for S. aureus evolution. Resistens tildeles af mecA- genet, som koder for et ændret penicillinbindende protein (PBP2a eller PBP2 '), der har en lavere affinitet for binding af β-lactamer (penicilliner, cephalosporiner og carbapenemer ). Dette giver mulighed for resistens over for alle β-lactam-antibiotika og fjerner deres kliniske anvendelse under MRSA-infektioner. Undersøgelser har forklaret, at dette mobile genetiske element er blevet erhvervet af forskellige slægter i separate genoverførselshændelser, hvilket indikerer, at der ikke er en fælles forfader til forskellige MRSA -stammer. Interessant nok tyder en undersøgelse på, at MRSA ofrer virulens, for eksempel toksinproduktion og invasivitet, for overlevelse og oprettelse af biofilm
Aminoglycosidantibiotika , såsom kanamycin , gentamicin , streptomycin , var engang effektive mod stafylokokinfektioner, indtil stammer udviklede mekanismer til at hæmme aminoglycosidernes virkning, som sker via protoneret amin og/eller hydroxylinteraktioner med det ribosomale RNA i den bakterielle 30S ribosomale underenhed . Tre hovedmekanismer for aminoglycosidresistensmekanismer er i øjeblikket og bredt accepteret: aminoglycosidmodificerende enzymer, ribosomale mutationer og aktiv udstrømning af lægemidlet ud af bakterierne.
Aminoglycosid-modificerende enzymer inaktiverer aminoglycosidet ved kovalent at binde enten et phosphat , nukleotid eller acetyldel til enten aminen eller alkoholnøglefunktionelle gruppe (eller begge grupper) af antibiotikummet. Dette ændrer ladningen eller hindrer antibiotikumet sterisk og reducerer dets ribosomale bindingsaffinitet. I S. aureus er det bedst karakteriserede aminoglycosid-modificerende enzym aminoglycosid adenylyltransferase 4 'IA ( ANT (4') IA ). Dette enzym er blevet løst ved røntgenkrystallografi . Enzymet er i stand til at binde en adenyldel til 4' -hydroxylgruppen af mange aminoglycosider, herunder kamamycin og gentamicin.
Glycopeptidresistens medieres ved erhvervelse af vanA -genet, der stammer fra Tn1546 -transposonen, der findes i et plasmid i enterokokker og koder for et enzym, der producerer et alternativt peptidoglycan, som vancomycin ikke vil binde til.
I dag er S. aureus blevet resistent over for mange almindeligt anvendte antibiotika. I Storbritannien er kun 2% af alle S. aureus -isolater følsomme over for penicillin med et lignende billede i resten af verden. De β-lactamase-resistente penicilliner (methicillin, oxacillin, cloxacillin og flucloxacillin) blev udviklet til behandling af penicillinresistente S. aureus og bruges stadig som førstelinjebehandling. Methicillin var det første antibiotikum i denne klasse, der blev brugt (det blev introduceret i 1959), men kun to år senere blev det første tilfælde af methicillinresistent Staphylococcus aureus (MRSA) rapporteret i England.
På trods af dette forblev MRSA generelt et usædvanligt fund, selv i hospitalsindstillinger, indtil 1990'erne, hvor MRSA -prævalensen på hospitaler eksploderede, og den er nu endemisk .
MRSA-infektioner på både hospitalet og i lokalsamfundet behandles sædvanligvis med ikke-β-lactam-antibiotika, såsom clindamycin (en lincosamin) og co-trimoxazol (også almindeligt kendt som trimethoprim / sulfamethoxazol ). Modstandsdygtighed over for disse antibiotika har også ført til brug af nye, bredspektrede anti-grampositive antibiotika, såsom linezolid , på grund af dets tilgængelighed som et oralt lægemiddel. Førstelinjebehandling for alvorlige invasive infektioner på grund af MRSA er i øjeblikket glycopeptidantibiotika (vancomycin og teicoplanin ). Der opstår en række problemer med disse antibiotika, såsom behovet for intravenøs administration (ingen oral præparat er tilgængelig), toksicitet og behovet for regelmæssigt at overvåge lægemiddelniveauer ved blodprøver. Glykopeptidantibiotika trænger heller ikke særlig godt ind i inficerede væv (dette er en særlig bekymring ved infektioner i hjernen og meninges og ved endokarditis ). Glycopeptider må ikke anvendes til behandling af methicillin-følsomme S. aureus (MSSA), da resultaterne er ringere.
På grund af den høje resistens over for penicilliner og på grund af MRSA's potentiale for at udvikle resistens over for vancomycin har de amerikanske centre for sygdomsbekæmpelse og forebyggelse offentliggjort retningslinjer for korrekt brug af vancomycin. I situationer, hvor forekomsten af MRSA -infektioner er kendt for at være høj, kan den behandlende læge vælge at bruge et glycopeptidantibiotikum, indtil identiteten af den inficerende organisme er kendt. Efter at infektionen er bekræftet at skyldes en methicillin-modtagelig stamme af S. aureus , kan behandlingen efter behov ændres til flucloxacillin eller endda penicillin.
Vancomycin-resistente S. aureus (VRSA) er en stamme af S. aureus, der er blevet resistent over for glycopeptiderne. Det første tilfælde af vancomycin-mellemprodukt S. aureus (VISA) blev rapporteret i Japan i 1996; men det første tilfælde af S. aureus, der virkelig var resistent over for glycopeptidantibiotika, blev først rapporteret i 2002. Tre tilfælde af VRSA -infektion var blevet rapporteret i USA fra 2005. I hvert fald delvis kan den antimikrobielle resistens i S. aureus forklares med dens evne til at tilpasse sig. Flere to -komponent signaltransduktionsveje hjælper S. aureus med at udtrykke gener, der er nødvendige for at overleve under antimikrobiel stress.
Vogn
Omkring 33% af den amerikanske befolkning er bærere af S. aureus og omkring 2% bærer MRSA . Selv sundhedsudbydere kan være MRSA -kolonisatorer
Vognen af S. aureus er en vigtig kilde til hospitalserhvervet infektion (også kaldet nosokomiel) og MRSA, der er erhvervet af lokalsamfundet. Selvom S. aureus kan være til stede på værtens hud, er en stor del af dens vogn gennem de forreste nares i næsepassagerne og kan yderligere være til stede i ørerne. Næsegangernes evne til at rumme S. aureus skyldes en kombination af en svækket eller defekt værtsimmunitet og bakteriens evne til at unddrage sig værts medfødt immunitet. Næsevogn er også impliceret i forekomsten af stafylokokinfektioner.
Infektionskontrol
Spredning af S. aureus (herunder MRSA) sker generelt gennem kontakt mellem mennesker, selvom nogle dyrlæger for nylig har opdaget, at infektionen kan spredes gennem kæledyr, hvor miljøforurening menes at spille en relativt mindre vigtig rolle. Vægt på grundlæggende håndvasketeknikker er derfor effektive til at forhindre overførsel. Personalets brug af engangsforklæder og handsker reducerer hud-til-hud-kontakt, hvilket reducerer risikoen for overførsel yderligere .
For nylig er utallige tilfælde af S. aureus blevet rapporteret på hospitaler i hele Amerika. Overførsel af patogenet lettes i medicinske omgivelser, hvor sundhedsplejerskehygiejne er utilstrækkelig. S. aureus er en utrolig hårdfør bakterie, som det blev vist i en undersøgelse, hvor den overlevede på polyester i knap tre måneder; polyester er det vigtigste materiale, der bruges i hospitalsgardiner til beskyttelse af personlige oplysninger.
Bakterierne transporteres på hænderne på sundhedspersonale, som kan afhente dem fra en tilsyneladende rask patient, der bærer en godartet eller kommensal stamme af S. aureus , og derefter videregive den til den næste patient, der skal behandles. Indførelse af bakterierne i blodbanen kan føre til forskellige komplikationer, herunder endokarditis, meningitis og, hvis den er udbredt, sepsis .
Ethanol har vist sig at være et effektivt topisk desinfektionsmiddel mod MRSA. Kvartært ammonium kan bruges sammen med ethanol for at forøge varigheden af den desinficerende virkning. Forebyggelse af nosokomielle infektioner involverer rutinemæssig og terminal rengøring . Ikke -brandfarlig alkoholdamp i CO
2 NAV-CO2- systemer har en fordel, da de ikke angriber metaller eller plast, der bruges i medicinske miljøer, og ikke bidrager til antibakteriel resistens.
Et vigtigt og tidligere ukendt middel til samfundsrelateret MRSA-kolonisering og transmission er under seksuel kontakt.
S. aureus dræbes på et minut ved 78 ° C og på ti minutter ved 64 ° C, men er modstandsdygtig over for frysning .
Visse stammer af S. aureus er blevet beskrevet som værende resistente over for klordesinfektion
Brugen af mupirocinsalve kan reducere infektionshastigheden på grund af nasal transport af S. aureus. Der er begrænset dokumentation for, at nasal dekontaminering af S. aureus ved hjælp af antibiotika eller antiseptika kan reducere hyppigheden af infektioner på kirurgisk sted.
| Top almindelige bakterier i hver branche | |
|---|---|
| Catering industri | Vibrio parahaemolyticus , S. aureus , Bacillus cereus |
| Medicinsk industri | Escherichia coli , S. aureus , Pseudomonas aeruginosa |
Forskning
Fra og med 2021 findes der ingen godkendt vaccine mod S. aureus . Tidlige kliniske forsøg er blevet udført med flere vaccinkandidater, såsom Nabi's StaphVax og PentaStaph, Intercell's / Merck's V710, VRi's SA75 og andre.
Mens nogle af disse vaccinkandidater har vist immunrespons, forværrede andre en infektion af S. aureus . Til dato giver ingen af disse kandidater beskyttelse mod en S. aureus -infektion. Udviklingen af Nabi's StaphVax blev stoppet i 2005 efter fase III -forsøg mislykkedes. Intercells første V710 -vaccinevariant blev afsluttet under fase II/III efter højere dødelighed og morbiditet blev observeret blandt patienter, der udviklede S. aureus -infektion.
Nabis forbedrede S. aureus -vaccinkandidat PentaStaph blev solgt i 2011 til GlaxoSmithKline Biologicals SA Den nuværende status for PentaStaph er uklar. Et WHO -dokument indikerer, at PentaStaph mislykkedes i fase III -forsøgsfasen.
I 2010 startede GlaxoSmithKline en fase 1 blindundersøgelse for at evaluere sin GSK2392103A -vaccine. Fra 2016 er denne vaccine ikke længere under aktiv udvikling.
Pfizers S. aureus fire-antigen-vaccine SA4Ag blev tildelt fast track-betegnelse af US Food and Drug Administration i februar 2014. I 2015 har Pfizer påbegyndt et fase 2b-forsøg vedrørende SA4Ag-vaccinen. Fase 1 -resultater offentliggjort i februar 2017 viste en meget robust og sikker immunogenicitet af SA4Ag. Vaccinen gennemgik et klinisk forsøg indtil juni 2019 med resultater offentliggjort i Semptember 2020, der ikke påviste en signifikant reduktion i postoperativ infektion i blodbanen efter operationen.
I 2015 offentliggjorde Novartis Vaccines and Diagnostics, en tidligere division af Novartis og nu en del af GlaxoSmithKline, lovende prækliniske resultater af deres firekomponent Staphylococcus aureus- vaccine, 4C-staph.
I 2020 viste æterisk olie, ekstraheret ved hydrodistillation fra bladene på Myrciaria pilosa , at have potentiale som et antimikrobielt lægemiddel til at kontrollere infektion med multiresistente stammer af stafylokokus aureus.
Standardstammer
En række standardstammer af S. aureus (kaldet "typekulturer") bruges i forskning og i laboratorietest.
| Navn | NCTC | ATCC | Indbetalingsår | Kommentar |
|---|---|---|---|---|
| Oxford H | 6571 | 9144 | 1943 | Standardstamme, der bruges til at teste penicillinstyrken, og ved hvilken penicillinenheden oprindeligt blev defineret. |
| Rosenbach | 12973 | 29213 | 1884 | Standard stamme til EUCAST antimikrobiel resistens test. |
Referencer
Yderligere læsning
- Loskill P, Pereira PM, Jung P, Bischoff M, Herrmann M, Pinho MG, Jacobs K (september 2014). "Reduktion af peptidoglycan -tværbindingen forårsager et fald i stivheden i Staphylococcus aureus -cellehylsteret" . Biofysisk Journal . 107 (5): 1082–1089. Bibcode : 2014BpJ ... 107.1082L . doi : 10.1016/j.bpj.2014.07.029 . PMC 4156677 . PMID 25185544 .
- Benson MA, Ohneck EA, Ryan C, Alonzo F, Smith H, Narechania A, Kolokotronis SO, Satola SW, Uhlemann AC, Sebra R, Deikus G, Shopsin B, Planet PJ, Torres VJ (august 2014). "Evolution af hypervirulens ved en MRSA -klon gennem erhvervelse af et transponerbart element" . Molekylær mikrobiologi . 93 (4): 664–81. doi : 10.1111/mmi.12682 . PMC 4127135 . PMID 24962815 .
eksterne links
| Klassifikation |
|---|
- StopMRSANow.org - Diskuterer, hvordan man forhindrer spredning af MRSA
- TheMRSA.com - Forstå hvad MRSA -infektionen handler om.
- " Staphylococcus aureus " . NCBI -taksonomi -browser . 1280.
- Packham C (16. marts 2015). "Vellykket in vivo test af gennembrud Staphylococcus aureus vaccine" . Medicinsk Presse . Arkiveret fra originalen den 19. september 2012 . Hentet 18. marts 2015 .
- Type stamme af Staphylococcus aureus ved Bac Dive - Metadatabase for bakteriel mangfoldighed