Transient receptor potential channel - Transient receptor potential channel
| Transient receptor potential (TRP) ionkanal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatorer | |||||||||
| Symbol | TRP | ||||||||
| Pfam | PF06011 | ||||||||
| InterPro | IPR013555 | ||||||||
| OPM superfamilie | 8 | ||||||||
| OPM -protein | 3j5p | ||||||||
| Membranome | 605 | ||||||||
| |||||||||
Transiente receptorpotentiale -kanaler ( TRP -kanaler ) er en gruppe af ionkanaler, der hovedsageligt er placeret på plasmamembranen i talrige dyrecelletyper. De fleste af disse er grupperet i to brede grupper: Gruppe 1 inkluderer TRPC ("C" for kanonisk), TRPV ("V" for vanilloid), TRPVL ("VL" for vanilloidlignende), TRPM ("M" for melastatin) , TRPS ("S" for soromelastatin), TRPN ("N" uden mekanoreceptorpotentiale C) og TRPA ("A" for ankyrin). Gruppe 2 består af TRPP ("P" for polycystisk) og TRPML ("ML" for mucolipin). Der findes andre mindre velkategoriserede TRP-kanaler, herunder gærkanaler og et antal gruppe 1- og gruppe 2-kanaler, der findes i ikke-dyr. Mange af disse kanaler formidler en række forskellige fornemmelser som smerte, temperatur, forskellige slags smag, tryk og syn. I kroppen menes nogle TRP -kanaler at opføre sig som mikroskopiske termometre og bruges i dyr til at fornemme varme eller kolde. Nogle TRP -kanaler aktiveres af molekyler, der findes i krydderier som hvidløg ( allicin ), chilipeber ( capsaicin ), wasabi ( allylisothiocyanat ); andre aktiveres af menthol , kamfer , pebermynte og kølemidler; endnu andre aktiveres af molekyler, der findes i cannabis (dvs. THC , CBD og CBN ) eller stevia . Nogle fungerer som sensorer for osmotisk tryk, volumen, strækning og vibrationer. De fleste af kanalerne aktiveres eller hæmmes ved signalering af lipider og bidrager til en familie af lipidgaterede ionkanaler .
Disse ionkanaler har en relativt ikke-selektiv permeabilitet for kationer , herunder natrium , calcium og magnesium .
TRP -kanaler blev oprindeligt opdaget i den såkaldte "transient receptor potential" mutant ( trp -mutant) stamme af frugtfluen Drosophila , deraf deres navn (se History of Drosophila TRP -kanaler nedenfor). Senere blev TRP -kanaler fundet hos hvirveldyr, hvor de allestedsnærværende udtrykkes i mange celletyper og væv. De fleste TRP-kanaler er sammensat af 6 membranspændende spiraler med intracellulære N- og C-terminaler . Pattedyrs TRP -kanaler aktiveres og reguleres af en lang række stimuli og udtrykkes i hele kroppen.
Familier
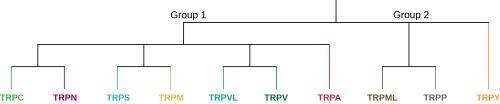
I dyre -TRP -superfamilien er der i øjeblikket 9 foreslåede familier opdelt i to grupper, der hver familie indeholder et antal underfamilier. Gruppe et består af TRPC, TRPV, TRPVL, TRPA, TRPM, TRPS og TRPN, mens gruppe to indeholder TRPP og TRPML. Der er en ekstra familie mærket TRPY, der ikke altid er inkluderet i nogen af disse grupper. Alle disse underfamilier ligner hinanden, idet de er molekylære sansende, ikke-selektive kationkanaler, der har seks transmembransegmenter, men hver underfamilie er meget unik og deler lidt strukturel homologi med hinanden. Denne unikhed giver anledning til de forskellige sensoriske opfattelses- og reguleringsfunktioner, som TRP -kanaler har i hele kroppen. Gruppe et og gruppe to varierer, idet både TRPP og TRPML i gruppe to har en meget længere ekstracellulær sløjfe mellem S1 og S2 transmembransegmenterne. En anden differentierende egenskab er, at alle gruppe en-underfamilierne enten indeholder en C-terminal, intracellulær ankyrin-gentagelsessekvens, en N-terminal TRP-domænesekvens eller begge dele-hvorimod begge gruppe to underfamilier ikke har nogen. Nedenfor er medlemmer af underfamilierne og en kort beskrivelse af hver:
TRPA
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPA | TRPA1 | Hvirveldyr , leddyr og bløddyr |
| TRPA-lignende | Choanoflagellater , cnidarians , nematoder , leddyr (kun krebsdyr og myriapoder), bløddyr og pighuder | |
| TRPA5 | Leddyr (kun krebsdyr og insekter) | |
| smertefri | ||
| pyreksi | ||
| vandheks | ||
| HsTRPA | Specifik for hymenopteranske insekter |
TRPA, A for "ankyrin", er opkaldt efter den store mængde ankyrin-gentagelser, der findes nær N-terminalen. TRPA findes primært i afferente nociceptive nervefibre og er forbundet med forstærkning af smertesignalering samt kold smerteoverfølsomhed. Disse kanaler har vist sig at være både mekaniske receptorer for smerter og kemosensorer aktiveret af forskellige kemiske arter, herunder isothiocyanater (skarpe kemikalier i stoffer som sennepsolie og wasabi), cannabinoider, generelle og lokale analgetika og cinnamaldehyd.
Mens TRPA1 udtrykkes i en lang række dyr, findes der en række andre TRPA -kanaler uden for hvirveldyr. TRPA5, smertefri, pyrexi og vandheks er adskilte fylogenetiske grene inden for TRPA-kladen og kan kun udtrykkes i krebsdyr og insekter, mens HsTRPA opstod som en Hymenoptera-specifik duplikation af vandheks. Ligesom TRPA1 og andre TRP -kanaler fungerer disse som ionkanaler i en række sensoriske systemer. TRPA- eller TRPA1-lignende kanaler findes også i en række arter som en fylogenetisk adskilt klade, men disse er mindre velforståede.
TRPC
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPC | TRPC1 | Hvirveldyr |
| TRPC2 | ||
| TRPC3 | ||
| TRPC4 | ||
| TRPC5 | ||
| TRPC6 | ||
| TRPC7 | ||
| TRP | Leddyr | |
| TRPgamma | ||
| TRPL | ||
| Ukendt | Choanoflagellater, cnidarians, xenacoelomorphs , lophotrochozoans og nematoder |
TRPC, C for "kanonisk", er opkaldt efter at være den tættest beslægtede med drosophilia TRP, navnebror til TRP -kanaler. Fylogenien i TRPC -kanaler er ikke blevet løst i detaljer, men de er til stede på tværs af dyretaxa. Der er faktisk kun seks TRPC-kanaler udtrykt hos mennesker, fordi TRPC2 viser sig at være udtrykt udelukkende i mus og betragtes som et pseudo-gen hos mennesker; dette skyldes delvist TRPC2's rolle i påvisning af feromoner, hvilke mus har en øget evne sammenlignet med mennesker. Mutationer i TRPC -kanaler har været forbundet med luftvejssygdomme sammen med fokal segmental glomerulosklerose i nyrerne. Alle TRPC -kanaler aktiveres enten af phospholipase C (PLC) eller diacyglycerol (DAG).
TRPM
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPM | Alpha/α (inkl. TRPM1, 3, 6 og 7) | Choanoflagellater og dyr (undtagen tardigrader ) |
| Beta/β (inkl. TRPM2, 4, 5 og 8) |
TRPM, M for "melastatin", blev fundet under en sammenlignende genetisk analyse mellem godartet nevi og malign nevi (melanom). Mutationer inden for TRPM -kanaler har været forbundet med hypomagnesæmi med sekundær hypocalcæmi. TRPM-kanaler er også blevet kendt for deres koldfølende mekanismer, sådan er det med TRPM8. Sammenlignende undersøgelser har vist, at de funktionelle domæner og kritiske aminosyrer i TRPM -kanaler er stærkt bevaret på tværs af arter.
Fylogenetik har vist, at TRPM -kanaler er opdelt i to store klader, αTRPM og βTRPM. aTRPM'er inkluderer blandt andet vertebrater TRPM1, TRPM3 og "chanzymerne" TRPM6 og TRPM7 samt den eneste insekt TRPM -kanal. βTRPM'er inkluderer, men er ikke begrænset til, hvirveldyr TRPM2, TRPM4, TRPM5 og TRPM8 (kold- og mentolsensoren). To yderligere store klader er blevet beskrevet: TRPMc, som kun findes i en række leddyr, og en basalklade, som siden er blevet foreslået at være en særskilt og adskilt TRP -kanalfamilie (TRPS).
TRPML
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPML | Ukendt | Cnidarianer, basale hvirveldyr, sækdyr , cephalochordates , hemichordates , pighuder, leddyr, og nematoder |
| TRPML1 | Specifik for kæbede hvirveldyr | |
| TRPML2 | ||
| TRPML3 |
TRPML, ML for "mucolipin", har sit navn fra neurodevelopmental lidelsen mucolipidosis IV . Mucolipidosis IV blev først opdaget i 1974 af ER Berman, der bemærkede abnormiteter i et spædbarns øjne. Disse abnormiteter blev hurtigt forbundet med mutationer til MCOLN1 -genet, der koder for TRPML1 -ionkanalen. TRPML er stadig ikke særligt karakteriseret. De tre kendte hvirveldyrskopier er begrænset til kæbede hvirveldyr, med nogle undtagelser (f.eks. Xenopus tropicalis ).
TRPN
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPN | TRPN/nompC | Placozoans, cnidarians, nematoder, leddyr, bløddyr, annelider og hvirveldyr (undtagen fostervand) |
TRPN blev oprindeligt beskrevet i Drosophila melanogaster og Caenorhabditis elegans som nompC, en mekanisk lukket ionkanal. Kun en enkelt TRPN, N for "ingen mekanoreceptorpotentiale C" eller "nompC", vides bredt at blive udtrykt i dyr (selvom nogle Cnidarians har mere), og er især kun et pseudogen hos fostervirveldyr . På trods af at TRPA er opkaldt efter ankyrin -gentagelser, menes TRPN -kanaler at have størst mulig værdi af enhver TRP -kanal, typisk omkring 28, som er stærkt bevarede på tværs af taxa Siden opdagelsen har Drosophila nompC været impliceret i mekanosensation (herunder mekanisk stimulering af neglebåndet og lyddetektering) og kold nociception .
TRPP
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPP | PKD1-lignende | Dyr (undtagen leddyr) |
| PKD2-lignende | Dyr | |
| Brividos | Insekter |
TRPP , P for "polycistin", er opkaldt efter polycystisk nyresygdom , som er forbundet med disse kanaler. Disse kanaler omtales også som PKD (polycistic kindey disease) ionkanaler.
PKD2-lignende gener (eksempler inkluderer TRPP2 , TRPP3 og TRPP5 ) koder for kanoniske TRP-kanaler. PKD1-lignende gener koder for meget større proteiner med 11 transmembransegmenter, som ikke har alle funktionerne i andre TRP-kanaler. Imidlertid har 6 af de transmebrane segmenter af PKD1-lignende proteiner betydelig sekvenshomologi med TRP-kanaler, hvilket indikerer, at de ganske enkelt kan have diversificeret sig meget fra andre nært beslægtede proteiner.
Insekter har en tredje underfamilie af TRPP, kaldet brividos, som deltager i koldfornemmelse.
TRPS
TRPS, S for Soromelastatin, blev navngivet, da det danner en søstergruppe til TRPM. TRPS er stort set til stede hos dyr, men især fraværende hos hvirveldyr og insekter (blandt andre). TRPS er endnu ikke blevet godt beskrevet funktionelt, selvom det vides, at C. elegans TRPS, kendt som CED-11, er en calciumkanal, der deltager i apoptose .
TRPV
| Familie | Underfamilie | Kendt Taxa |
|---|---|---|
| TRPV | Nanchung | Placozoans , cnidarians, nematoder, annelider, bløddyr og leddyr (muligvis undtagen arachnider ) |
| Inaktiv | ||
| TRPV1 | Specifikt for hvirveldyr | |
| TRPV2 | ||
| TRPV3 | ||
| TRPV4 | ||
| TRPV5 | ||
| TRPV6 |
TRPV, V for "vanilloid", blev oprindeligt opdaget i Caenorhabditis elegans og er opkaldt efter de vanilloidkemikalier, der aktiverer nogle af disse kanaler. Disse kanaler er blevet kendt for deres tilknytning til molekyler som capsaicin (en TRPV1 -agonist). Ud over de 6 kendte hvirveldyrsparaloger kendes 2 større klader uden for deterostomerne: nanchung og Iav. Mekanistiske undersøgelser af disse sidstnævnte klader har stort set været begrænset til Drosophila , men fylogenetiske analyser har placeret en række andre gener fra Placozoa, Annelida, Cnidaria, Mollusca og andre leddyr inden for dem. TRPV -kanaler er også blevet beskrevet i protister.
TRPVL
TRPVL er blevet foreslået at være en søsterklade til TRPV og er begrænset til cnidarians Nematostella vectensis og Hydra magnipapillata og annelid Capitella teleta . Lidt er kendt om disse kanaler.
TRPY
TRPY, Y for "gær", er stærkt lokaliseret til gærvakuolen, som er den funktionelle ækvivalent af et lysosom i en pattedyrscelle, og fungerer som en mekanosensor for vakuolært osmotisk tryk. Patch clamp -teknikker og hyperosmotisk stimulering har illustreret, at TRPY spiller en rolle i intracellulær calciumfrigivelse. Fylogenetisk analyse har vist, at TRPY1 ikke udgør en del med de andre metazoanske TRP -grupper et og to, og det foreslås at have udviklet sig efter divergensen mellem metazoaner og svampe. Andre har angivet, at TRPY er tættere beslægtet med TRPP.
Struktur
TRP-kanaler er sammensat af 6 membranspændende spiraler (S1-S6) med intracellulære N- og C-terminaler . Pattedyrs TRP-kanaler aktiveres og reguleres af en lang række stimuli, herunder mange post-transkriptionelle mekanismer som fosforylering , G-proteinreceptorkobling , ligand-gating og ubiquitination . Receptorerne findes i næsten alle celletyper og er stort set lokaliseret i celle- og organellemembraner, hvilket modulerer ionindgang.
De fleste TRP-kanaler danner homo- eller heterotetramere, når de er fuldstændigt funktionelle. Ionselektivitetsfilteret, pore, dannes af den komplekse kombination af p-loops i det tetrameriske protein, som er placeret i det ekstracellulære domæne mellem S5- og S6-transmembransegmenterne. Som med de fleste kationkanaler har TRP -kanaler negativt ladede rester i poren for at tiltrække de positivt ladede ioner.
Gruppe 1 Karakteristika
Hver kanal i denne gruppe er strukturelt unik, hvilket øger den mangfoldighed af funktioner, som TRP -kanaler besidder, men der er nogle fællestræk, der adskiller denne gruppe fra andre. Fra den intracellulære N-terminal er der varierende længder af ankryin-gentagelser (undtagen i TRPM), der hjælper med membranforankring og andre proteininteraktioner. Kort efter S6 på den C-terminale ende er der et stærkt konserveret TRP-domæne (undtagen i TRPA), som er involveret i portmodulering og kanalmultimerisering. Andre C-terminale ændringer, såsom alfa-kinasedomæner i TRPM7 og M8, er også set i denne gruppe.
Gruppe 2 Karakteristika
Gruppe to mest kendetegnende træk er det lange ekstracellulære spænd mellem S1 og S2 transmembransegmenterne. Medlemmer af gruppe to mangler også ankryin -gentagelser og et TRP -domæne. De har imidlertid vist sig at have endoplasmatisk retikulum (ER) retentionssekvenser mod den C-terminale ende, der illustrerer mulige interaktioner med ER.
Fungere
TRP -kanaler modulerer drivkræfter til ionindgang og Ca 2+ og Mg 2+ transportmaskiner i plasmamembranen, hvor de fleste er placeret. TRP'er har vigtige interaktioner med andre proteiner og danner ofte signalkomplekser, hvis nøjagtige veje er ukendte. TRP -kanaler blev oprindeligt opdaget i trp -mutantstammen af frugtfluen Drosophila, der udviste forbigående forhøjelse af potentialet som reaktion på lysstimuli og blev kaldt så forbigående receptorpotentiale -kanaler. TRPML -kanaler fungerer som intracellulære calciumfrigivelseskanaler og tjener således en vigtig rolle i organelleregulering. Det er vigtigt, at mange af disse kanaler formidler en række forskellige fornemmelser som fornemmelser af smerte, temperatur, forskellige slags smag, tryk og syn. I kroppen menes nogle TRP -kanaler at opføre sig som mikroskopiske termometre og bruges i dyr til at fornemme varme eller kolde. TRP'er fungerer som sensorer for osmotisk tryk , volumen , strækning og vibrationer . TRP'er har vist sig at have komplekse multidimensionale roller i sensorisk signalering. Mange TRP'er fungerer som intracellulære calciumfrigivelseskanaler.
Smerte og temperaturfornemmelse
TRP -ionkanaler omdanner energi til aktionspotentialer i somatosensoriske nociceptorer. Thermo-TRP-kanaler har et C-terminal domæne, der er ansvarligt for termosensation og har et specifikt udskifteligt område, der giver dem mulighed for at fornemme temperaturstimuli, der er knyttet til ligandregulerende processer. Selvom de fleste TRP -kanaler moduleres af temperaturændringer, har nogle en afgørende rolle i temperaturfornemmelsen. Der er mindst 6 forskellige Thermo-TRP-kanaler, der hver spiller en anden rolle. F.eks. Vedrører TRPM8 mekanismer til registrering af kulde, TRPV1 og TRPM3 bidrager til varme- og betændelsesfornemmelser, og TRPA1 letter mange signalveje som sensorisk transduktion, nociception , inflammation og oxidativ stress .
Smag
TRPM5 er involveret i smag signalering af søde , bitre og Umami smag ved at modulere signal pathway i type II smags-receptor -celler. TRPM5 aktiveres af de søde glycosider, der findes i stevia -planten .
Flere andre TRP -kanaler spiller en væsentlig rolle i kemosensation gennem sensoriske nerveender i munden, der er uafhængige af smagsløg. TRPA1 reagerer på sennepsolie ( allylisothiocyanat ), wasabi og kanel, TRPA1 og TRPV1 reagerer på hvidløg ( allicin ), TRPV1 reagerer på chili peber ( capsaicin ), TRPM8 aktiveres af mentol , kamfer , pebermynte og kølemidler; TRPV2 aktiveres af molekyler ( THC , CBD og CBN ) fundet i marihuana.
TRP-lignende kanaler i insektvision

De trp -mutante frugtfluer, der mangler en funktionel kopi af trp -genet, er kendetegnet ved en forbigående reaktion på lys, i modsætning til vildtype fluer, der demonstrerer en vedvarende fotoreceptorcelleaktivitet som reaktion på lys. En fjernt beslægtet isoform af TRP-kanal, TRP-lignende kanal (TRPL), blev senere identificeret i Drosophila fotoreceptorer, hvor den udtrykkes ved cirka 10- til 20 gange lavere niveauer end TRP-protein. En mutant flue, trpl , blev efterfølgende isoleret. Bortset fra strukturelle forskelle adskiller TRP- og TRPL -kanalerne sig i kationpermeabilitet og farmakologiske egenskaber.
TRP/TRPL -kanaler er alene ansvarlige for depolarisering af insektfotoreceptorplasmamembran som reaktion på lys. Når disse kanaler åbner, tillader de natrium og calcium at komme ind i cellen ned ad koncentrationsgradienten, som depolariserer membranen. Variationer i lysintensitet påvirker det samlede antal åbne TRP/TRPL -kanaler og derfor graden af membrandepolarisering. Disse sorterede spænding responser forplante sig til fotoreceptortransplantater synapser med anden ordens retinale neuroner og yderligere til hjernen.
Det er vigtigt at bemærke, at mekanismen for insektfotoreception er dramatisk forskellig fra den hos pattedyr. Excitation af rhodopsin i pattedyrs fotoreceptorer fører til hyperpolarisering af receptormembranen, men ikke til depolarisering som i insektøjet. I Drosophila og, det formodes, andre insekter, forbinder en phospholipase C (PLC) -medieret signalkaskade fotoexcitation af rhodopsin til åbningen af TRP/TRPL-kanalerne. Selvom talrige aktivatorer af disse kanaler, såsom phosphatidylinositol-4,5-bisphosphat (PIP 2 ) og flerumættede fedtsyrer (PUFA'er) var kendt i årevis, forblev en nøglefaktor, der medierer kemisk kobling mellem PLC- og TRP/TRPL-kanaler, indtil for nylig. Det blev konstateret, at nedbrydning af et lipidprodukt fra PLC -kaskade, diacylglycerol (DAG), ved enzymet diacylglycerollipase , genererer PUFA'er, der kan aktivere TRP -kanaler og dermed starte membrandepolarisering som reaktion på lys. Denne mekanisme til aktivering af TRP-kanal kan være velbevaret blandt andre celletyper, hvor disse kanaler udfører forskellige funktioner.
Klinisk betydning
Mutationer i TRP'er har været forbundet med neurodegenerative lidelser, skeletdysplasi , nyresygdomme og kan spille en vigtig rolle ved kræft. TRP'er kan udgøre vigtige terapeutiske mål. Der er betydelig klinisk betydning for TRPV1, TRPV2, TRPV3 og TRPM8's rolle som termoreceptorer og TRPV4 og TRPA1's rolle som mekanoreceptorer; reduktion af kronisk smerte kan være mulig ved at målrette ionkanaler involveret i termisk, kemisk og mekanisk fornemmelse for at reducere deres følsomhed over for stimuli. For eksempel ville brugen af TRPV1 -agonister potentielt hæmme nociception ved TRPV1, især i bugspytkirtelvæv, hvor TRPV1 er stærkt udtrykt. TRPV1 -agonisten capsaicin, der findes i chilipeber, er blevet indiceret til at lindre neuropatiske smerter. TRPV1 -agonister hæmmer nociception ved TRPV1
Rolle i kræft
Ændret ekspression af TRP -proteiner fører ofte til tumorigenese , som rapporteret for TRPV1, TRPV6, TRPC1, TRPC6, TRPM4, TRPM5 og TRPM8. TRPV1 og TRPV2 har været impliceret i brystkræft. TRPV1 -ekspression i aggregater fundet på endoplasmatisk retikulum eller Golgi -apparat og/eller omkring disse strukturer hos brystkræftpatienter giver dårligere overlevelse. TRPV2 er et potentielt biomarkør og terapeutisk mål for tredobbelt negativ brystkræft. TRPM-familien af ionkanaler er især forbundet med prostatakræft, hvor TRPM2 (og dets lange ikke-kodende RNA TRPM2-AS ), TRPM4 og TRPM8 er overudtrykt i prostatakræft forbundet med mere aggressive resultater. TRPM3 har vist sig at fremme vækst og autofagi i nyrecellecarcinom i klare celler, TRPM4 er overudtrykt i diffust stort B-cellelymfom forbundet med dårligere overlevelse, mens TRPM5 har onkogene egenskaber ved melanom .
Rolle i inflammatoriske reaktioner
Ud over TLR4 -medierede veje genkender visse medlemmer af familien af de forbigående receptorpotentiale ionkanaler LPS . LPS-medieret aktivering af TRPA1 blev vist hos mus og Drosophila melanogaster fluer. Ved højere koncentrationer aktiverer LPS også andre medlemmer af den sensoriske TRP -kanalfamilie, såsom TRPV1, TRPM3 og til en vis grad TRPM8. LPS genkendes af TRPV4 på epitelceller. TRPV4 -aktivering ved LPS var nødvendig og tilstrækkelig til at inducere nitrogenoxidproduktion med en bakteriedræbende virkning.
Historien om Drosophila TRP -kanaler
Den originale TRP-mutant i Drosophila blev første gang beskrevet af Cosens og Manning i 1969 som "en mutant stamme af D. melanogaster, der, selv om den opfører sig fototaktisk positiv i en T-labyrint under lavt omgivende lys, er synshandicappet og opfører sig som blind" . Det viste også et unormalt elektroretinogramrespons af fotoreceptorer på lys, som var forbigående snarere end vedvarende som i "vildtypen". Det blev efterfølgende undersøgt af Baruch Minke, en post-doc i gruppen af William Pak, og navngivet TRP i henhold til dets adfærd i ERG. Identiteten af det muterede protein var ukendt, indtil det blev klonet af Craig Montell, en postdoktoral forsker i Gerald Rubins forskningsgruppe, i 1989, der noterede sig det forudsagte strukturelle forhold til kanaler, der var kendt på det tidspunkt, og Roger Hardie og Baruch Minke, der leverede beviser i 1992 for, at det er en ionkanal, der åbner som reaktion på lysstimulering. TRPL -kanalen blev klonet og karakteriseret i 1992 af forskningsgruppen Leonard Kelly.
Referencer
Yderligere læsning
eksterne links
- Transient+Receptor+Potential+Channels at the US National Library of Medicine Medical Subject Headings (MeSH)
- "Transient Receptor Potential Channels" . IUPHAR Database over receptorer og ionkanaler . International Union of Basic and Clinical Pharmacology.
- Clapham DE, DeCaen P, Carvacho I, Chaudhuri D, Doerner JF, Julius D, et al. "Transient Receptor Potentielle kanaler" . IUPHAR/BPS Guide til farmakologi.
- "TRIP -database" . en manuelt kureret database over protein-protein-interaktioner for TRP-kanaler fra pattedyr .