X -inaktivering - X-inactivation

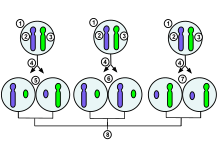
1. tidlig fase embryonale celle af et kvindeligt menneske 2.
moder X-kromosom 3.
paternalt X-kromosom 4.
mitose og tilfældigt X-kromosom inaktiveringsbegivenhed
5. paternalt kromosom inaktiveres tilfældigt i en dattercelle, moderens kromosom inaktiveres i de andre
6 .Paternelt kromosom inaktiveres tilfældigt i begge datterceller
7. Maternelt kromosom inaktiveres tilfældigt i begge datterceller
8. Tre mulige tilfældige kombinationsresultater
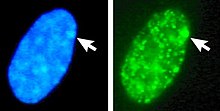
Til venstre: DNA (DAPI) -farvet kerne. Pil angiver placeringen af Barr -krop (Xi). Til højre: DNA -associeret histonprotein påvist
X-inaktivering (også kaldet Lyonization efter engelsk arvelighedsforsker Mary Lyon ) er en proces, hvorved en af kopierne af X kromosom inaktiveres i therian kvindelige pattedyr . Det inaktive X -kromosom dæmpes ved, at det pakkes i en transskriptionelt inaktiv struktur kaldet heterochromatin . Da næsten alle hunpattedyr har to X-kromosomer, X-inaktiveringsprocedurer forhindrer dem i at have dobbelt så mange X-kromosom -genprodukter som mænd , der kun besidder en enkelt kopi af X-kromosomet (se dosering kompensation ).
Valget af hvilket X -kromosom der vil blive inaktiveret er tilfældigt hos placentapattedyr som mennesker , men når et X -kromosom er inaktiveret vil det forblive inaktivt i hele cellens levetid og dets efterkommere i organismen (dets cellelinje). X-inaktivering, der er ujævnt fordelt over cellelinjer inden for en organisme ( skæv X-inaktivering ) forekommer almindeligvis.
I modsætning til tilfældig X-inaktivering hos placentapattedyr gælder inaktivering i pungdyr udelukkende for det paternalt afledte X-kromosom.
Mekanisme
Cyklus for X-kromosomaktivering hos gnavere
Afsnittene herunder har kun at gøre med gnavere og afspejler ikke XI hos de fleste pattedyr. X-inaktivering er en del af aktiveringscyklussen for X-kromosomet i hele kvindelivet. Ægget og den befrugtede zygote bruger i første omgang maternelle transkripter, og hele det embryonale genom bliver tavs, indtil zygotisk genomaktivering. Derefter alle muse celler undergår en tidlig, præget inaktivering af paternelt-afledte X-kromosom i 4-8 cellestadie embryoer . De ekstraembryoniske væv (som giver anledning til moderkagen og andre væv, der understøtter embryoet) bevarer denne tidlige påtrykte inaktivering, og dermed er kun moderens X -kromosom aktivt i disse væv.
I den tidlige blastocyst vendes denne indledende, påtrykte X-inaktivering i cellerne i den indre cellemasse (som giver anledning til embryoet), og i disse celler bliver begge X-kromosomer aktive igen. Hver af disse celler inaktiverer derefter uafhængigt og tilfældigt en kopi af X -kromosomet. Denne inaktiveringshændelse er irreversibel i individets levetid, med undtagelse af kimlinjen. I den kvindelige kønscelle før meiotisk indgang vendes X-inaktivering, så alle haploide oocytter efter meiose indeholder et enkelt aktivt X-kromosom.
Oversigt
Den Xi markerer den inaktive, Xa den aktive X-kromosom. X P betegner faderlig, og X M betegner moderens X -kromosom. Når ægget (bærende X M ) befrugtes af en sædcelle (bærer et Y eller et X P ) dannes en diploid zygote. Fra zygote, gennem voksenstadiet, til den næste generation af æg, undergår X -kromosomet følgende ændringer:
- Xi P Xi M zygote → undergår zygotisk genomaktivering , hvilket fører til:
- Xa P Xa M → underlagt påtrykt (faderlig) X-inaktivering , hvilket fører til:
- Xi P Xa M → undergår X-aktivering i det tidlige blastocyststadium , hvilket fører til:
- Xa P Xa M → undergår tilfældig X-inaktivering i den embryonale slægt (indre cellemasse) i blastocyststadiet, hvilket fører til:
- Xi P Xa M ELLER Xa P Xi M → undergår X-reaktivering i urkimceller før meiose , hvilket fører til:
- Xa M Xa P diploide kimceller i meiotisk arrest. Da meiosen jeg kun fuldender med ægløsning , eksisterer menneskelige kønsceller i dette stadium fra de første udviklingsuger til puberteten. Afslutningen af meiose fører til:
- Xa M OG Xa P haploide kimceller (æg).
X -aktiveringscyklussen er bedst undersøgt hos mus, men der er flere undersøgelser hos mennesker. Da de fleste beviser kommer fra mus, repræsenterer ovenstående skema begivenhederne hos mus. Afslutningen af meiosen er forenklet her for klarhed. Trin 1-4 kan studeres i in vitro -befrugtede embryoner og i differentierende stamceller; X-reaktivering sker i det udviklende embryo, og efterfølgende (6-7) trin inde i hunkroppen, derfor meget sværere at studere.
Timing
Tidspunktet for hver proces afhænger af arten, og i mange tilfælde diskuteres det præcise tidspunkt aktivt. [Hele delen af den menneskelige timing af X-inaktivering i denne tabel er stærkt tvivlsom og bør fjernes, indtil den er korrekt underbygget af empiriske data]
| Behandle | Mus | Human | |
| 1 | Zygotisk genomaktivering | 2-4 celletrin | 2-8 celletrin |
| 2 | Påtrykt (faderlig) X-inaktivering | 4-8 celletrin | Uklart, om det finder sted hos mennesker |
| 3 | X-aktivering | Tidligt blastocyststadium | Tidligt blastocyststadium |
| 4 | Tilfældig X-inaktivering i den embryonale slægt (indre cellemasse) | Sent blastocyststadium | Sent blastocyststadium efter implantation |
| 5 | X-reaktivering i urkimceller før meiose | Fra før udviklingsuge 4 til uge 14 |
Arv af inaktiveringsstatus på tværs af cellegenerationer
Efterkommere af hver celle, der inaktiverede et bestemt X -kromosom, vil også inaktivere det samme kromosom. Dette fænomen, som kan observeres ved farvning af skildpaddeskatte, når hunner er heterozygote for det X-bundne gen , bør ikke forveksles med mosaicisme , som er et udtryk, der specifikt refererer til forskelle i genotypen for forskellige cellepopulationer i samme individuel; X-inaktivering, som er en epigenetisk ændring, der resulterer i en anden fænotype, er ikke en ændring på det genotypiske niveau. For en individuel celle eller slægt er inaktiveringen derfor skæv eller ' ikke-tilfældig ', og dette kan give anledning til milde symptomer hos kvindelige 'bærere' af X-bundne genetiske lidelser.
Udvælgelse af ét aktivt X -kromosom
Normale hunner besidder to X -kromosomer, og i en given celle vil et kromosom være aktivt (betegnet Xa), og et vil være inaktivt (Xi). Undersøgelser af personer med ekstra kopier af X -kromosomet viser imidlertid, at der i celler med mere end to X -kromosomer stadig kun er et Xa, og alle de resterende X -kromosomer er inaktiveret. Dette indikerer, at standardtilstanden for X -kromosomet hos kvinder er inaktivering, men et X -kromosom er altid valgt for at forblive aktivt.
Det forstås, at inaktivering af X-kromosom er en tilfældig proces, der forekommer på cirka tidspunktet for gastrulering i epiblasten (celler, der vil give anledning til embryoet). Maternelle og faderlige X -kromosomer har lige stor sandsynlighed for inaktivering. Dette tyder på, at kvinder forventes at lide af X-bundne lidelser cirka 50% så ofte som mænd (fordi kvinder har to X-kromosomer, mens mænd kun har et); i virkeligheden er forekomsten af disse lidelser hos kvinder meget lavere end det. En forklaring på denne forskel er, at 12–20% af generne på det inaktiverede X-kromosom forbliver udtrykt, hvilket giver kvinder ekstra beskyttelse mod defekte gener kodet af X-kromosomet. Nogle antyder, at denne forskel skal være et bevis på præference (ikke-tilfældig) inaktivering. Fortrinsvis inaktivering af det faderlige X-kromosom forekommer i både pungdyr og i cellelinier, der danner membranerne omkring embryoet, hvorimod hos placentapattedyr enten det maternale eller det paternalt afledte X-kromosom kan inaktiveres i forskellige cellelinjer.
Tidsperioden for inaktivering af X-kromosom forklarer denne forskel. Inaktivering sker i epiblasten under gastrulation, hvilket giver anledning til embryoet. Inaktivering sker på mobilniveau, hvilket resulterer i et mosaikudtryk, hvor cellerne har et inaktivt moder-X-kromosom, mens andre patches har et inaktivt faderligt X-kromosom. For eksempel vil en kvindelig heterozygot for hæmofili (en X-bundet sygdom) få omkring halvdelen af hendes leverceller til at fungere korrekt, hvilket typisk er nok til at sikre normal blodprop. Chance kan resultere i betydeligt flere dysfunktionelle celler; sådanne statistiske ekstremer er imidlertid usandsynlige. Genetiske forskelle på kromosomet kan også gøre ét X-kromosom mere tilbøjelige til at undergå inaktivering. Hvis et X-kromosom også har en mutation, der forhindrer dets vækst eller gør det ikke levedygtigt, vil celler, der tilfældigt inaktiverede dette X, have en selektiv fordel i forhold til celler, der tilfældigt inaktiverede den normale allel. Selvom inaktivering i første omgang er tilfældig, vil celler, der inaktiverer en normal allel (efterlader den muterede allel aktiv) i sidste ende blive vokset og erstattet af funktionelt normale celler, hvor næsten alle har det samme X-kromosom aktiveret.
Det antages, at der er en autosomalt kodet 'blokeringsfaktor', der binder sig til X-kromosomet og forhindrer dets inaktivering. Modellen postulerer, at der er en begrænsende blokeringsfaktor, så når det tilgængelige blokeringsfaktormolekyle binder sig til et X -kromosom, er de resterende X -kromosom (er) ikke beskyttet mod inaktivering. Denne model understøttes af eksistensen af et enkelt Xa i celler med mange X -kromosomer og af eksistensen af to aktive X -kromosomer i cellelinjer med det dobbelte af det normale antal autosomer.
Sekvenser ved X -inaktiveringscentret ( XIC ), der er til stede på X -kromosomet, styrer dæmpningen af X -kromosomet. Den hypotetiske blokeringsfaktor forudsiges at binde til sekvenser inden for XIC.
Udtryk af X-bundne lidelser hos heterozygote hunner
Effekten af kvindelig X heterozygositet er tydelig i nogle lokaliserede træk, såsom det unikke pelsmønster hos en calico -kat. Det kan imidlertid være sværere at fuldt ud forstå udtrykket for ikke-lokaliserede træk hos disse hunner, såsom sygdomsudtryk.
Da hanner kun har en kopi af X-kromosomet, er alle udtrykte X-kromosomale gener (eller alleler , i tilfælde af flere variantformer for et givet gen i befolkningen) placeret på den kopi af kromosomet. Hunnerne vil imidlertid primært udtrykke de gener eller alleler, der er placeret på den X-kromosomale kopi, der forbliver aktiv. I betragtning af situationen for et gen eller flere gener, der forårsager individuelle forskelle i en bestemt fænotype (dvs. forårsager variation observeret i befolkningen for den fænotype), er det hos homozygote hunner ikke særlig vigtigt, hvilken kopi af kromosomet der er inaktiveret, da allelerne på begge eksemplarer er de samme. Hos hunner, der er heterozygote ved årsagsgenerne, kan inaktivering af den ene kopi af kromosomet frem for den anden have en direkte indvirkning på deres fænotypiske værdi. På grund af dette fænomen er der en observeret stigning i fænotypisk variation hos hunner, der er heterozygote ved det eller de involverede gener end hos hunner, der er homozygote ved det eller de gener. Der er mange forskellige måder, hvorpå den fænotypiske variation kan spille ud. I mange tilfælde kan heterozygote hunner være asymptomatiske eller kun vise mindre symptomer på en given lidelse, såsom med X-bundet adrenoleukodystrofi.
Differentieringen af fænotype hos heterozygote hunner fremmes af tilstedeværelsen af X-inaktiveringsskævhed. Typisk bliver hvert X-kromosom tavset i halvdelen af cellerne, men denne proces er skæv, når præferentiel inaktivering af et kromosom forekommer. Det menes, at skævheder sker enten ved en tilfældighed eller ved en fysisk egenskab ved et kromosom, der kan få det til at blive tavs mere eller mindre ofte, såsom en ugunstig mutation.
I gennemsnit inaktiveres hvert X-kromosom i halvdelen af cellerne, men 5-20% af "tilsyneladende normale" kvinder viser X-inaktivering skævhed. I tilfælde, hvor skævhed er til stede, kan der forekomme en bred vifte af symptomudtryk, hvilket resulterer i, at ekspression varierer fra mindre til svær afhængigt af forskydningsandelen. Et ekstremt tilfælde af dette blev set, hvor monozygotiske kvindelige tvillinger havde ekstrem variation i udtryk for Menkes sygdom (en X-forbundet lidelse), hvilket resulterede i en tvillings død, mens den anden forblev asymptomatisk.
Det menes, at X-inaktivering skævhed kan være forårsaget af problemer i mekanismen, der forårsager inaktivering, eller af problemer i selve kromosomet. Imidlertid er forbindelsen mellem fænotype og skævhed stadig i tvivl, og bør undersøges fra sag til sag. En undersøgelse, der så på både symptomatiske og asymptomatiske kvinder, der var heterozygote for Duchenne og Becker muskeldystrofier (DMD), fandt ingen tilsyneladende sammenhæng mellem transkriptionsekspression og skæv X-inaktivering. Undersøgelsen tyder på, at begge mekanismer er uafhængigt reguleret, og at der er andre ukendte faktorer, der spiller ind.
Kromosomkomponent
X-inaktiveringscentret (eller simpelthen XIC) på X-kromosomet er nødvendigt og tilstrækkeligt til at forårsage X-inaktivering. Kromosomale translokationer, der placerer XIC på et autosom, fører til inaktivering af autosomet, og X -kromosomer, der mangler XIC, inaktiveres ikke.
Den XIC indeholder fire ikke- oversatte RNA -gener, Xist , Tsix , JPX og FTX , som er involveret i X-inaktivering. XIC indeholder også bindingssteder for både kendte og ukendte regulatoriske proteiner .
Xist og Tsix RNA'er
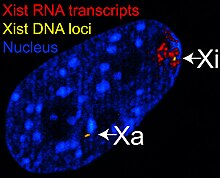
Det X-inaktive specifikke transkript ( Xist ) -gen koder for et stort ikke-kodende RNA, der er ansvarligt for at formidle den specifikke dæmpning af X-kromosomet, hvorfra det transkriberes. Det inaktive X -kromosom er belagt med Xist RNA, hvorimod Xa ikke er det (se figur til højre). X -kromosomer, der mangler Xist -genet, kan ikke inaktiveres. Kunstig placering og udtryk af Xist -genet på et andet kromosom fører til dæmpning af det kromosom.
Før inaktivering udtrykker begge X -kromosomer svagt Xist RNA fra Xist -genet. Under inaktiveringsprocessen ophører den fremtidige Xa med at udtrykke Xist, hvorimod den fremtidige Xi dramatisk øger Xist RNA -produktionen. På den fremtidige Xi dækker det xistiske RNA gradvist kromosomet og breder sig ud fra XIC; Xist RNA lokaliserer ikke til Xa. Den silencing af gener langs Xi forekommer hurtigt efter overtrækning af Xist RNA.
Ligesom Xist koder Tsix -genet for et stort RNA, der ikke menes at kode for et protein. Tsix RNA transkriberes antisense til Xist, hvilket betyder, at Tsix -genet overlapper Xist -genet og transkriberes på den modsatte streng af DNA fra Xist -genet. Tsix er en negativ regulator af Xist; X -kromosomer, der mangler Tsix -ekspression (og dermed har høje niveauer af Xist -transkription) inaktiveres meget oftere end normale kromosomer.
Ligesom Xist, før inaktivering, udtrykker begge X -kromosomer svagt Tsix RNA fra Tsix -genet. Ved begyndelsen af X-inaktivering ophører den fremtidige Xi med at udtrykke Tsix RNA (og øger Xist-ekspression), hvorimod Xa fortsætter med at udtrykke Tsix i flere dage.
Rep A er et langt ikke -kodende RNA, der fungerer med et andet langt ikke -kodende RNA, Xist, til X -inaktivering. Rep A hæmmer funktionen af Tsix, antisens fra Xist, i forbindelse med eliminering af ekspression af Xite. Det fremmer methylering af Tsix -regionen ved at tiltrække PRC2 og dermed inaktivere et af X -kromosomerne.
Lyddæmpning
Det inaktive X -kromosom udtrykker ikke størstedelen af dets gener, i modsætning til det aktive X -kromosom. Dette skyldes dæmpning af Xi ved undertrykkende heterochromatin , som komprimerer Xi -DNA'et og forhindrer ekspression af de fleste gener.
Sammenlignet med Xa har Xi høje niveauer af DNA-methylering , lave niveauer af histonacetylering , lave niveauer af histon H3- lysin-4- methylering og høje niveauer af histon-H3-lysin-9-methylering og H3-lysin-27-methyleringsmærke, som placeres af PRC2 -komplekset rekrutteret af Xist , som alle er forbundet med gendæmpning. PRC2 regulerer chromatin -komprimering og chromatin -ombygning i flere processer, herunder DNA -skaderesponsen. Derudover findes en histonvariant kaldet macroH2A ( H2AFY ) udelukkende på nukleosomer langs Xi.
Barr -kroppe
DNA pakket i heterochromatin, såsom Xi, er mere kondenseret end DNA pakket i euchromatin , såsom Xa. Det inaktive X danner et diskret legeme i kernen kaldet et Barr -legeme . Barr -kroppen er generelt placeret i kernens periferi , replikerer sent i cellecyklussen og indeholder, som den indeholder Xi, heterochromatin -modifikationer og Xist RNA.
Udtrykte gener på det inaktive X -kromosom
En brøkdel af generne langs X -kromosomet undslipper inaktivering på Xi. Xist -genet udtrykkes ved høje niveauer på Xi og udtrykkes ikke på Xa. Mange andre gener undslipper inaktivering; nogle udtrykkes ligeligt fra Xa og Xi, og andre, mens de udtrykkes fra begge kromosomer, udtrykkes stadig overvejende fra Xa. Op til en fjerdedel af generne på det menneskelige Xi er i stand til at flygte. Undersøgelser med musen tyder på, at i en given celletype undslipper 3% til 15% af generne inaktivering, og at det at slippe væk fra genidentiteten varierer mellem væv.
Mange af de gener, der slipper for inaktivering, er til stede langs områder af X -kromosomet, der i modsætning til størstedelen af X -kromosomet indeholder gener, der også er til stede på Y -kromosomet . Disse regioner betegnes pseudoautosomale regioner, da individer af begge køn vil modtage to kopier af hvert gen i disse regioner (som et autosom), i modsætning til de fleste gener langs kønskromosomerne. Da individer af begge køn vil modtage to kopier af hvert gen i en pseudoautosomal region , er der ikke behov for doseringskompensation for kvinder, så det postuleres, at disse DNA-områder har udviklet mekanismer til at undslippe X-inaktivering. Generne i pseudoautosomale regioner i Xi har ikke de typiske modifikationer af Xi og har lidt Xist RNA bundet.
Eksistensen af gener langs det inaktive X, som ikke er tavs, forklarer defekterne hos mennesker med unormale tal af X -kromosomet, såsom Turners syndrom (X0) eller Klinefelter syndrom (XXY). Teoretisk set bør X-inaktivering eliminere forskellene i gendosering mellem berørte individer og personer med et normalt kromosomkomplement. Hos berørte individer er X-inaktivering imidlertid ufuldstændig, og doseringen af disse ikke-tavse gener vil variere, når de undslipper X-inaktivering, svarende til en autosomal aneuploidi .
De præcise mekanismer, der styrer flugt fra X-inaktivering kendes ikke, men lydløse og flugtområder har vist sig at have tydelige kromatinmærker. Det er blevet foreslået, at flugt fra X-inaktivering kan medieres ved ekspression af langt ikke-kodende RNA (lncRNA) inden for de undslipende kromosomale domæner.
Anvendelser inden for eksperimentel biologi
Stanley Michael Gartler brugte inaktivering af X-kromosom for at demonstrere den klonale oprindelse af kræft. Undersøgelse af normale væv og tumorer fra hunners heterozygote for isoenzymer af det kønskoblede G6PD- gen viste, at tumorceller fra sådanne individer kun udtrykker én form for G6PD, hvorimod normale væv består af en næsten lige blanding af celler, der udtrykker de to forskellige fænotyper. Dette mønster antyder, at en enkelt celle og ikke en befolkning vokser til en kræftsygdom. Imidlertid er dette mønster bevist forkert for mange kræftformer, hvilket tyder på, at nogle kræftformer kan være polyklonale.
Desuden betragtes måling af methyleringsstatus (inaktivering) for den polymorfe humane androgenreceptor (HUMARA), der er placeret på X-kromosom, som den mest nøjagtige metode til vurdering af klonalitet i kvindelige kræftbiopsier. En lang række tumorer blev testet ved denne metode, nogle, såsom nyrecellekarcinom, blev fundet monoklonale, mens andre (f.eks. Mesotheliom) blev rapporteret polyklonale.
Forskere har også undersøgt ved hjælp af inaktivering af X-kromosom til at dæmpe aktiviteten af autosomale kromosomer. For eksempel Jiang et al. indsat en kopi af Xist -genet i en kopi af kromosom 21 i stamceller afledt af et individ med trisomi 21 ( Downs syndrom ). Det indsatte Xist-gen inducerer Barr-kropsdannelse, udløser stabile heterochromatin-modifikationer og dæmper de fleste gener på den ekstra kopi af kromosom 21. I disse modificerede stamceller ser den Xist-medierede gen-lyddæmpning ud til at vende nogle af de defekter, der er forbundet med Down syndrom.
Historie
I 1959 viste Susumu Ohno , at pattedyrs to X -kromosomer var forskellige: det ene lignede autosomerne ; den anden var kondenseret og heterokromatisk. Dette fund antydede, uafhængigt af to grupper af efterforskere, at et af X -kromosomerne blev inaktiveret.
I 1961, Mary Lyon foreslog tilfældig inaktivering af en kvindelig X-kromosom for at forklare den plettede fænotype af hunmus heterozygote for pelsfarvegener gener . Lyon -hypotesen stod også for fundene om, at en kopi af X -kromosomet i hunceller var stærkt kondenseret, og at mus med kun en kopi af X -kromosomet udviklede sig som ufrugtbare hunner. Dette foreslog for Ernest Beutler at studere heterozygote hunner for glucose-6-phosphat dehydrogenase (G6PD) -mangel, at der var to røde blodlegemer af erytrocytter i sådanne heterozygoter: mangelfulde celler og normale celler, afhængigt af om det inaktiverede X-kromosom (i kerne i den røde celles forløbercelle) indeholder den normale eller defekte G6PD -allel.
Se også
- Kønbestemmelsessystem
- Doseringskompensation
- Barr krop
- Heterochromatin
- Epigenetik
- Skæv X-inaktivering
- Udviklingsforstyrrelser, der menes at være relateret til X-inaktivering:
Referencer
Yderligere læsning
- Huynh KD, Lee JT (maj 2005). "X-kromosominaktivering: en hypotese, der forbinder ontogeni og fylogeni". Naturanmeldelser. Genetik . 6 (5): 410–8. doi : 10.1038/nrg1604 . PMID 15818384 . S2CID 19245310 .
- Goto T, Monk M (juni 1998). "Regulering af X-kromosominaktivering i udvikling hos mus og mennesker" (gennemgangsartikel) . Mikrobiologi og molekylærbiologi anmeldelser . 62 (2): 362–78. doi : 10.1128/MMBR.62.2.362-378.1998 . PMC 98919 . PMID 9618446 .
- Lyon MF (december 2003). "Lyon og LINE -hypotesen". Seminarer i celle- og udviklingsbiologi (gennemgangsartikel). 14 (6): 313–8. doi : 10.1016/j.semcdb.2003.09.015 . PMID 15015738 .
- Ng K, Pullirsch D, Leeb M, Wutz A (januar 2007). "Xist og rækkefølgen af lyddæmpning" (gennemgangsartikel) . EMBO -rapporter . 8 (1): 34–9. doi : 10.1038/sj.embor.7400871 . PMC 1796754 . PMID 17203100 .
- Cerase A, Pintacuda G, Tattermusch A, Avner P (august 2015). "Xist lokalisering og funktion: ny indsigt fra flere niveauer" . Genombiologi . 16 : 166. doi : 10.1186/s13059-015-0733-y . PMC 4539689 . PMID 26282267 .
eksterne links
-
 Medier relateret til inaktivering af X -kromosom på Wikimedia Commons
Medier relateret til inaktivering af X -kromosom på Wikimedia Commons - Kruszelnicki K (2004-02-11). "Hybrid Auto-Immune Women 3" . ABC Science .

