Affinitetskromatografi - Affinity chromatography
Affinitetskromatografi er en metode til adskillelse af et biomolekyle fra en blanding baseret på en meget specifik makromolekylær bindingsinteraktion mellem biomolekylet og et andet stof. Den specifikke type bindingsinteraktion afhænger af biomolekylet af interesse; antigen og antistof , enzym og substrat , receptor og ligand eller interaktioner mellem protein og nukleinsyre udnyttes ofte til isolering af forskellige biomolekyler. Affinitetskromatografi er nyttig for sin høje selektivitet og opløsning af separation, sammenlignet med andre kromatografiske metoder.
Princip
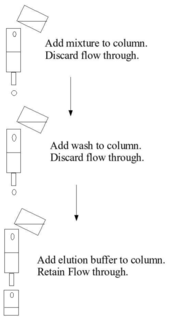
Affinitetskromatografi drager fordel af specifikke bindingsinteraktioner mellem analytten af interesse (normalt opløst i mobilfasen ) og en bindingspartner eller ligand (immobiliseret på den stationære fase ). I et typisk affinitetskromatografiforsøg er liganden knyttet til en fast, uopløselig matrix-sædvanligvis en polymer såsom agarose eller polyacrylamid- kemisk modificeret til at indføre reaktive funktionelle grupper, hvormed liganden kan reagere, og danne stabile kovalente bindinger. Den stationære fase indlæses først i en søjle, hvortil mobilfasen introduceres. Molekyler, der binder til liganden, forbliver forbundet med den stationære fase. En vaskebuffer påføres derefter for at fjerne ikke-målbiomolekyler ved at forstyrre deres svagere interaktioner med den stationære fase, mens biomolekylerne af interesse forbliver bundet. Målbiomolekyler kan derefter fjernes ved at anvende en såkaldt elueringsbuffer, som forstyrrer interaktioner mellem de bundne målbiomolekyler og liganden. Målmolekylet udvindes således i elueringsopløsningen.
Affinitetskromatografi kræver ikke molekylvægt, ladning, hydrofobicitet eller andre fysiske egenskaber af analytten af interesse for at være kendt, selvom kendskab til dens bindingsegenskaber er nyttig ved udformningen af en separationsprotokol. Typer bindingsinteraktioner, der almindeligvis udnyttes i affinitetskromatografiprocedurer, er opsummeret i nedenstående tabel.
| Sr. nr | Typer af ligand | Målmolekyle |
|---|---|---|
| 1 | Substrat analog | Enzymer |
| 2 | Antistof | Antigen |
| 3 | Lectin | Polysaccharid |
| 4 | Nukleinsyre | Komplementær basesekvens |
| 5 | Hormon | Receptor |
| 6 | Avidin | Biotin/Biotin-konjugeret molekyle |
| 7 | Calmodulin | Calmodulin bindingspartner |
| 8 | Glutathion | GST -fusionsprotein |
| 9 | Proteiner A og G | Immunoglobuliner |
| 10 | Metalioner | Poly-histidin fusionsprotein |
Batch- og kolonneopsætninger
Binding til den faste fase kan opnås ved søjlekromatografi, hvorved det faste medium pakkes på en søjle, den indledende blanding løber gennem søjlen for at tillade bundfældning, en vaskebuffer køres gennem søjlen og elueringsbufferen påføres derefter kolonnen og opsamles . Disse trin udføres normalt ved omgivelsestryk. Alternativt kan binding opnås ved anvendelse af en batchbehandling, f.eks. Ved at tilsætte den indledende blanding til den faste fase i en beholder, blande, adskille den faste fase, fjerne den flydende fase, vaske, re-centrifugering, tilføje elueringsbufferen, re-centrifugering og fjernelse af elueringen.
Nogle gange anvendes en hybridmetode således, at bindingen udføres ved batchmetoden, men den faste fase med målmolekylet bundet pakkes på en søjle, og vask og eluering udføres på søjlen.
De ligander, der anvendes i affinitetskromatografi, fås fra både organiske og uorganiske kilder. Eksempler på biologiske kilder er serumproteiner, lektiner og antistoffer. Uorganiske kilder som moroniske handlinger, metalchelater og triazinfarvestoffer.
En tredje metode, ekspanderet bedabsorption, som kombinerer fordelene ved de to ovennævnte metoder, er også blevet udviklet. Fastfasepartiklerne placeres i en søjle, hvor flydende fase pumpes ind fra bunden og forlader i toppen. Partiklernes tyngdekraft sikrer, at den faste fase ikke forlader søjlen med den flydende fase.
Affinitetskolonner kan elueres ved at ændre saltkoncentrationer, pH, pI, ladning og ionstyrke direkte eller gennem en gradient for at løse partiklerne af interesse.
For nylig er opsætninger, der beskæftiger mere end en kolonne i serier, blevet udviklet. Fordelen i forhold til enkeltkolonneopsætninger er, at harpiksmaterialet kan fyldes fuldt ud, da ikke-bindende produkt direkte sendes videre til en på hinanden følgende søjle med frisk søjlemateriale. Disse kromatografiske processer er kendt som periodisk modstrømskromatografi (PCC). Harpiksomkostningerne pr. Mængde produceret produkt kan således reduceres drastisk. Da en kolonne altid kan elueres og regenereres, mens den anden kolonne er indlæst, er allerede to kolonner tilstrækkelige til at udnytte fordelene fuldt ud. Yderligere søjler kan give ekstra fleksibilitet til eluerings- og regenereringstider på bekostning af ekstra udstyr og harpiksomkostninger.
Specifikke anvendelser
Affinitetskromatografi kan anvendes i en række applikationer, herunder rensning af nukleinsyre, proteinrensning fra cellefrie ekstrakter og oprensning fra blod.
Ved at bruge affinitetskromatografi kan man adskille proteiner, der binder til et bestemt fragment fra proteiner, der ikke binder det specifikke fragment. Fordi denne rensningsteknik er afhængig af de nødvendige proteiners biologiske egenskaber, er det en nyttig teknik, og proteiner kan renses mange folder i et trin.
Forskellige affinitetsmedier
Der findes mange forskellige affinitetsmedier til en række forskellige anvendelser. Kort fortalt er de (generaliserede) aktiverede/funktionaliserede, der fungerer som et funktionelt afstandsstykke, understøtter matrix og eliminerer håndtering af giftige reagenser.
Aminosyremedier bruges med en række serumproteiner, proteiner, peptider og enzymer samt rRNA og dsDNA. Avidin biotin medier bruges i oprensningsprocessen af biotin/avidin og deres derivater.
Kulhydratbinding bruges oftest sammen med glycoproteiner eller andre kulhydratholdige stoffer; kulhydrat bruges sammen med lektiner, glycoproteiner eller ethvert andet kulhydratmetabolitprotein. Farveligandmedier er uspecifikke, men efterligner biologiske substrater og proteiner. Glutathion er nyttig til adskillelse af GST -mærkede rekombinante proteiner. Heparin er en generaliseret affinitetsligand, og den er mest nyttig til adskillelse af plasmakoagulationsproteiner sammen med nukleinsyreenzymer og lipaser
Hydrofobe interaktionsmedier bruges mest til at målrette mod frie carboxylgrupper og proteiner.
Immunaffinitetsmedier (detaljeret nedenfor) anvender antigeners og antistoffers høje specificitet til at adskille; immobiliseret metalaffinitetskromatografi er detaljeret nærmere nedenfor og anvender interaktioner mellem metalioner og proteiner (normalt specielt mærket) til at adskille; nukleotid/coenzym, der virker til at adskille dehydrogenaser, kinaser og transaminaser.
Nukleinsyrer fungerer til at fange mRNA, DNA, rRNA og andre nukleinsyrer/oligonukleotider. Protein A/G -metode bruges til at rense immunglobuliner.
Specialmedier er designet til en bestemt klasse eller type protein/co -enzym; denne type medier fungerer kun for at adskille et specifikt protein eller coenzym.
Immunaffinitet
En anden anvendelse til proceduren er affinitetsrensning af antistoffer fra blodserum. Hvis serumet vides at indeholde antistoffer mod et specifikt antigen (f.eks. Hvis serummet kommer fra en organisme immuniseret mod det pågældende antigen), kan det bruges til affinitetsrensning af det antigen. Dette er også kendt som immunoaffinitetskromatografi. For eksempel ,, hvis en organisme er immuniseret mod et GST-fusionsprotein, vil det producere antistoffer mod fusionsproteinet og muligvis også antistoffer mod GST-mærket. Proteinet kan derefter kovalent kobles til en fast bærer, såsom agarose og anvendes som en affinitetsligand ved oprensning af antistof fra immunserum.
For grundighed kan GST-proteinet og GST-fusionsproteinet hver især kobles separat. Serumet får i første omgang lov til at binde til GST -affinitetsmatrixen. Dette vil fjerne antistoffer mod GST -delen af fusionsproteinet. Serumet separeres derefter fra den faste bærer og får lov til at binde til GST-fusionsproteinmatrixen. Dette gør det muligt for alle antistoffer, der genkender antigenet, at blive fanget på den faste bærer. Eluering af antistofferne af interesse opnås oftest ved anvendelse af en buffer med lav pH , såsom glycin, pH 2,8. Eluatet opsamles i en neutral tris- eller phosphatbuffer for at neutralisere elueringsbufferen med lavt pH og standse enhver nedbrydning af antistofets aktivitet. Dette er et godt eksempel, da affinitetsoprensning bruges til at rense det første GST-fusionsprotein, til at fjerne de uønskede anti-GST-antistoffer fra serumet og til at rense målantistoffet.
Monoklonale antistoffer kan også vælges til at binde proteiner med stor specificitet, hvor protein frigives under forholdsvis skånsomme forhold. Dette kan blive brugt til yderligere forskning i fremtiden.
En forenklet strategi anvendes ofte til at oprense antistoffer frembragt mod peptid- antigener . Når peptidantigenerne fremstilles syntetisk, tilsættes en terminal cysteinrest ved enten N- eller C-terminalen af peptidet. Denne cysteinrest indeholder en funktionel sulfhydrylgruppe , som gør det muligt let at konjugere peptidet til et bærerprotein (f.eks. Keyhole limpet hemocyanin (KLH)). Det samme cysteinholdige peptid immobiliseres også på en agaroseharpiks gennem cysteinresten og bruges derefter til at rense antistoffet.
De fleste monoklonale antistoffer er blevet renset ved hjælp af affinitetskromatografi baseret på immunoglobulin -specifikt protein A eller protein G , afledt af bakterier.
Immunaffinitetskromatografi med monoklonale antistoffer immobiliseret på monolitisk søjle er med succes blevet anvendt til at fange ekstracellulære vesikler (f.eks. Exosomer og eksomerer) fra humant blodplasma ved at målrette tetraspaniner og integriner fundet på EV'ernes overflade.
Immunoaffinitetskromatografi er også grundlaget for immunokromatografiske teststrimler (IKT), som giver et hurtigt diagnosemiddel i patientplejen. Ved hjælp af IKT kan en tekniker foretage en beslutning ved en patients seng uden behov for et laboratorium. IKT -detektion er meget specifik for mikroben, der forårsager en infektion.
Immobiliseret metalionaffinitetskromatografi
Immobiliseret metalionaffinitetskromatografi (IMAC) er baseret på den specifikke koordinat kovalente binding af aminosyrer, især histidin, til metaller. Denne teknik virker ved at tillade proteiner med en affinitet for metalioner at blive tilbageholdt i en søjle indeholdende immobiliserede metalioner, såsom kobolt, nikkel eller kobber til oprensning af histidinholdige proteiner eller peptider, jern, zink eller gallium til oprensning af phosphorylerede proteiner eller peptider. Mange naturligt forekommende proteiner har ikke en affinitet for metalioner, derfor kan rekombinant DNA -teknologi bruges til at indføre et sådant proteintag i det relevante gen. Metoder, der bruges til at eluere proteinet af interesse, inkluderer ændring af pH eller tilføjelse af et konkurrencedygtigt molekyle, såsom imidazol .
Rekombinante proteiner
Den mest almindelige anvendelse af affinitetskromatografi er muligvis til oprensning af rekombinante proteiner. Proteiner med en kendt affinitet mærkes med protein for at hjælpe med deres oprensning. Proteinet kan være blevet genetisk modificeret for at tillade det at blive valgt for affinitetsbinding; dette er kendt som et fusionsprotein. Mærkerne omfatter hexahistidin ( His ), glutathion -S -transferase (GST) og maltosebindende protein (MBP). Histidin tags har en affinitet for nikkel , kobolt , zink , kobber og jern -ioner, som er blevet immobiliseret ved at danne kovalente koordinationsbindinger med en chelator inkorporeret i den stationære fase. Til eluering anvendes en overskydende mængde af en forbindelse, der er i stand til at fungere som en metalionligand, såsom imidazol . GST har en affinitet for glutathion, som er kommercielt tilgængelig immobiliseret som glutathionagarose. Under eluering bruges overskydende glutathion til at fortrænge det mærkede protein.
Lektiner
Lektinaffinitetskromatografi er en form for affinitetskromatografi, hvor lektiner bruges til at adskille komponenter i prøven. Lectiner, såsom concanavalin A, er proteiner, der kan binde specifikke alfa-D-mannose og alfa-D-glucose kulhydratmolekyler. Nogle almindelige kulhydratmolekyler, der bruges til lektinaffinitetskromatografi, er Con A-Sepharose og WGA-agarose. Et andet eksempel på et lektin er hvedekimagglutinin, der binder DN-acetyl-glucosamin. Den mest almindelige anvendelse er at adskille glycoproteiner fra ikke-glycosylerede proteiner eller en glycoform fra en anden glycoform. Selvom der er forskellige måder at udføre lektinaffinitetskromatografi på, er målet at udtrække en sukkerligand af det ønskede protein.
Specialitet
En anden anvendelse til affinitetskromatografi er oprensning af specifikke proteiner ved anvendelse af en gelmatrix, der er unik for et specifikt protein. For eksempel opnås oprensning af E. coli β-galactosidase ved affinitetskromatografi under anvendelse af p-aminobenyl-1-thio-β-D-galactopyranosyl agarose som affinitetsmatrix. p-aminobenyl-1-thio-β-D-galactopyranosyl agarose bruges som affinitetsmatrix, fordi den indeholder en galactopyranosylgruppe, der fungerer som en god substratanalog for E.Coli-B-Galactosidase. Denne egenskab gør det muligt for enzymet at binde til affinitetsmatrixens stationære fase og elueres ved tilsætning af stigende koncentrationer af salt til søjlen.
Alkalisk fosfatase
Alkalisk phosphatase fra E. coli kan oprenses ved anvendelse af en DEAE-cellulosematrix. A. phosphatase har en svag negativ ladning, hvilket gør det muligt at svagt binde til de positivt ladede amingrupper i matrixen. Enzymet kan derefter elueres ved tilsætning af buffer med højere saltkoncentrationer.
Boronat affinitetskromatografi
Boronataffinitetskromatografi består i at anvende borsyre eller boronater til at eluere og kvantificere mængder glycoproteiner . Kliniske tilpasninger har anvendt denne type kromatografi til brug ved bestemmelse af langsigtet vurdering af diabetespatienter gennem analyse af deres glycerede hæmoglobin .
Serumalbuminoprensning
Af mange anvendelser af affinitetskromatografi ses en anvendelse af den ved affinitetsrensning af albumin- og makroglobulinforurening. Denne type oprensning er nyttig til at fjerne overskydende albumin og α 2 -macroglobulin -forurening, når der udføres massespektrometri. Ved affinitetsoprensning af serumalbumin kan det stationære, der bruges til opsamling eller tiltrækning af serumproteiner, være Cibacron Blue-Sepharose. Derefter kan serumproteinerne elueres fra adsorbenten med en buffer indeholdende thiocyanat (SCN - ).
Svag affinitetskromatografi
Svag affinitetskromatografi (WAC) er en affinitetskromatografiteknik til affinitetsscreening i lægemiddeludvikling. WAC er en affinitetsbaseret væskekromatografisk teknik, der adskiller kemiske forbindelser baseret på deres forskellige svage affiniteter til et immobiliseret mål. Jo højere affinitet en forbindelse har til målet, jo længere bliver den tilbage i adskillelsesenheden, og dette vil blive udtrykt som en længere opbevaringstid. Affinitetsmål og rangering af affinitet kan opnås ved at behandle de opnåede retentionstider for analyserede forbindelser.
WAC -teknologien demonstreres mod en række forskellige proteinmål - proteaser , kinaser , chaperoner og protein -protein -interaktion (PPI) -mål. WAC har vist sig at være mere effektiv end etablerede metoder til fragmentbaseret screening.
Historie
Affinitetskromatografi blev udtænkt og først udviklet af Pedro Cuatrecasas og Meir Wilchek .
Referencer
eksterne links
"Affinitetskromatografiprincip, procedure og forhåndsdetaljeret note - 2020".
|
Bibliotekets ressourcer om affinitetskromatografi |