Kalorimetri - Calorimetry
Kalorimetri er videnskaben eller handlingen med at måle ændringer i tilstandsvariabler i et legeme med det formål at udlede varmeoverførslen forbundet med ændringer i dets tilstand på grund af for eksempel kemiske reaktioner , fysiske ændringer eller faseovergange under specificerede begrænsninger. Kalorimetri udføres med et kalorimeter . Ordet kalorimetri er afledt af det latinske ord kalor , der betyder varme og det græske ord μέτρον (metron), der betyder mål. Skotsk læge og videnskabsmand Joseph Black , som var den første til at erkende forskellen mellem varme og temperatur , siges at være grundlæggeren af videnskaben om kalorimetri.
Indirekte kalorimetri beregner varme, som levende organismer producerer ved enten at måle deres produktion af kuldioxid og kvælstofaffald (ofte ammoniak i vandorganismer eller urinstof i terrestriske) eller ud fra deres iltforbrug . Lavoisier bemærkede i 1780, at varmeproduktion kan forudsiges ud fra iltforbrug på denne måde ved hjælp af multipel regression . Den dynamiske energi budget teori forklarer, hvorfor denne procedure er korrekt. Varme genereret af levende organismer kan også måles ved direkte kalorimetri , hvor hele organismen placeres inden i kalorimeteret til målingen.
Et meget brugt moderne instrument er det differentielle scanningskalorimeter , en enhed, der gør det muligt at opnå termiske data på små mængder materiale. Det indebærer opvarmning af prøven med en kontrolleret hastighed og registrering af varmestrømmen enten i eller fra prøven.
Klassisk kalorimetrisk beregning af varme
Tilfælde med differentierbar tilstandsligning for et organ med en komponent
Grundlæggende klassisk beregning med hensyn til volumen
Kalorimetri kræver, at et referencemateriale, der ændrer temperatur, har kendte bestemte termiske konstituerende egenskaber. Den klassiske regel, anerkendt af Clausius og Kelvin , er, at det tryk, der udøves af det kalorimetriske materiale, bestemmes fuldt ud og hurtigt udelukkende af dets temperatur og volumen; denne regel er for ændringer, der ikke involverer faseændring, såsom smeltning af is. Der er mange materialer, der ikke overholder denne regel, og for dem giver den nuværende formel for klassisk kalorimetri ikke en tilstrækkelig redegørelse. Her antages den klassiske regel at gælde for det kalorimetriske materiale, der bruges, og propositionerne er matematisk skrevet:
Den termiske reaktion af det kalorimetriske materiale beskrives fuldt ud ved dets tryk som værdien af dets konstituerende funktion af netop volumen og temperatur . Alle trin skal her være meget små. Denne beregning henviser til et domæne for volumen og temperatur i kroppen, hvor der ikke sker faseændring, og der er kun en fase til stede. En vigtig antagelse her er kontinuitet i ejendomsforhold. En anden analyse er nødvendig for faseændring
Når en lille stigning i varme opnås af en kalorimetrisk krop med små intervaller af dens volumen og dens temperatur, gives den stigning i varmen , der opnås af kroppen af kalorimetrisk materiale, af
hvor
- betegner den latente varme med hensyn til volumen af det kalorimetriske materiale ved konstant kontrolleret temperatur . Omgivelsernes tryk på materialet justeres instrumentalt til at påtvinge en valgt volumenændring med indledende volumen . For at bestemme denne latente varme er volumenændringen effektivt den uafhængigt instrumentalt varierede mængde. Denne latente varme er ikke en af de meget anvendte, men er af teoretisk eller konceptuel interesse.
- angiver varmekapaciteten for det kalorimetriske materiale ved fast konstant volumen , mens materialets tryk tillades at variere frit med den indledende temperatur . Temperaturen tvinges til at ændre sig ved eksponering for et passende varmebad. Det er almindeligt at skrive simpelthen som , eller endnu mere kort som . Denne latente varme er en af de to meget anvendte.
Den latente varme i forhold til volumen er den varme, der kræves for enhedsforøgelse i volumen ved konstant temperatur. Det kan siges at være 'målt langs en isoterm', og det tryk, materialet udøver, får lov til at variere frit i henhold til dens konstituerende lov . For et givet materiale kan det have et positivt eller negativt tegn eller undtagelsesvis kan det være nul, og dette kan afhænge af temperaturen, som det gør for vand omkring 4 C. Begrebet latent varme med hensyn til volumen blev måske først anerkendt af Joseph Black i 1762. Udtrykket 'latent ekspansionsvarme' bruges også. Den latente varme med hensyn til volumen kan også kaldes 'latent energi med hensyn til volumen'. For alle disse anvendelser af 'latent varme' bruger en mere systematisk terminologi 'latent varmekapacitet'.
Varmekapaciteten ved konstant volumen er den varme, der kræves for enhedens temperaturforøgelse ved konstant volumen. Det kan siges at være 'målt langs en isochor', og igen tillades det tryk, materialet udøver, at variere frit. Det har altid et positivt tegn. Dette betyder, at for at øge temperaturen i et legeme uden at ændre dets volumen, skal der tilføres varme til det. Dette er i overensstemmelse med fælles erfaring.
Mængder som kaldes undertiden 'kurvedifferentialer', fordi de måles langs kurver i overfladen.
Klassisk teori for kalorimetri med konstant volumen (isokorisk)
Kalorimetri med konstant volumen er kalorimetri udført med et konstant volumen . Dette indebærer brug af et kalorimeter med konstant volumen . Varme måles stadig ved hjælp af ovennævnte princip om kalorimetri.
Dette betyder, at i en passende konstrueret kalorimeter, kaldet en bombe kalorimeter, kan volumenforøgelsen bringes til at forsvinde . Til kalorimetri med konstant volumen:
hvor
- angiver stigningen i temperatur og
- angiver varmekapaciteten ved konstant volumen.
Klassisk varmeberegning med hensyn til tryk
Fra ovenstående regel for beregning af varme med hensyn til volumen følger der en med hensyn til tryk.
I en proces med små trin, dets tryk og dets temperatur, gives den stigning af varme , der opnås af kroppen af kalorimetrisk materiale, af
hvor
- betegner den latente varme med hensyn til tryk for det kalorimetriske materiale ved konstant temperatur, mens legemets volumen og tryk får lov til at variere frit ved tryk og temperatur ;
- angiver varmekapaciteten for det kalorimetriske materiale ved konstant tryk, mens kroppens temperatur og volumen får lov til at variere frit ved tryk og temperatur . Det er almindeligt at skrive simpelthen som , eller endnu mere kort som .
De nye mængder her er relateret til de foregående:
hvor
- betegner den delvise derivat af med hensyn til evalueret for
og
- betegner den delvise derivat af med hensyn til evalueret for .
De latente varmer og er altid med det modsatte tegn.
Det er almindeligt at henvise til forholdet mellem specifikke varmer som
- ofte bare skrevet som .
Kalorimetri gennem faseændring, tilstandsligning viser et spring diskontinuitet
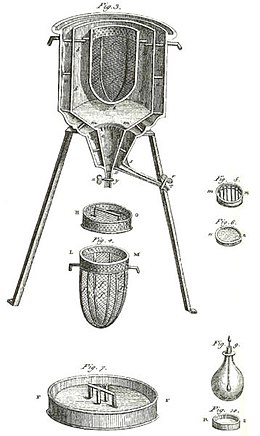
Et tidligt kalorimeter var det, der blev brugt af Laplace og Lavoisier , som vist i figuren ovenfor. Det fungerede ved konstant temperatur og ved atmosfærisk tryk. Den involverede latente varme var derefter ikke en latent varme med hensyn til volumen eller med hensyn til tryk, som i ovenstående redegørelse for kalorimetri uden faseændring. Den latente varme involveret i dette kalorimeter var med hensyn til faseændring, naturligt forekommende ved konstant temperatur. Denne slags kalorimeter arbejdet ved måling af vandmasse produceret ved smeltning af is, hvilket er en faseændring .
Kumulation af opvarmning
For en tidsafhængig opvarmningsproces af det kalorimetriske materiale, defineret ved en kontinuerlig fælles progression af og , startende på tidspunktet og slutter på tidspunktet , kan der beregnes en akkumuleret mængde leveret varme . Denne beregning udføres ved matematisk integration langs progressionen med hensyn til tid. Dette skyldes, at varmeintervaller er 'additive'; men det betyder ikke, at varme er en konservativ mængde. Ideen om, at varme var en konservativ mængde, blev opfundet af Lavoisier og kaldes ' kaloriteorien '; i midten af det nittende århundrede blev det anerkendt som fejlagtigt. Skrevet med symbolet er mængden slet ikke begrænset til at være en stigning med meget små værdier; dette står i kontrast til .
Man kan skrive
- .
Dette udtryk bruger størrelser som defineret i nedenstående afsnit med overskriften 'Matematiske aspekter af ovenstående regler'.
Matematiske aspekter af ovenstående regler
Anvendelsen af 'meget små' mængder, som f.eks. Er relateret til det fysiske behov for, at mængden 'hurtigt bestemmes' af og ; sådan en 'hurtig bestemmelse' henviser til en fysisk proces. Disse 'meget små' mængder bruges i Leibniz- tilgangen til den uendelige calculus . Den Newton tilgang bruger i stedet ' fluxions ' såsom , hvilket gør det mere klart, at skal være 'hurtigt bestemmes'.
Med hensyn til fluxions kan ovenstående første beregningsregel skrives
hvor
- angiver tiden
- angiver tidsraten for opvarmning af det kalorimetriske materiale på tidspunktet
- angiver tidsraten for ændring af volumen af det kalorimetriske materiale på tidspunktet
- angiver tidshastigheden for temperaturændring af det kalorimetriske materiale.
Inkrementet og fluxionen opnås i et bestemt tidsrum, der bestemmer værdierne for mængderne på højre side af ovenstående regler. Men dette er ikke en grund til at forvente, at der skulle eksistere en matematisk funktion . Af denne grund siges stigningen at være en 'ufuldkommen forskel' eller en ' unøjagtig forskel '. Nogle bøger angiver dette ved at skrive i stedet for . Notationen đQ bruges også i nogle bøger. Uforsigtighed omkring dette kan føre til fejl.
Mængden er korrekt siges at være en funktionel af den kontinuerte fælles progression af og , men, i den matematiske definition af en funktion , er ikke en funktion af . Selvom fluxionen er defineret her som en funktion af tiden , er symbolerne og henholdsvis stående alene ikke defineret her.
Fysisk rækkevidde af ovenstående regler for kalorimetri
Ovenstående regler refererer kun til egnede kalorimetriske materialer. Udtrykkene "hurtigt" og "meget lille" kræver empirisk fysisk kontrol af gyldighedsdomænet for ovenstående regler.
Ovenstående regler for beregning af varme hører til ren kalorimetri. De henviser ikke til termodynamik og blev for det meste forstået før termodynamikken kom. De er grundlaget for det 'termo' bidrag til termodynamikken. Bidraget til 'dynamik' er baseret på idéen om arbejde , som ikke bruges i ovenstående beregningsregler.
Eksperimentelt bekvemt målte koefficienter
Empirisk er det praktisk at måle egenskaber for kalorimetriske materialer under eksperimentelt kontrollerede forhold.
Trykstigning ved konstant volumen
Til målinger ved eksperimentelt styret volumen kan man bruge den antagelse, der er anført ovenfor, at legemets tryk af kalorimetrisk materiale er kan udtrykkes som en funktion af dets volumen og temperatur.
Til måling ved konstant eksperimentelt kontrolleret volumen defineres den isokoriske koefficient for trykstigning med temperaturen ved
- .
Ekspansion ved konstant tryk
Til målinger ved eksperimentelt styret tryk antages det, at volumenet af kalorimetrisk materiale kan udtrykkes som en funktion af dets temperatur og tryk . Denne antagelse er relateret til, men er ikke den samme, som den ovennævnte antagelse om, at legemets tryk af kalorimetrisk materiale er kendt som en funktion af dets volumen og temperatur; unormal opførsel af materialer kan påvirke dette forhold.
Den mængde, der hensigtsmæssigt måles ved konstant eksperimentelt styret tryk, isobar volumenudvidelseskoefficienten, defineres med
- .
Kompressibilitet ved konstant temperatur
Til målinger ved eksperimentelt kontrolleret temperatur antages det igen, at volumenet af kroppen af kalorimetrisk materiale kan udtrykkes som en funktion af dets temperatur og tryk med de samme forbehold som nævnt lige ovenfor.
Den mængde, der hensigtsmæssigt måles ved konstant eksperimentelt kontrolleret temperatur, den isotermiske kompressibilitet, defineres ved
- .
Forholdet mellem klassiske kalorimetriske størrelser
Forudsat at reglen er kendt, kan man udlede funktionen af den, der anvendes ovenfor i den klassiske varmeberegning med hensyn til tryk. Denne funktion kan findes eksperimentelt ud fra koefficienterne og gennem det matematisk deducerbare forhold
- .
Forbindelse mellem kalorimetri og termodynamik
Termodynamik udviklede sig gradvist i første halvdel af det nittende århundrede og bygger på ovennævnte teori om kalorimetri, som var blevet udarbejdet før den, og på andre opdagelser. Ifølge Gislason og Craig (2005): "De fleste termodynamiske data kommer fra kalorimetri ..." Ifølge Kondepudi (2008): "Kalorimetri bruges i vid udstrækning i nutidens laboratorier."
Med hensyn til termodynamik kan den indre energi af det kalorimetriske materiale betragtes som værdien af en funktion af , med partielle derivater og .
Derefter kan det vises, at man kan skrive en termodynamisk version af de ovennævnte kalorimetriske regler:
med
og
- .
Igen, yderligere ud fra termodynamik, den indre energi af det kalorimetriske materiale kan undertiden, afhængigt af det kalorimetriske materiale, betragtes som værdien af en funktion af , med partielle afledede og , og med kan udtrykkes som værdien af en funktion af , med delvise derivater og .
Derefter kan det ifølge Adkins (1975) vises, at man kan skrive en yderligere termodynamisk version af ovenstående kalorimetriske regler:
med
og
- .
Ud over den kalorimetriske kendsgerning, der er nævnt ovenfor, at den latente opvarmning og altid er med det modsatte tegn, kan det vises ved hjælp af det termodynamiske koncept for arbejde, at også
Særlig interesse for termodynamik i kalorimetri: de isotermiske segmenter af en Carnot-cyklus
Kalorimetri har en særlig fordel for termodynamik. Den fortæller om varmen, der absorberes eller udsendes i det isotermiske segment af en Carnot-cyklus .
En Carnot-cyklus er en speciel form for cyklisk proces, der påvirker en krop sammensat af materiale, der er egnet til brug i en varmemotor. Et sådant materiale er af den art, der betragtes i kalorimetri, som nævnt ovenfor, der udøver et tryk, der meget hurtigt bestemmes bare af temperatur og volumen. En sådan krop siges at ændre sig reversibelt. En Carnot-cyklus består af fire på hinanden følgende faser eller segmenter:
(1) en ændring i volumen fra et volumen til et volumen ved konstant temperatur for at medføre en strøm af varme ind i kroppen (kendt som en isoterm ændring)
(2) en ændring i volumen fra til et volumen ved en variabel temperatur, således at der ikke påføres nogen varmestrøm (kendt som en adiabatisk ændring)
(3) en anden isotermisk ændring i volumen fra til et volumen ved konstant temperatur, således at der pådrages en strøm eller varme ud af kroppen og netop sådan, at man nøjagtigt forbereder sig på den følgende ændring
(4) en anden adiabatisk ændring af volumen fra ryggen til netop sådan, at kroppen vender tilbage til sin starttemperatur .
I isotermisk segment (1) gives varmen, der strømmer ind i kroppen
og i isotermisk segment (3) gives varmen, der strømmer ud af kroppen
- .
Fordi segmenterne (2) og (4) er adiabats, strømmer ingen varme ind i eller ud af kroppen under dem, og derfor er nettovarmen, der tilføres kroppen under cyklussen, givet af
- .
Denne mængde bruges af termodynamik og er på en særlig måde relateret til det nettoarbejde , der udføres af kroppen under Carnot-cyklussen. Nettoændringen af kroppens indre energi under Carnot-cyklussen, er lig med nul, fordi materialet i det arbejdende legeme har de specielle egenskaber, der er anført ovenfor.
Særlig interesse for kalorimetri i termodynamik: forholdet mellem klassiske kalorimetriske størrelser
Forholdet mellem latent varme i forhold til volumen og tilstandsligningen
Mængden , den latente varme i forhold til volumen, hører til klassisk kalorimetri. Det tegner sig for forekomsten af energioverførsel ved arbejde i en proces, hvor varme også overføres; mængden blev dog taget i betragtning, før forholdet mellem varme og arbejdsoverførsler blev afklaret ved opfindelsen af termodynamik. I lyset af termodynamikken afsløres den klassiske kalorimetriske størrelse som tæt knyttet til det kalorimetriske materiales tilstandsligning . Forudsat at temperaturen måles i den termodynamiske absolutte skala, udtrykkes forholdet i formlen
- .
Forskel på specifikke varmer
Avanceret termodynamik giver forholdet
- .
Ud fra dette fører yderligere matematisk og termodynamisk ræsonnement til en anden sammenhæng mellem klassiske kalorimetriske størrelser. Forskellen i specifikke opvarmninger er givet ved
- .
Praktisk kalorimetri med konstant volumen (bombe kalorimetri) til termodynamiske undersøgelser
Kalorimetri med konstant volumen er kalorimetri udført med et konstant volumen . Dette indebærer brug af et kalorimeter med konstant volumen .
Intet arbejde udføres i kalorimetri med konstant volumen, så den målte varme svarer til ændringen i systemets interne energi. Varmekapaciteten ved konstant volumen antages at være uafhængig af temperaturen.
Varme måles efter kalorimetriprincippet.
hvor
- Δ U er ændring i intern energi ,
- Δ T er ændring i temperatur og
- C V er varmekapaciteten ved konstant volumen.
I konstant volumen kalorimetri det tryk ikke holdes konstant. Hvis der er en trykforskel mellem indledende og afsluttende stater, at varmen målte justering behov tilvejebringe den enthalpi ændring . Man har derefter
hvor
- Δ H er ændring i entalpi og
- V er det uændrede volumen af prøvekammeret.
Se også
- Isoterm mikrokalorimetri (IMC)
- Isotermisk titreringskalorimetri
- Sorptionskalorimetri
- Reaktionskalorimeter
Referencer
Bøger
- Adkins, CJ (1975). Equilibrium Thermodynamics , anden udgave, McGraw-Hill, London, ISBN 0-07-084057-1 .
- Bailyn, M. (1994). En undersøgelse af termodynamik , American Institute of Physics, New York, ISBN 0-88318-797-3 .
- Bryan, GH (1907). Termodynamik. En indledende afhandling, der hovedsagelig vedrører de første principper og deres direkte anvendelser , BG Tuebner, Leipzig.
- Callen, HB (1960/1985). Termodynamik og en introduktion til termostatistik , anden udgave, Wiley, New York, ISBN 981-253-185-8 .
- Crawford, FH (1963). Varme, termodynamik og statistisk fysik , Rupert Hart-Davis, London, Harcourt, Brace og World.
- Guggenheim, EA (1949/1967). Termodynamik. En avanceret behandling for kemikere og fysikere , Nordholland, Amsterdam.
- Iribarne, JV, Godson, WL (1973/1981), Atmospheric Thermodynamics , anden udgave, D. Reidel, Kluwer Academic Publishers, Dordrecht, ISBN 90-277-1296-4 .
- Kondepudi, D. (2008). Introduktion til moderne termodynamik , Wiley, Chichester, ISBN 978-0-470-01598-8 .
- Landsberg, PT (1978). Termodynamik og statistisk mekanik , Oxford University Press, Oxford, ISBN 0-19-851142-6 .
- Lewis, GN, Randall, M. (1923/1961). Termodynamik , anden udgave revideret af KS Pitzer, L. Brewer, McGraw-Hill, New York.
- Maxwell, JC (1872). Theory of Heat , tredje udgave, Longmans, Green og Co., London.
- Partington, JR (1949). En avanceret afhandling om fysisk kemi , bind 1, grundlæggende principper. Egenskaberne for gasser , Longmans, Green og Co., London.
- Planck, M. (1923/1926). Afhandling om termodynamik , tredje engelske udgave oversat af A. Ogg fra den syvende tyske udgave, Longmans, Green & Co., London.
- Truesdell, C., Bharatha, S. (1977). Begreberne og logikken i klassisk termodynamik som en teori om varmemotorer, strengt konstrueret på fundamentet lagt af S. Carnot og F. Reech , Springer, New York, ISBN 0-387-07971-8 .































































![\ delta Q \ = \ venstre [p (V, T) \, + \, \ venstre. \ frac {\ delvis U} {\ delvis V} \ højre | _ {(V, T)} \ højre] \, \ delta V \, + \, \ left. \ frac {\ partial U} {\ partial T} \ right | _ {(V, T)} \, \ delta T](https://wikimedia.org/api/rest_v1/media/math/render/svg/f84955a4832939c4d1337fcfadae0affc3a945bc)








![\ delta Q \ = \ venstre [\ venstre. \ frac {\ partial U} {\ partial p} \ right | _ {(p, T)} \, + \, p \ left. \ frac {\ partial V} {\ partial p} \ right | _ {( p, T)} \ højre] \ delta p \, + \, \ venstre [\ venstre. \ frac {\ delvis U} {\ delvis T} \ højre | _ {(p, T)} \, + \, p \ venstre. \ frac {\ delvis V} {\ delvis T} \ højre | _ {(p, T)} \ højre] \ delta T](https://wikimedia.org/api/rest_v1/media/math/render/svg/c80e88197ed385fd3debc25941f418cec98cd244)















![C_p (p, T) -C_V (V, T) = \ left [p (V, T) \, + \, \ left. \ Frac {\ partial U} {\ partial V} \ right | _ {(V , T)} \ højre] \, \ venstre. \ Frac {\ delvis V} {\ delvis T} \ højre | _ {(p, T)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e5046f626f9dccc1569d9c418d77d6cd6c0a06b)


