Åndedrætsudbrud - Respiratory burst
Åndedrætsudbrud (eller oxidativt burst ) er hurtig frigivelse af den reaktive iltart (ROS), superoxidanion ( O-
2) og hydrogenperoxid ( H
2O
2), fra forskellige celletyper .
Dette bruges normalt til immunologisk forsvar hos pattedyr , men spiller også en rolle i cellesignalering . Åndedrætsudbrud er også impliceret i dyrenes æg efter befrugtning . Det kan også forekomme i planteceller .
Immunitet
Immunceller kan opdeles i myeloide celler og lymfoide celler . Myeloide celler, herunder makrofager og neutrofiler , er især impliceret i åndedrætsudbruddet. De er fagocytiske , og åndedrætsudbruddet er afgørende for den efterfølgende nedbrydning af internaliserede bakterier eller andre patogener . Dette er et vigtigt aspekt af den medfødte immunitet .
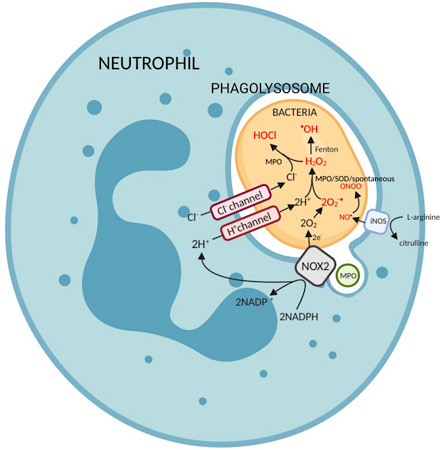
Åndedrætsudbrud kræver en 10 til 20 gange stigning i iltforbruget gennem NADPH oxidase ( NOX2 hos mennesker) aktivitet. NADPH er nøglen substrat af NOX2, og bærer reduktionsevne . Glykogennedbrydning er afgørende for at producere NADPH. Dette sker via pentosefosfatvejen .
NOX2 -enzymet er bundet i phagolysosom -membranen. Efter bakteriel fagocytose aktiveres den og producerer superoxid via sit redoxcenter , som overfører elektroner fra cytosolisk NADPH til O 2 i fagosomet.
2O 2 + NADPH -> 2O 2 • - + NADP + + H +
Superoxidet kan derefter spontant eller enzymatisk reagere med andre molekyler for at give anledning til andet ROS. Den fagocytiske membran lukker igen for at begrænse eksponeringen af det ekstracellulære miljø for de genererede reaktive frie radikaler .
Stier til reaktiv artgenerering
Der er 3 hovedveje til frembringelse af reaktive iltarter eller reaktive nitrogentyper (RNS) i effektorceller :
-
Superoxiddismutase (eller alternativt myeloperoxidase ) genererer hydrogenperoxid fra superoxid. Hydroxylradikaler genereres derefter via Haber-Weiss-reaktionen eller Fenton-reaktionen , hvoraf begge katalyseres af Fe 2+ .
O 2 • - + H 2 O 2 -> • OH + OH - + O 2
- I nærvær af halogenidioner , fremtrædende chloridioner, bruger myeloperoxidase hydrogenperoxid til at producere hypochlorsyre .
H 2 O 2 + Cl - -> ClO - + H 2 O
-
Nitrogenoxidsyntase (den inducerbare isoform, iNOS, i immunitet) katalyserer produktionen af nitrogenoxid fra L-arginin .2L-arginin + 3NADPH + 3 H + + 4O 2 -> 2 citrullin + 2NO • + 4H 2 O + 3NADP +
Nitrogenoxid kan reagere med superoxid -anioner for at producere peroxynitrit -anion.
Forsvar mod patogener
Eksponeringen for disse reaktive arter i åndedrætsudbruddet resulterer i patologi. Dette skyldes oxidativ skade på de opslugte bakterier.
Især peroxynitrit er en meget stærk oxidationsmiddel , der kan føre til lipidperoxidation , proteinoxidation, protein nitrering , som er ansvarlige for dets baktericide virkninger. Det kan reagere direkte med proteiner, der indeholder overgangsmetalcentre, såsom FeS , og frigive Fe 2+ til Fenton -reaktionen. Peroxynitrit kan også reagere med forskellige aminosyrer i peptidkæden og derved ændre proteinstruktur og efterfølgende proteinfunktion. Det oxiderer oftest cystein og kan indirekte inducere tyrosinnitrering gennem andet genereret RNS. Ændret proteinfunktion inkluderer ændringer i enzymkatalytisk aktivitet, cytoskeletal organisation og cellesignaltransduktion.
Hypochlorsyre reagerer med en række biomolekyler, herunder DNA, lipider og proteiner. HClO kan oxidere cystein og methioniner via deres sulfhydrylgrupper og svovlgrupper. Førstnævnte fører til dannelsen af disulfidbindinger , der inducerer proteintværbinding. Begge oxidationer resulterer i proteinaggregation og i sidste ende celledød. Sulfhydrylgrupper kan oxideres op til tre gange af tre HClO -molekyler og danner sulfensyrer, sulfinsyrer og R – SO 3 H , som i stigende grad er irreversible og bakteriedræbende. I mellemtiden er methioninoxidation reversibel. HOCl kan også reagere med primære eller sekundære aminer og producere chloroaminer, der er giftige for bakterier. Proteintværbinding og -aggregering kan også forekomme samt afbrydelse af FeS -grupper.
Integreret i hypochlorsyredannelse er myeloperoxidase. Myeloperoxidase er mest udbredt i neutrofiler, hvor fagocytose ledsages af degranulering . Dette er sammensmeltning af granulater med fagolysosomet, der frigiver deres indhold, herunder myeloperoxidase. Da mange mikrobicidprodukter dannes under åndedrætsudbrud, forstås ikke betydningen af individuelle molekyler ved at dræbe invaderende patogener fuldstændigt.
På grund af den høje toksicitet af genererede antimikrobielle produkter, herunder ROS, har neutrofiler en kort levetid for at begrænse værtsvævsskader under betændelse .
Sygdom
Kronisk granulomatøs sygdom er en arvelig sygdom hos humane neutrofiler , hvor NOX2 er defekt. Fagocytose kan stadig forekomme, men uden korrekt fungerende NOX2 er der ingen superoxidproduktion og derfor ingen åndedrætsudbrud. Den bakterielle infektion er ikke ryddet.
Cellulær signalering
Ikke-fagocytiske celler
I ikke-fagocytiske celler anvendes oxidative burst-produkter i intracellulære signalveje. Den genererede ROS opnår dette ved at flytte cellens redox -tilstand. Dette kan overvåges ved forholdet mellem antioxidantenzymet glutathion og dets oxiderede produkt, glutathion -disulfid (GSH: GSSG). Antioxidant enzymer modvirker redox -signalering ved at eliminere de involverede molekyler, især superoxid -anion og nitrogenoxid. Redox -signalering er kritisk for normale processer såsom proliferation, differentiering samt vaskulær funktion og neurotransmission. Det er også involveret i sygdomstilstande som kræft .
NADPH -oxidase isoform NOX1 producerer forbigående et burst af superoxid som reaktion på vækstfaktor (f.eks. EGF ) stimulering af respektive receptorer. Superoxid opløses til hydrogenperoxid med en hastighed tæt på den diffusionsbegrænsede hastighed. Denne rumlige begrænsning for superoxids dismutation muliggør specificitet af redox -signalering. Specificitet sikres også ved lokalisering af NOX1 i specifikke mikrodomæner i cellens plasmamembran. Gennem kanaler såsom aquaporin eller diffusion kommer hydrogenperoxid ind i cytosolen. Der oxiderer det cysteingrupperne af redoxfølsomme proteiner, som derefter kan transducere signaler.
Makrofager
Oxidativ burst i fagocytter er oftest forbundet med bakteriedrab. Imidlertid producerer makrofager, især alveolære makrofager , normalt langt lavere niveauer af ROS end neutrofiler og kan kræve aktivering for deres bakteriedræbende egenskaber. I stedet regulerer deres forbigående oxidative burst det inflammatoriske respons ved at inducere cytokinsyntese til redox -signalering, hvilket resulterer i en tilstrømning af neutrofiler og aktiverede makrofager.
Kræftceller
Kræftceller kan manipulere cellesignalering ved at producere overskydende niveauer af ROS og derved konstitutivt aktivere veje for at fremme deres cellulære vækst og spredning. Implicerede veje omfatter NF- κB , PI3K , HIF'er og MAPK'er . Hos mennesker er mitokondrielt ROS påkrævet sammen med dem, der frigives i det oxidative burst for mitogen vejstimulering i onkogene KRAS -celler. I onkogene Kras -musfibroblaster har NADPH -oxidasehæmmere imidlertid vist sig at være tilstrækkelige til at blokere disse vækstfaktorveje. Tumorigene celler opretholder samtidig høje niveauer af antioxidanter for at beskytte mod kræftcelledød.
Befrugtning
Især kan man se oxidativ burst efter befrugtning i søpindsvinægget . Dette menes at være evolutionært afvigende fra neutrofiler.
Hydrogenperoxid dannes ved ægoxidase -aktivitet efter en stigning i iltforbruget. Dette er afgørende for tværbindingen af ægproteinerne for at forhindre dødelig polyspermi . Hydrogenperoxid i sig selv er også sæddræbende. Imidlertid opretholdes de genererede reaktive arter på lavere niveauer end i immunitet for at beskytte selve det befrugtede æg mod oxidativ skade. Dette opnås ved eliminering af hydrogenperoxid primært gennem den dobbelte funktion af den samme ægoxidase og sekundært gennem cytoplasmatiske ROS -scavengers, såsom katalase og glutathion .
I planter
Oxidativ burst fungerer som en forsvarsmekanisme for patogen infektion i planter. Dette ses efter PAMPs- detektion ved hjælp af celleoverflade-lokaliserede receptorer (f.eks. FLS2 eller EFR ). Som hos dyr medieres produktionen af reaktive iltarter i planter af NADPH -oxidase . I plante immunitet , NADPH oxidase subunits RbohD og RbohF har overlappende funktioner udtrykkes i forskellige væv og på forskellige niveauer. I modsætning til dyre fagocytter, hvor genereret ROS er indeholdt i det forseglede fagolysosom, er oxidativ burst i planter imidlertid ikke indeholdt. Følgelig bærer genereret ROS yderligere effekter sammen med patogen toksicitet. Hydrogenperoxid inducerer oxidativ tværbinding af plantens cellevægsglykoproteiner. Dette reducerer modtagelighed for enzymatisk nedbrydning af patogener. Systemisk erhvervet resistens , der er analog med medfødt immunitet hos dyr, induceres også i de udsatte planteceller. Hydrogenperoxideksponering kan også resultere i overfølsom reaktion , hvilket er død af et lille antal værtsceller på infektionsstedet med det formål at begrænse patogen infektion. ROS produktion i planter, kan anvendes som en udlæsning for vellykket patogen genkendelse via en luminol - peroxidase baseret assay.
Referencer
eksterne links
- Respiratorisk+burst ved US National Library of Medicine Medical Subject Headings (MeSH)