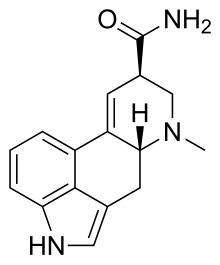
Ergine - Ergine
 | |
 | |
| Kliniske data | |
|---|---|
| Andre navne | LSA; d-Lyserginsyreamid; d-Lysergamid; Ergine; LA-111 |
| Graviditet kategori |
|
| Ruter for administration |
Oral , intramuskulær injektion |
| ATC -kode | |
| Lovlig status | |
| Lovlig status | |
| Farmakokinetiske data | |
| Metabolisme | Hepatisk |
| Udskillelse | Renal |
| Identifikatorer | |
| |
| CAS -nummer | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| ChEBI | |
| CHEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard |
100.006.841 |
| Kemiske og fysiske data | |
| Formel | C 16 H 17 N 3 O |
| Molar masse | 267,322 g · mol −1 |
| 3D -model ( JSmol ) | |
| Smeltepunkt | 135 ° C (275 ° F) nedbrydes |
| |
| |
| (verificere) | |
Ergine , også kendt som d-lysergsyre amid ( LSA ) og d-lysergamide , er en ergolin alkaloid som forårsager psykedeliske hallucinationer ligner LSD og forekommer i forskellige arter af vinstokke af Convolvulaceae og nogle arter af svampe . De psykedeliske egenskaber i frø af ololiuhqui , Hawaii Baby Woodrose og morgen herligheder har været knyttet til ergine og / eller isoergine, dens epimer , da det er den dominerende alkaloid til stede i frøene.
Forekomst i naturen
Ergine er fundet i høje koncentrationer på 20 μg/g tørvægt i det søvnige græs inficeret med en Acremonium endophytic svamp sammen med andre ergotalkaloider.
Ergine er en del af de alkaloider, der er indeholdt i meldrøje svamp, der vokser på hovedet af inficerede rug græsser.
Det findes også i frøene fra flere varianter af morgenherligheder i koncentrationer på cirka 10 μg pr. Frø samt hawaiiske baby -woodrose -frø i en koncentration på omkring 0,13% af tørvægten.
Historie
Ololiuhqui blev brugt af sydamerikanske healere i shamanske helbredelsesceremonier. På samme måde blev indtagelse af morgenfrøfrø af Mazatec -stammer til "kommunisere med deres guder" rapporteret af Richard Schultes i 1941 og praktiseres stadig i dag.
Yderligere rapporter om brugen af ergine blev lavet af Don Thomes MacDougall. Han rapporterede, at frøene fra Ipomoea violacea blev brugt som sakramenter af visse zapotecer , nogle gange i forbindelse med frøene af Rivea corymbosa , en anden art, der har en lignende kemisk sammensætning, med lysergol i stedet for ergometrin .
Ergine blev analyseret for menneskelig aktivitet af Albert Hofmann i selvforsøg i 1947, længe før det var kendt at være en naturlig forbindelse. Intramuskulær administration af en dosis på 500 mikrogram førte til en træt, drømmende tilstand med manglende evne til at bevare klare tanker. Efter en kort periode med søvn var virkningerne væk, og normal baseline blev genoprettet inden for fem timer.
I 1956 forskede Central Intelligence Agency om erginets psykedeliske egenskaber i frøene af Rivea corymbosa , som delprojekt 22 af MKULTRA .
I 1959 var Hofmann den første til at isolere kemisk ren ergin fra frøene fra Turbina corymbosa og fastslog, at den og andre alkaloider virkede som de vigtigste aktive komponenter i frøene. 20 år før isoleringen blev ergin først kemisk defineret af engelske kemikere S. Smith og GM Timmis som spaltningsprodukt af ergotalkaloider. Derudover isolerede Guarin og Youngkin angiveligt det rå alkaloid i 1964 fra morning glory frø.
Indtagelse
Ligesom andre psykedelika anses ergine ikke for at være vanedannende. Derudover er der ingen kendte dødsfald , der er direkte forbundet med farmakologiske virkninger af erginforbrug. Alle tilhørende dødsfald skyldes indirekte årsager, såsom selvskade , nedsat dømmekraft og negative lægemiddelinteraktioner . En kendt sag drejede et selvmord , der blev rapporteret i 1964 efter indtagelse af Morning Glory frø . Et andet eksempel er et dødsfald på grund af faldet fra en bygning efter indtagelse af hawaiianske baby -woodrose -frø og alkohol .
Fysiologiske virkninger
Selvom dets fysiologiske virkninger varierer fra person til person, er følgende symptomer blevet tilskrevet forbruget af ergine eller ergine, der indeholder frø:
- Sedation
- Milde visuelle og auditive hallucinationer
- Eufori
- Tab af motorstyring
- Kvalme
- Vasokonstriktion
- Elevudvidelse
- Vrangforestilling
- Angst
- Paranoia
- Uregelmæssig hjerterytme
- Seksuel ophidselse
- takykardi
- mydriasis
- hypertoni
- luftvejsforstyrrelser
- kramper
En undersøgelse viste, at 2 ud af 4 mennesker oplevede kardiovaskulær dysregulering, og undersøgelsen måtte standses og konkluderede, at stoffet er farligere end almindeligt antaget. Den samme undersøgelse observerede også, at reaktionerne var meget forskellige i type og intensitet mellem forskellige emner. En anden undersøgelse af mus fandt ud af, at stoffet havde afrodisiakum, hvilket fremkaldte øget seksuel adfærd.
En undersøgelse gav mus 3000 mg/kg (svarende til at give en person på 100 kg en dosis på 300 gram [10,5 ounces]) uden dødelige virkninger.
Psykedelisk komponent
Ergine menes at være en serotonerg psykedelisk, og dens psykedeliske virkninger menes at skyldes, at det er en delvis agonist for 5-HT 2A- receptoren . Selvom årsagen til, hvorfor dette kan være hallucinogent, stadig er undvigende.
Ideen om, at ergine er den vigtigste psykedeliske komponent i ergineholdige frø (morning glory, hawaiisk baby woodrose) er veldebatteret, da virkningerne af isoleret syntetisk ergin kun rapporteres at være mildt psykedelisk. Den samlede psykedeliske oplevelse efter indtagelse af sådanne frø er således foreslået at skyldes en blanding af ergolinalkaloider.
Farmakologi
Farmakodynamik
| Receptor | Affinitet (K i [nM]) | |
|---|---|---|
| LSA | LSD | |
| 5-HT 1A | 10 | 2.5 |
| 5-HT 2 | 28 | 0,87 |
| D 1 | 832 | 87 |
| D 2L | 891 | 155 |
| D 2S | 145 | 25 |
| D 3 | 437 | 65 |
| D 4.4 | 141 | 30 |
| α 1 | 912 | 60 |
| α 2 | 62 | 1.0 |
| Bemærkninger: 5-HT 1A og D 1 er til svinreceptorer. | ||
Ergine interagerer med serotonin , dopamin og adrenerge receptorer på samme måde som men med lavere affinitet end lyserginsyre -diethylamid (LSD). De psykedeliske virkninger af ergin kan tilskrives aktivering af serotonin 5-HT 2A- receptorer .
Kemi
Biosyntese
Den biosyntetiske vej til ergine starter som de fleste andre ergolinalkaloid- med dannelsen af ergolin-stilladset. Denne syntese starter med prenylering af L-tryptophan på en SN1-måde med dimethylallyldiphosphat (DMAPP) som prenyldonor og katalyseres af prenyltransferase 4-dimethylallyltryptophansyntase (DMATS) til dannelse af 4-L-dimethylallyltryptophan (4-L-DMAT) . DMAPP stammer fra mevalonsyre . En tre strep mekanisme foreslås at danne 4-L-DMAT: dannelsen af en allylisk carbokation , en nukleofilt angreb på indol -kernen til kationen, efterfulgt af deprotonering at genoprette aromaticitet og til at frembringe 4-L-DMAT. 4-Dimethylallyltyptophan N -methyltransferase (EASF) katalyserer N -methylering af 4-L-DMAT ved amino af tryptophan rygrad under anvendelse S-adenosyl methionin (SAM) som methyl kilde til dannelse 4-dimethylallyl-L-abrine (4-DMA-L-abrine). Omdannelsen af 4-DMA-L-abrine til chanoclavin-I menes at ske ved en decarboxylering og to oxidationstrin, katalyseret af den FAD-afhængige oxidoreduktase , EasE og katalasen , EasC. Chanoclavin-mellemproduktet oxideres derefter til chanoclavin-l-aldehyd, katalyseret af kortkædede dehydrogenase/reduktase (SDR), EasD.
Herfra afviger biosyntesen, og de dannede produkter er plante- og svampespecifikke. Biosyntesen af ergin i C laviceps purpurea vil blive eksemplificeret, hvor agroclavin produceres efter dannelsen af chanoclavin-l-aldehyd, katalyseret af EasA gennem en keto-enol tautomerisering for at lette rotation omkring CC-bindingen, efterfulgt af tautomerisering tilbage til aldehyd og kondens med den proksimale sekundære amin til dannelse af en iminiumart, som efterfølgende reduceres til tertiær amin og giver argoclavin. Cytochrom P450 monooxygenaser (CYP 450 ) menes derefter at katalysere dannelsen af elymoclavin fra argoclavin via en 2 elektronoxidation. Dette omdannes yderligere til paspalsyre via en 4 elektronoxidation, katalyseret af cloA , en CYP 450 monooxygenase. Paspalsyre undergår derefter isomerisering af CC-dobbeltbindingen i konjugering med syren til dannelse af D-lyserginsyre . Selv om detaljerne ved dannelsen af ergin fra D-lyserginsyre ikke kendes, foreslås det at forekomme gennem en nonribosomal peptidsyntase (NRPS) med to enzymer, der primært involverer: D-lysergylpeptidsyntase (LPS) 1 og 2.
Lovlig status
Lovligheden af at indtage, dyrke og besidde ergine varierer afhængigt af landet.
Der er ingen love mod besiddelse af erginholdige frø i USA. Men besiddelse af den rene forbindelse uden recept eller DEA -licens ville blive retsforfulgt, da ergine under navnet "lyserginsyreamid" er opført under skema III i lov om kontrollerede stoffer . Tilsvarende betragtes ergine som et klasse A -stof i Det Forenede Kongerige, kategoriseret som en forløber for LSD .
I de fleste australske stater er forbrug af ergineholdige materialer forbudt i henhold til statslovgivning.
I Canada er ergine ikke ulovligt at besidde, da det ikke er opført under Canadas lov om kontrollerede stoffer og stoffer , selvom det sandsynligvis er ulovligt at sælge til konsum.
I New Zealand er ergine et kontrolleret lægemiddel, men planter og frø fra morning glory -arterne er lovlige at besidde, dyrke, købe og distribuere.
Se også
- Liste over entheogene/hallucinogene arter
- Liste over psykoaktive planter
- Tlitliltzin ( Ipomoea violacea )
Noter
- Powell, William (2002). Den anarkistiske kogebog . Ozark Press. s. s. 44 . ISBN 978-0-8488-1130-3.
- Smith, Sydney; Timmis, Geoffrey M. (1932). "98. Ergots alkaloider. Del III. Ergine, en ny base opnået ved nedbrydning af ergotoksin og ergotinin". J. Chem. Soc. 1932 : 763–766. doi : 10.1039/JR9320000763 .
- Juszczak, Grzegorz R .; Swiergiel, Artur H. (2013-01-01). "Fritidsbrug af D-lysergamid fra frøene fra Argyreia nervosa, Ipomoea tricolor, Ipomoea violacea og Ipomoea purpurea i Polen". Journal of Psychoactive Drugs . 45 (1): 79–93. doi : 10.1080/02791072.2013.763570 . ISSN 0279-1072 . PMID 23662334 . S2CID 22086799 .
- Burillo-Putze, G .; López Briz, E .; Climent Díaz, B .; Munné Mas, P .; Nogue Xarau, S .; Pinillos, MA; Hoffman, RS (2013-09-01). "[Emergent drugs (III): hallucinogene planter og svampe]" . Anales del Sistema Sanitario de Navarra . 36 (3): 505–518. doi : 10.4321/s1137-66272013000300015 . ISSN 1137-6627 . PMID 24406363 .



