Organisk kobberforbindelse - Organocopper compound
Organokobberforbindelser i organometallisk kemi indeholder kemiske bindinger mellem kulstof og kobber . Organokopper-kemi er videnskaben om organokopperforbindelser, der beskriver deres fysiske egenskaber, syntese og reaktioner. De er reagenser inden for organisk kemi .
Den første organokobber forbindelse, den eksplosive kobber (I) acetylid Cu 2 C 2 (Cu-C = C-Cu), blev syntetiseret ved Rudolf Christian Böttger i 1859 ved at lede acetylen gas gennem kobber (I) chlorid opløsning:
- C 2 H 2 + 2 CuCl → Cu 2 C 2 + 2 HCI
Struktur og limning
Organiske kobberforbindelser har forskellig struktur og reaktivitet, men organiske kobberforbindelser er stort set begrænset i oxidationstilstande til kobber (I), undertiden betegnet Cu + . Som metalcenter ad 10 er det relateret til Ni (0), men på grund af dets højere oxidationstilstand engagerer det sig i mindre pi-backbonding. Organiske derivater af Cu (II) og Cu (III) påberåbes som mellemprodukter, men sjældent isoleret eller endog observeret. Med hensyn til geometri vedtager kobber (I) symmetriske strukturer i overensstemmelse med sin sfæriske elektroniske skal. Typisk vedtages en af tre koordineringsgeometrier: lineær 2-koordinat, trigonal 3-koordinat og tetrahedral 4-koordinat. Organokobberforbindelser danne komplekser med en række bløde ligander, såsom alkylphosphiner (R 3 P), thioethere (R 2 S) og cyanid (CN - ).
Enkle komplekser med CO-, alken- og Cp-ligander
Kobbersalte (I) har længe været kendt for at binde CO, omend svagt. Et repræsentativt kompleks er CuCl (CO), som er polymert. I modsætning til klassiske metalcarbonyler er pi-backbonding ikke stærk i disse forbindelser.

Alkener binder til kobber (I), men igen generelt svagt. Binding af ethylen til Cu i proteiner har så stor betydning i plantebiologi, at ethylen klassificeres som et plantehormon . Dens tilstedeværelse, detekteret af Cu-proteinet, påvirker modning og mange andre udviklinger.
Selvom kobber ikke danner et metallocen , kan der produceres halv sandwich-komplekser. Et sådant derivat er (η-cyclopentadienyltriethylphosphin) kobber.
Alkyl- og aryl-kobberforbindelser
Alkyl og aryl kobber (I) forbindelser
Kobberhalogenider reagerer med organolithiumreagenser for at give organiske kobberforbindelser . Området var banebrydende af Henry Gilman , der rapporterede methylcopper i 1936. Således fremstilles phenylcopper ved reaktion af phenyllithium med kobber (I) bromid i diethylether . Grignard-reagenser kan anvendes i stedet for organolithiumforbindelser. Gilman undersøgte også dialkylcuprates. Disse opnås ved at kombinere to ækvivalenter RLi med Cu (I) -salte. Alternativt fremstilles disse cuprater ud fra oligomere neutrale organiske kobberforbindelser ved behandling med en ækvivalent organolithiumreagens.
Forbindelser af typen [CUR n ] ( n -1) - er reaktiv over oxygen og vand, danner kobber (I) oxid . De har også en tendens til at være termisk ustabile, hvilket kan være nyttigt i visse koblingsreaktioner. På trods af eller på grund af disse vanskeligheder genereres organokopperreagenser ofte og forbruges in situ uden forsøg på at isolere dem. De anvendes i organisk syntese som alkyleringsreagenser, fordi de udviser større funktionel gruppetolerance end tilsvarende Grignard- og organolithiumreagenser. Den elektronegativitet af kobber er langt større end dens nabo i gruppe 12 elementer , zink , hvilket tyder på formindsket nukleofilicitet for sit CO ligander.
Kobbersalte reagerer med terminale alkyner til dannelse af acetyliderne .
Alkylhalogenider reagerer med organokopperforbindelser med inversion af konfiguration. På den anden side fortsætter reaktioner af organisk kobberforbindelse med alkenylhalogenider med tilbageholdelse af subtratets konfiguration.
Organokopperforbindelser parres med arylhalogenider:
Strukturer
Alkyl- og aryl-kobberkomplekser aggregerer både i krystallinsk form og i opløsning. Aggregering er især tydeligt for ladningsneutrale organokopperforbindelser, dvs. arter med den empiriske formel (RCu), som vedtager cykliske strukturer. Da hvert kobbercenter kræver mindst to ligander, er den organiske gruppe en broligand . Denne effekt er illustreret ved strukturen af mesitylcopper, som er en pentamer. En cyklisk struktur ses også for Cuch 2 SiMe 3 , først 1: 1 organokobber forbindelse, der skal analyseres ved røntgen krystallografi (1972 af Lappert). Denne forbindelse er relativt stabil, fordi de voluminøse trimethylsilylgrupper tilvejebringer sterisk beskyttelse. Det er en tetramer , der danner en 8-leddet ring med alternerende Cu-C-bindinger. Derudover danner de fire kobberatomer en plan Cu 4- ring baseret på tre-center to-elektronbindinger . Kobber til kobber bindingslængde er 242 pm sammenlignet med 256 pm i kobber i bulk. I pentamesitylpentacopper dannes en 5-leddet kobberring svarende til (2,4,6-trimethylphenyl) guld, og pentafluorphenylcopper er en tetramer.
Lithiumdimethylcuprat er en dimer i diethylether , der danner en 8-leddet ring med to lithiumatomer, der forbinder to methylgrupper. Tilsvarende danner lithiumdiphenylcuprat et dimeretherether, [{Li (OEt 2 )} (CuPh 2 )] 2 , i fast tilstand.
Alkyl- og aryl-kobber (III) forbindelser
Involveringen af den ellers sjældne Cu (III) oxidationstilstand er blevet demonstreret i konjugattilsætningen af Gilman-reagenset til en enone : I et såkaldt NMR- eksperiment med hurtig injektion ved -100 ° C blev Gilman-reagenset Me 2 CuLi ( stabiliseret med lithiumiodid ) blev introduceret til cyclohexenon ( 1 ), der muliggør påvisning af kobber-alken- pi-kompleks 2 . Ved efterfølgende tilsætning af trimethylsilylcyanid dannes Cu (III) -arten 3 (ubestemt stabil ved denne temperatur), og ved forøgelse af temperaturen til -80 ° C konjugatadditionsproduktet 4 . Ifølge en ledsagende in silico eksperimenter Cu (III) mellemprodukt har en firkantet plan molekylær geometri med cyano gruppe i cis orientering i forhold til cyclohexenyl methin gruppe og anti-parallelt med methinproton. Med andre ligander end cyanogruppen forudsiger denne undersøgelse stabile Cu (III) forbindelser ved stuetemperatur .
Reaktioner af organokuprater
Tværkoblingsreaktioner
Forud for udviklingen af palladium -katalyseret krydskoblingsreaktioner , kobber var den foretrukne katalysator i næsten et århundrede. Palladium giver en hurtigere, mere selektiv reaktion. I de senere år er kobber imidlertid genopstået som et syntetisk nyttigt metal på grund af dets lavere omkostninger og fordi det er et miljøvenligt metal.
Reaktioner af R 2 CuLi med alkylhalogenider R'-X giver koblingsproduktet:
- R 2 CuLi + R'X → RR' + CUR + LiX
Den reaktionsmekanisme involverer oxidativ addition (OA) af alkylhalogenid til Cu (I), danner et plant Cu (III) mellemprodukt, efterfulgt af reduktiv elimination (RE). Det nukleofile angreb er det hastighedsbestemmende trin. Ved substitution af iodid foreslås en enkelt-elektronoverførselsmekanisme (se figur).
Mange elektrofiler deltager i denne reaktion. Den omtrentlige rækkefølge af reaktivitet, der begynder med den mest reaktive, er som følger: syrechlorider > aldehyder > tosylater ~ epoxider > iodider > bromider > chlorider > ketoner > estere > nitriler >> alkener
Generelt er OA-RE-mekanismen analog med den for palladiumkatalyserede krydskoblingsreaktioner. En forskel mellem kobber og palladium er, at kobber kan gennemgå enkeltelektronoverførselsprocesser.
Koblingsreaktioner
Oxidativ kobling er koblingen af kobberacetylider til konjugerede alkyner i Glaser-koblingen (for eksempel ved syntesen af cyclooctadecanonaen ) eller til arylhalogenider i Castro-Stephens-koblingen .
Reduktiv kobling er en koblingsreaktion af arylhalogenider med en støkiometrisk ækvivalent kobbermetal, der forekommer i Ullmann-reaktionen . I et eksempel på et nutidigt krydskoblingsreaktion kaldet decarboxylative kobling , en katalytisk mængde af Cu (I) forskyder en carboxylgruppe gruppe danner arylcopper (Arcu) mellemprodukt. Samtidig omdanner en palladiumkatalysator et arylbromid til organopalladiummellemproduktet (Ar'PdBr), og ved transmetallering dannes biarlen fra ArPdAr '.
Redox neutral kobling er koblingen af terminale alkyner med halo-alkyner med et kobbersalt (I) i Cadiot-Chodkiewicz-koblingen . Termisk kobling af to organiske kobberforbindelser er også mulig.
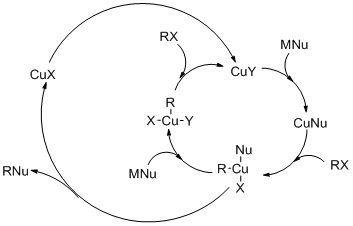
Carbocupration
Carbocupration er en nukleofil tilsætning af organokopperreagenser (R-Cu) til acetylen eller terminale alkyner, hvilket resulterer i en alkenylcopper-forbindelse (RC = C-Cu). Det er et specielt tilfælde af karbometalering og kaldes også Normant-reaktionen .
Figur: Katalytisk cyklus til carbocupration til syntese af Aldol, produkter fra Baylis-Hillman-typen
Syntetiske applikationer
- Den Chan-Lam kobling muliggør dannelsen af aryl- carbon-hetoroatom bindinger. Det involverer kobling af borsyrer , stannaner eller siloxaner med NH- eller OH-holdige substrater.
- Ullmann-reaktion involverer kobbermedierede reaktioner af arylhalogenider. To typer Ullmann-reaktioner genkendes:
- Klassisk kobberfremmet syntese af symmetriske biarylforbindelser)
- Kobberfremmet nukleofil aromatisk substitution.
- Sonogashira-koblingsreaktion , der anvender både kobber og palladium, indebærer kobling af aryl- og / eller vinylhalogenider med terminale alkyner.
Reduktionsmidler
Kobberhydrider er specialiserede reagenser, der lejlighedsvis anvendes som reduktionsmiddel . Det bedst kendte kobberhydrid kaldes Stryker's reagens , en klyngeforbindelse med formlen [(PPh 3 ) CuH] 6 . Det reducerer alken α, β-umættede carbonylforbindelser .
Buchwald-reaktionen er en kobberkatalyseret asymmetrisk reduktion af aktiverede alkener. Reagenset genereres in situ fra kobber (I) NHC- kompleks. Hydridækvivalenterne tilvejebringes af en silan .
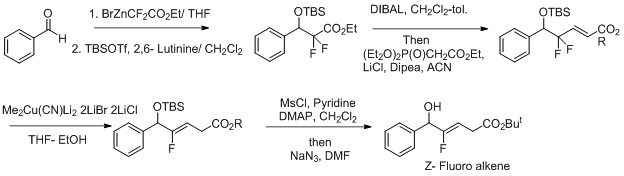
Syntese af Z-fluoralkendipeptid-isosterer. En anden indsats for at gøre dette til en mere selektiv reaktion inkluderer anvendelsen af oxidationsreduktionsbetingelser for reaktionen. Fluor fungerer som en fraspaltelig gruppe, og det forbedrer regioselektivitet i transformation af Z-fluoralken.
Cu-alkyleringsreaktion
Generelt forløber alkyleringsreaktionen af organokopperreagenser via gamma-alkylering. Cis-gamma-angreb forekommer bedre i cyclohexylcarbamat på grund af steriske stoffer. Reaktionen rapporteres at være gunstig i æteriske opløsningsmidler. Denne metode viste sig at være meget effektiv til oxidativ kobling af aminer og alkyl, herunder tertbutyl og arylhalogenider.
Vicinal funktionaliseringsreaktioner
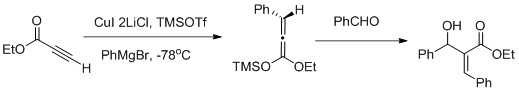
Vicinal funktionalisering under anvendelse af en Carbocupration-Mukaiyama aldol reaktionssekvens
Muller og samarbejdspartnere rapporterede en vicinal funktionalisering af α, β-acetylenestere ved anvendelse af en Carbocupration / Mukaiyama aldol reaktionssekvens (som vist i fig. Ovenfor) carbocupration favoriserer dannelsen af Z-aldol.
Yderligere læsning
- Yao, B .; Liu, Y .; Zhao, L .; Wang, D .; Wang, M. (2014). "Designe en Cu (II) -ArCu (II) -ArCu (III) -Cu (I) katalytisk cyklus: Cu (II) -katalyseret oxidativ Arene C-H-bindingsazidering med luft som en oxidant under omgivende forhold". J. Org. Chem . 79 (22): 11139–11145. doi : 10.1021 / jo502115a . PMID 25350606 .
- Yamamoto, Y .; Yamammoto, S .; Yatagai, H .; Maruyama, K (1980). "Lewis-syre-medierede reaktioner af organokopperreagens. Et bemærkelsesværdigt forbedret regioselektivt gamma-angreb af allylhalider og direkte alkylering af allylalkoholer via RCu.BF 3 ". JACS . 102 (7): 2318-22325. doi : 10.1021 / ja00527a032 .





![Et Cu (III) mellemprodukt karakteriseret ved NMR. [11]](https://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/CopperIII_intermediate_by_RI_NMR.png/300px-CopperIII_intermediate_by_RI_NMR.png)
![{\ displaystyle [{\ ce {R}} {-} {\ color {Blue} {\ ce {Cu}}} {\ ce {-R}}] ^ {-} {\ ce {Li +}} \ { \ xrightarrow {\ color {Red} {\ ce {R'-X}}}} \ \ left [{\ ce {R}} {-} {\ overset {{\ displaystyle \ color {Red} {\ ce { R}} '} \ oven |} {\ undersæt {| \ ovenpå {\ displaystyle \ color {rød} {\ ce {X}}}} {\ color {blå} {\ ce {Cu}}}}} {\ ce {-R}} \ højre] ^ {-} {\ ce {Li +}} {\ ce {-> R}} {-} {\ color {Blue} {\ ce {Cu}}} + {\ ce {R}} {-} {\ color {Red} {\ ce {R '}}} + {\ ce {Li}} {-} {\ color {Red} {\ ce {X}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d7db6776d965a97de00837677a94c6fd3d1df2a)