Pentavalent vaccine - Pentavalent vaccine
| Kombination af | |
|---|---|
| DTP -vaccine | Vaccine |
| Hepatitis B -vaccine | Vaccine |
| Haemophilus -vaccine | Vaccine |
| Kliniske data | |
| Handelsnavne | Quintavax, Pentavac, Pentacel, andre |
| Ruter for administration |
Intramuskulær injektion |
| ATC -kode | |
| Identifikatorer | |
| CAS -nummer | |
En pentavalent vaccine , også kendt som en 5-i-1-vaccine , er en kombinationsvaccine med fem individuelle vacciner konjugeret til én.
Pentavalent vaccine refererer ofte til 5-i-1-vaccinen, der beskytter mod difteri , stivkrampe , kighoste , hepatitis B og Haemophilus influenzae type B , som generelt bruges i mellem- og lavindkomstlande , hvor poliovaccine gives separat.
En anden femværdig vaccine er 5-i-1-vaccinen, der beskytter mod difteri, stivkrampe, kighoste, polio og Haemophilus influenza type B , som blev brugt i Storbritannien indtil 2017, hvorefter en 6-i-1-vaccine blev tilgængelig indeholdende den ekstra beskyttelse mod hepatitis B.
I 2013 udgjorde femværdige vacciner 100% af de DTP -indeholdende vacciner, der blev indkøbt af UNICEF , som leverer vacciner til en stor del af verdens børn.
Sikkerhed
Under undersøgelser og test viste det sig, at den konjugerede flydende DTPw - HepB - Hib -vaccine havde en positiv sikkerhed, når den blev givet som en booster til små børn, der har fået et vaccinationskursus med en anden femværdig booster, der kræver en ændring i konstitution og også blev fundet at være tilstrækkeligt immunogen .
Historie
I oktober 2004 udstedte Det Europæiske Lægemiddelagentur markedsføringstilladelse inden for EU til den femværdige vaccine Quintanrix, fremstillet af GlaxoSmithKline . Quintanrix blev frivilligt trukket tilbage af producenten i 2008.
I september 2006 modtog den første femværdige vaccineformulering prækvalifikationsgodkendelse fra Verdenssundhedsorganisationen .
I 2012 udsendte og anbefalede UNICEF og Verdenssundhedsorganisationen en fælles erklæring til immuniseringsafdelingen, ministeriet for sundhed og familievelfærd, indiens regering og andre udviklingslande i separate dokumenter om brugen af femværdige vacciner til beskyttelse mod fem af de førende årsager til vaccineforebyggelig død hos børn.
I 2013 udgjorde femværdige vacciner 100% af de DTP -indeholdende vacciner, der blev indkøbt af UNICEF, som leverer vacciner til en stor del af verdens børn.
I 2014 blev Sydsudan det sidste af de 73 GAVI- understøttede lande til at introducere fem-i-en-vaccinen.
Samfund og kultur
I maj 2010 annoncerede Crucell NV en pris på 110 millioner dollars fra UNICEF for at levere sin femværdige børnevaccine Quinvaxem til udviklingslandene.
I november 2010 annoncerede det offentligt-private konsortium GAVI , at udgifterne til den pentavalente vaccine til vækstlandene var faldet til under $ 3,00 USD pr. Dosis.
Højindkomstlande har en tendens til at bruge alternative formuleringer ved hjælp af acellulær pertussis (Pa), som har en mere gunstig profil af bivirkninger, frem for helcelle-kighoste-komponenter. I Europa er hexavalente vacciner, der også indeholder inaktiveret poliovaccine ( IPV ) i vid udstrækning. I USA indeholder de to femværdige vacciner, der har modtaget markedsføringstilladelse, IPV frem for hepatitis B-vaccine ( DTaP-IPV/Hib-vaccine ) eller Hib-vaccine ( DTaP-IPV-HepB-vaccine ).
Alle pentavalente vaccinepriser faldt, og prisdiskriminering forsvandt næsten. Graf af GAVI; ikke-UNICEF-priser ikke vist
Indien
I 2013 blev det konstateret, at Pentavac PFS -vacciner blev leveret med to forskellige pakker: Et sæt med fremstillings- og udløbsdatoer blev leveret til private hospitaler , mens det andet sæt uden fremstillings- og udløbsdatoer blev distribueret til offentlige hospitaler . Det blev senere præciseret, at de udaterede vacciner blev leveret af UNICEF og overholdt indisk lov .
Sri Lanka
Sri Lanka introducerede Quinvaxem i januar 2008. Inden for tre måneder førte fire rapporter om dødsfald og 24 rapporter om mistænkte hypotonisk-hyporesponsive episoder til lovgivningsmæssig opmærksomhed og forsigtig suspension af det oprindelige vaccineparti. En efterfølgende død, der fandt sted med det næste parti i april 2009, fik myndighederne til at suspendere pentavalent vaccinebrug og genoptage DTwP- og hepatitis B -vaccination . Efter en undersøgelse foretaget af uafhængige nationale og internationale eksperter blev vaccinen genindført i 2010.
Bhutan
Bhutan introducerede Easyfive-TT i september 2009. Identifikationen af fem tilfælde med encefalopati og/eller meningoencephalitis kort efter femværdig vaccination fik myndighederne til at suspendere vaccinationen den 23. oktober 2009. Efterfølgende blev yderligere fire alvorlige tilfælde relateret til vaccine administreret før suspension identificeret og undersøgt. Efter en omfattende gennemgang af uafhængige nationale og internationale eksperter blev vaccinen genindført i 2011.
Vietnam
Mellem december 2012 og marts 2013 blev der rapporteret ni dødsfald i Vietnam af børn, der for nylig havde fået injektioner af den pentavalente vaccine Quinvaxem. Den 4. maj 2013 meddelte Vietnams sundhedsministerium, at brugen af Quinvaxem blev suspenderet.
Efter en gennemgang af sagerne foretaget af nationale eksperter sammen med personale fra WHO og UNICEF og en uafhængig kliniker, kunne der ikke identificeres nogen forbindelse med vaccination. De dødsfald, der blev rapporteret i Vietnam, blev tilskrevet tilfældige helbredsproblemer relateret til tiden, men ikke relateret til brugen af Quinvaxem, eller tilfælde, for hvilke de tilgængelige oplysninger ikke gav mulighed for en bestemt konklusion, men der var ingen kliniske tegn, der var i overensstemmelse med brugen af vaccinen. WHO -rapporten understregede, at mere end 400 millioner doser Quinvaxem var blevet administreret, og at der aldrig nogensinde havde været forbundet en dødelig bivirkning med Quinvaxem eller lignende vacciner.
Efter yderligere rapporter fra Indien , Sri Lanka og Bhutan om et lille antal alvorlige bivirkninger efter immunisering med femværdige vacciner bad WHO et globalt panel af uafhængige eksperter om at gennemgå vaccinens sikkerhed. Denne gennemgang fandt sted den 12.-13. Juni 2013 og konkluderede, at der ikke kan tilskrives pentavalente vacciner nogen usædvanlig reaktion. Den 20. juni 2013 meddelte sundhedsministeriet, at Vietnam ville genoptage brugen af Quinvaxem.
De rapporterede hændelser i disse asiatiske nationer forårsagede offentlig usikkerhed om brugen af femværdige vacciner til at sprede sig til andre udviklingslande. Som svar på dette og en tilsvarende spredning af unøjagtige oplysninger om vaccinesikkerhed udsendte Indian Academy of Pediatrics en erklæring til støtte for femværdige vacciner.
Formuleringer
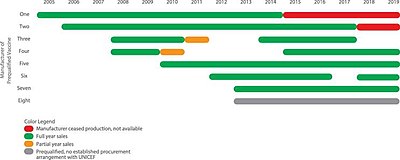
Almindelige versioner af femværdige vacciner omfatter Quinvaxem, Pentavac PFS, Easyfive TT, ComBE Five, Shan5 og Pentabio.
| Vaccine | Fabrikant | Dato prækvalificeret af WHO |
|---|---|---|
| Quinvaxem | Crucell | 26. september 2006 |
| Pentavac PFS | Serum Institute of India | 23. juni 2010 |
| Easyfive TT | Panacea Biotec | 2. oktober 2013 |
| ComBE Five | Biologisk E. Limited | 1. september 2011 |
| Shan5 | Shantha Biotechnics | 29. april 2014 |
| Pentabio | Bio Farma | 19. december 2014 |
Noter
Referencer
Yderligere læsning
- Dodoo AN, Renner L, van Grootheest AC, Labadie J, Antwi-Agyei KO, Hayibor S, et al. (2007). "Sikkerhedsovervågning af en ny pentavalent vaccine i det udvidede program om immunisering i Ghana". Lægemiddelsikkerhed . 30 (4): 347–56. doi : 10.2165/00002018-200730040-00007 . PMID 17408311 . S2CID 37633844 .
- Verma R, Khanna P, Chawla S (juli 2013). "Pentavalent DTP -vaccine: skal indarbejdes i vaccinationsprogrammet i Indien" . Human vacciner og immunterapeutika . 9 (7): 1497–9. doi : 10.4161/hv.24382 . PMID 23571225 .
eksterne links
- Quinn B (6. juni 2011). "Lægemiddelvirksomheder til lavere pris på vacciner i udviklingslande" . Værgen .
- Dhar A (2013-10-11). "Pentavalent vaccine bliver ren chit, indstillet til national opskalering" . Hinduen .
- Sinha V (10. juni 2011). "Sundhedsorganisation, Gates Foundation fremmer større brug af vacciner" . Amerikas stemme . Arkiveret fra originalen den 5. marts 2016.