Cathelicidin - Cathelicidin
Cathelicidin antimikrobielt peptid (CAMP) er et polypeptid , der primært opbevares i lysosomer af makrofager og polymorfonukleære leukocytter (PMN'er); hos mennesker koder CAMP- genet for peptidprekursoren CAP-18 (18 kDa), som behandles ved proteinase 3- medieret ekstracellulær spaltning til den aktive form LL-37. LL-37 er det eneste peptid i familien Cathelicidin, der findes i menneskekroppen.
Cathelicidinpeptider er dobbeltmolekyler kaldet amfifiler: den ene ende af molekylet tiltrækkes af vand og frastøttes af fedt og proteiner, og den anden ende tiltrækkes af fedt og proteiner og frastødes af vand. Medlemmer af denne familie reagerer på patogener ved at nedbryde, ødelægge eller punktere cellemembraner.
Cathelicidiner tjener således en kritisk rolle i pattedyrets medfødte immunforsvar mod invasiv bakteriel infektion. Cathelicidin -familien af peptider er klassificeret som antimikrobielle peptider (AMP'er). AMP -familien inkluderer også defensinerne . Mens defensinerne deler fælles strukturelle træk, er cathelicidin-relaterede peptider meget heterogene. Medlemmer af cathelicidin -familien af antimikrobielle polypeptider er kendetegnet ved en stærkt bevaret region (cathelin -domæne) og et meget variabelt cathelicidin -peptiddomæne.
Cathelicidinpeptider er blevet isoleret fra mange forskellige pattedyrarter . Cathelicidiner findes mest i neutrofiler , monocytter , mastceller , dendritiske celler og makrofager efter aktivering af bakterier, vira, svampe, parasitter eller hormonet 1,25-D , som er den hormonelt aktive form for D-vitamin . De er blevet fundet i nogle andre celler, herunder epitelceller og humane keratinocytter .
Etymologi
Udtrykket blev opfundet i 1995 fra cathelin på grund af det karakteristiske cathelinlignende domæne, der findes i cathelicidiner. Selve navnet cathelin blev opfundet fra cathepsin L -hæmmer i 1989.
Mekanisme for antimikrobiel aktivitet
Den generelle regel for mekanismen, der udløser cathelicidinvirkning, ligesom den for andre antimikrobielle peptider, involverer opløsning (beskadigelse og punktering) af cellemembraner af organismer, som peptidet er aktivt mod. Cathelicidin ødelægger hurtigt lipoproteinmembranerne i mikrober indhyllet i fagosomer efter fusion med lysosomer i makrofager . Derfor kan LL-37 hæmme dannelsen af bakterielle biofilm.
Andre aktiviteter
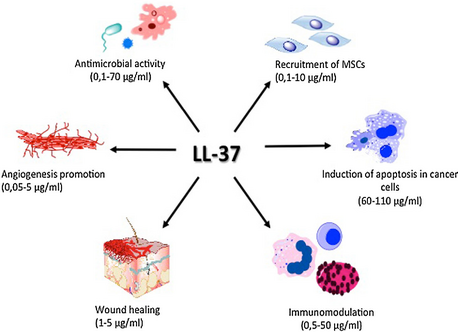
LL-37 spiller en rolle i aktiveringen af celleproliferation og migration, hvilket bidrager til sårlukningsprocessen. Alle disse mekanismer spiller sammen en væsentlig rolle i vævshomeostase og regenerative processer. Desuden har den en agonistisk virkning på forskellige pleiotropiske receptorer, f.eks. Formylpeptidreceptor- lignende (1), purinerg receptor P2X7 , epidermal vækstfaktorreceptor (EGFR) eller insulinlignende vækstfaktor-1-receptor (IGF- 1R). Disse receptorer spiller en vigtig immunmodulerende rolle i blandt andet anti-tumor immunrespons.
Desuden inducerer det angiogenese og regulerer apoptose. Disse processer er dysreguleret under tumorudvikling, og derfor kan LL-37 være involveret i patogenese af maligne tumorer.
Egenskaber
Cathelicidiner varierer i størrelse fra 12 til 80 aminosyrerester og har en lang række strukturer. De fleste cathelicidiner er lineære peptider med 23-37 aminosyrerester og foldes til amfipatiske a-helixer . Derudover kan cathelicidiner også være små molekyler (12-18 rester) med beta-hårnålestrukturer, stabiliseret med en eller to disulfidbindinger. Endnu større cathelicidinpeptider (39-80 aminosyrerester) er også til stede. Disse større cathelicidiner viser gentagne prolinmotiver, der danner forlængede strukturer af polyprolintype .
I 1995 udtalte Gudmundsson et al. antaget, at det aktive antimikrobielle peptid er dannet af et C-terminal domæne med 39 rester (betegnet FALL-39). Men kun et år senere oplyste, at den modne AMP, nu kaldet LL-37, i virkeligheden er to aminosyrer kortere end FALL-39.
Cathelicidin -familien deler primær sekvenshomologi med cystatin -familien af cysteinproteinasehæmmere, selv om aminosyrerester, der menes at være vigtige i en sådan proteaseinhibering, normalt mangler.
Ikke-menneskelige ortologer
Cathelicidinpeptider er fundet hos mennesker, aber, mus, rotter, kaniner, marsvin, pandaer, grise, kvæg, frøer, får, geder, kyllinger og heste. Omkring 30 cathelicidin -familiemedlemmer er blevet beskrevet hos pattedyr.
Aktuelt identificerede cathelicidinpeptider omfatter følgende:
- Menneske: hCAP-18 (spaltet i LL-37)
- Rhesus abe: RL-37
- Mus: CRAMP-1/2, (Cathelicidin-relateret antimikrobielt peptid
- Rotter: rCRAMP
- Kaniner: CAP-18
- Marsvin: CAP-11
- Grise: PR-39, Prophenin, PMAP-23,36,37
- Kvæg: BMAP-27,28,34 (Bovine Myeloid Antimicrobial Peptides); Bac5, Bac7
- Frøer: cathelicidin-AL (fundet i Amolops loloensis )
- Kyllinger: Fire cathelicidiner, fowlicidiner 1,2,3 og cathelicidin Beta-1
- Tasmansk djævel: Saha-CATH5
- Laks: CATH1 og CATH2
Klinisk betydning
Patienter med rosacea har forhøjede niveauer af cathelicidin og forhøjede niveauer af stratum corneum tryptiske enzymer (SCTE'er). Cathelicidin spaltes i det antimikrobielle peptid LL-37 af både kallikrein 5 og kallikrein 7 serinproteaser. Overdreven produktion af LL-37 formodes at være en medvirkende årsag i alle undertyper af Rosacea . Antibiotika har tidligere været brugt til behandling af rosacea, men antibiotika virker muligvis kun, fordi de hæmmer nogle SCTE'er.
Lavere plasmaniveauer af humant cathelicidin antimikrobielt protein ( hCAP18 ) ser ud til at øge risikoen for død ved infektion hos dialysepatienter markant . Produktionen af cathelicidin reguleres op af D-vitamin .
SAAP-148 (en s ynthetic en ntimicrobial og en ntibiofilm p eptide) er en modificeret version af LL-37, der har forbedret antimikrobielle aktiviteter sammenlignet med LL-37. Især SAAP-148 var mere effektiv til at dræbe bakterier under fysiologiske forhold.
LL-37 menes at spille en rolle i psoriasispatogenese (sammen med andre antimikrobielle peptider). Ved psoriasis frigiver beskadigede keratinocytter LL-37, som danner komplekser med selvgenetisk materiale (DNA eller RNA) fra andre celler. Disse komplekser stimulerer dendritiske celler (en type antigenpræsenterende celle), som derefter frigiver interferon α og β, hvilket bidrager til differentiering af T-celler og fortsat betændelse. LL-37 har også vist sig at være et almindeligt auto-antigen ved psoriasis; T-celler specifikke for LL-37 blev fundet i blod og hud hos to tredjedele af patienterne med moderat til svær psoriasis.
Se også
Referencer
Yderligere læsning
- Dürr UH, Sudheendra US, Ramamoorthy A (september 2006). "LL-37, det eneste humane medlem af cathelicidin-familien af antimikrobielle peptider" . Biochimica et Biophysica Acta (BBA) - Biomembraner . 1758 (9): 1408–25. doi : 10.1016/j.bbamem.2006.03.030 . PMID 16716248 .
- Chromek M, Slamová Z, Bergman P, Kovács L, Podracká L, Ehrén I, Hökfelt T, Gudmundsson GH, Gallo RL, Agerberth B, Brauner A (juni 2006). "Det antimikrobielle peptid cathelicidin beskytter urinvejene mod invasiv bakteriel infektion". Naturmedicin . 12 (6): 636–41. doi : 10.1038/nm1407 . PMID 16751768 . S2CID 20704807 .
- Gombart AF, Borregaard N, Koeffler HP (juli 2005). "Humant cathelicidin antimikrobielt peptid (CAMP) -gen er et direkte mål for vitamin D-receptoren og er stærkt opreguleret i myeloide celler af 1,25-dihydroxyvitamin D3". FASEB Journal . 19 (9): 1067–77. doi : 10.1096/fj.04-3284com . PMID 15985530 . S2CID 7563259 .
- López-García B, Lee PH, Gallo RL (maj 2006). "Ekspression og potentiel funktion af cathelicidin antimikrobielle peptider i dermatophytosis og tinea versicolor" . Journal of Antimicrobial Chemotherapy . 57 (5): 877–82. doi : 10.1093/jac/dkl078 . PMID 16556635 .
- Lehrer RI, Ganz T (januar 2002). "Cathelicidiner: en familie af endogene antimikrobielle peptider". Nuværende mening i hæmatologi . 9 (1): 18–22. doi : 10.1097/00062752-200201000-00004 . PMID 11753073 . S2CID 23575052 .
- Niyonsaba F, Hirata M, Ogawa H, Nagaoka I (september 2003). "Epithelcelle-afledte antibakterielle peptider humane beta-defensiner og cathelicidin: multifunktionelle aktiviteter på mastceller". Nuværende lægemiddelmål. Betændelse og allergi . 2 (3): 224–31. doi : 10.2174/1568010033484115 . PMID 14561157 .
- van Wetering S, Tjabringa GS, Hiemstra PS (april 2005). "Interaktioner mellem neutrofile afledte antimikrobielle peptider og luftvejsepitelceller". Journal of Leukocyte Biology . 77 (4): 444–50. doi : 10.1189/jlb.0604367 . PMID 15591123 . S2CID 8261526 .
- Cowland JB, Johnsen AH, Borregaard N (juli 1995). "hCAP-18, et cathelin/pro-bactenecin-lignende protein af humane neutrofile specifikke granulater" . FEBS Breve . 368 (1): 173–6. doi : 10.1016/0014-5793 (95) 00634-L . PMID 7615076 . S2CID 3172761 .
- Gudmundsson GH, Magnusson KP, Chowdhary BP, Johansson M, Andersson L, Boman HG (juli 1995). "Genets struktur for svinepeptidantibiotikum PR-39, et cathelin-genfamiliemedlem: komparativ kortlægning af locus for det humane peptidantibiotikum FALL-39" . Procedurer fra National Academy of Sciences i Amerikas Forenede Stater . 92 (15): 7085–9. Bibcode : 1995PNAS ... 92.7085G . doi : 10.1073/pnas.92.15.7085 . PMC 41476 . PMID 7624374 .
- Larrick JW, Hirata M, Balint RF, Lee J, Zhong J, Wright SC (april 1995). "Human CAP18: et nyt antimikrobielt lipopolysaccharidbindende protein" . Infektion og immunitet . 63 (4): 1291–7. doi : 10.1128/IAI.63.4.1291-1297.1995 . PMC 173149 . PMID 7890387 .
- Larrick JW, Lee J, Ma S, Li X, Francke U, Wright SC, Balint RF (november 1996). "Strukturel, funktionel analyse og lokalisering af det humane CAP18 -gen" . FEBS Breve . 398 (1): 74–80. doi : 10.1016/S0014-5793 (96) 01199-4 . PMID 8946956 . S2CID 35329283 .
- Frohm M, Agerberth B, Ahangari G, Stâhle-Bäckdahl M, Lidén S, Wigzell H, Gudmundsson GH (juni 1997). "Ekspressionen af genet, der koder for det antibakterielle peptid LL-37, induceres i humane keratinocytter under inflammatoriske lidelser" . Journal of Biological Chemistry . 272 (24): 15258–63. doi : 10.1074/jbc.272.24.15258 . PMID 9182550 .
- Bals R, Wang X, Zasloff M, Wilson JM (august 1998). "Peptidantibiotikummet LL-37/hCAP-18 udtrykkes i epitel af den humane lunge, hvor det har bred antimikrobiel aktivitet ved luftvejsoverfladen" . Procedurer fra National Academy of Sciences i Amerikas Forenede Stater . 95 (16): 9541–6. Bibcode : 1998PNAS ... 95.9541B . doi : 10.1073/pnas.95.16.9541 . PMC 21374 . PMID 9689116 .
- Chen Q, Schmidt AP, Anderson GM, Wang JM, Wooters J, Oppenheim JJ, Chertov O (oktober 2000). "LL-37, det neutrofile granulat- og epitelcelle-afledte cathelicidin, anvender formylpeptidreceptorlignende 1 (FPRL1) som en receptor til kemoattraktion af humane perifere blodneutrofiler, monocytter og T-celler" . Journal of Experimental Medicine . 192 (7): 1069–74. doi : 10.1084/jem.192.7.1069 . PMC 2193321 . PMID 11015447 .
- Agerberth B, Charo J, Werr J, Olsson B, Idali F, Lindbom L, Kiessling R, Jörnvall H, Wigzell H, Gudmundsson GH (november 2000). "De humane antimikrobielle og kemotaktiske peptider LL-37 og alfa-defensiner udtrykkes ved specifikke lymfocyt- og monocytpopulationer". Blod . 96 (9): 3086–93. doi : 10.1182/blood.V96.9.3086 . PMID 11049988 .
- Bals R, Lang C, Weiner DJ, Vogelmeier C, Welsch U, Wilson JM (marts 2001). "Rhesus abe (Macaca mulatta) mucosale antimikrobielle peptider er tætte homologer af humane molekyler" . Klinisk og diagnostisk laboratorieimmunologi . 8 (2): 370–5. doi : 10.1128/CDLI.8.2.370-375.2001 . PMC 96065 . PMID 11238224 .
- Nagaoka I, Hirota S, Niyonsaba F, Hirata M, Adachi Y, Tamura H, Heumann D (september 2001). "Cathelicidin-familien af antibakterielle peptider CAP18 og CAP11 hæmmer ekspressionen af TNF-alfa ved at blokere bindingen af LPS til CD14 (+) celler" . Journal of Immunology . 167 (6): 3329–38. doi : 10.4049/jimmunol.167.6.3329 . PMID 11544322 .
- Hase K, Eckmann L, Leopard JD, Varki N, Kagnoff MF (februar 2002). "Celledifferentiering er en vigtig determinant for cathelicidin LL-37/human kationisk antimikrobielt protein 18-ekspression af humant tyktarmsepitel" . Infektion og immunitet . 70 (2): 953–63. doi : 10.1128/IAI.70.2.953-963.2002 . PMC 127717 . PMID 11796631 .
- Giuliani A, Pirri G, Nicoletto S (2007). "Antimikrobielle peptider: en oversigt over en lovende klasse af terapeutiske midler" . Cent. Eur. J. Biol . 2 (1): 1–33. doi : 10.2478/s11535-007-0010-5 .
- Burton MF, Steel PG (december 2009). "Kemi og biologi af LL-37". Naturlige produktrapporter . 26 (12): 1572–84. doi : 10.1039/b912533g . PMID 19936387 .