Kronisk myelogen leukæmi - Chronic myelogenous leukemia
| Kronisk myelogen leukæmi | |
|---|---|
| Andre navne | Kronisk myeloid leukæmi, kronisk granulocytisk leukæmi (CGL) |
 | |
| The Philadelphia-kromosomet som ses ved fluorescerende in situ-hybridisering (FISH). | |
| Specialitet | Hæmatologi og onkologi |
| Frekvens | 298.000 (2015) |
| Dødsfald: Døde | 32.200 (2015) |
Kronisk myelogen leukæmi ( CML ), også kendt som kronisk myeloid leukæmi , er en kræft i de hvide blodlegemer . Det er en form for leukæmi karakteriseret ved den øgede og uregulerede vækst af myeloide celler i knoglemarven og akkumulering af disse celler i blodet. CML er en klonal knoglemarvsstamcelleforstyrrelse , hvor en proliferation af modne granulocytter ( neutrofiler , eosinofiler og basofiler ) og deres forstadier findes. Det er en type myeloproliferativ neoplasma forbundet med en karakteristisk kromosomal translokation kaldet Philadelphia -kromosomet .
CML behandles stort set med målrettede lægemidler kaldet tyrosinkinasehæmmere (TKI'er), som har ført til dramatisk forbedrede langsigtede overlevelsesrater siden 2001. Disse lægemidler har revolutioneret behandlingen af denne sygdom og giver de fleste patienter en god livskvalitet i sammenligning til de tidligere kemoterapilægemidler. I vestlige lande tegner CML sig for 15-25% af alle voksne leukæmier og 14% af leukæmier generelt (inklusive den pædiatriske population, hvor CML er mindre almindelig).
tegn og symptomer
Den måde CML præsenterer afhænger af sygdomsstadiet ved diagnosen, da det i nogle tilfælde har været kendt at springe stadier over.
De fleste patienter (~ 90%) diagnosticeres i det kroniske stadium, som oftest er asymptomatisk. I disse tilfælde kan det tilfældigt diagnosticeres med et forhøjet antal hvide blodlegemer på en rutinemæssig laboratorietest. Det kan også præsentere symptomer, der tyder på hepatosplenomegali og den resulterende venstre øvre kvadrant smerte, dette forårsager. Den forstørrede milt kan lægge pres på maven og forårsage tab af appetit og deraf følgende vægttab. Det kan også vise sig med let feber og nattesved på grund af et forhøjet basalt stofskifte.
Nogle (<10%) diagnosticeres i det accelererede stadium, som oftest præsenterer blødning, petechiae og ekkymose . Hos disse patienter er feber oftest et resultat af opportunistiske infektioner.
Nogle patienter diagnosticeres oprindeligt i blastfasen , hvor symptomerne sandsynligvis er feber, knoglesmerter og en stigning i knoglemarvsfibrose.
årsag
I de fleste tilfælde kan ingen åbenbar årsag til CML isoleres.
Risikofaktorer
CML er mere almindelig hos mænd end hos kvinder (forholdet mellem mænd og kvinder på 1,4: 1) og forekommer mere almindeligt hos ældre med en medianalder ved diagnosen 65 år. Eksponering for ioniserende stråling ser ud til at være en risikofaktor baseret på en 50 gange højere forekomst af CML i Hiroshima og Nagasaki atombomber. Hastigheden af CML hos disse individer ser ud til at toppe cirka 10 år efter eksponeringen.
Patofysiologi
CML var den første kræft, der blev knyttet til en klar genetisk abnormitet, den kromosomale translokation kendt som Philadelphia -kromosomet . Denne kromosomale abnormitet hedder det, fordi den først blev opdaget og beskrevet i 1960 af to forskere fra Philadelphia, Pennsylvania , USA: Peter Nowell fra University of Pennsylvania og David Hungerford fra Fox Chase Cancer Center .
I denne translokation skifter dele af to kromosomer (den 9. og 22.) sted. Som et resultat fusioneres en del af BCR ("breakpoint cluster region") -genet fra kromosom 22 med ABL -genet på kromosom 9. Dette unormale "fusionsgen" genererer et protein på p210 eller undertiden p185 vægt (p210 er kort for 210 kDa -protein, en stenografi, der bruges til at karakterisere proteiner, der udelukkende er baseret på størrelse). Fordi abl bærer et domæne, der kan tilføje fosfatgrupper til tyrosinrester (en tyrosinkinase ), er bcr-abl- fusionsgenproduktet også en tyrosinkinase.
Det fusionerede BCR-ABL-protein interagerer med interleukin 3beta (c) receptorsubenheden . BCR-ABL-transkriptet er kontinuerligt aktivt og kræver ikke aktivering af andre cellulære meddelelsesproteiner. Til gengæld aktiverer BCR-ABL en kaskade af proteiner, der styrer cellecyklussen , hvilket fremskynder celledeling. Desuden hæmmer BCR-ABL-proteinet DNA-reparation , hvilket forårsager genomisk ustabilitet og gør cellen mere modtagelig for at udvikle yderligere genetiske abnormiteter. Virkningen af BCR-ABL-proteinet er den patofysiologiske årsag til kronisk myelogen leukæmi. Med forbedret forståelse af arten af BCR-ABL-proteinet og dets virkning som tyrosinkinase er der udviklet målrettede terapier (hvoraf den første var imatinib ), der specifikt hæmmer aktiviteten af BCR-ABL-proteinet. Disse tyrosinkinasehæmmere kan forårsage komplette remissioner i CML, hvilket bekræfter den centrale betydning af bcr-abl som årsag til CML.
Diagnose
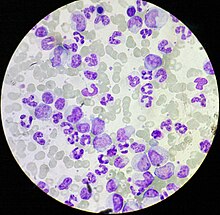
CML mistænkes ofte på grundlag af et fuldstændigt blodtal , som viser øgede granulocytter af alle typer, typisk inklusive modne myeloide celler . Basofiler og eosinofiler øges næsten universelt; denne funktion kan hjælpe med at differentiere CML fra en leukemoid reaktion . En knoglemarvsbiopsi udføres ofte som en del af evalueringen for CML, og CML diagnosticeres ved hjælp af cytogenetik, der detekterer translokationen t (9; 22) (q34; q11.2), som involverer ABL1 -genet i kromosom 9 og BCR -genet i kromosom 22. som følge af denne translokation, kromosomet ser mindre end dens homolog kromosom, og dette udseende er kendt som Philadelphia-kromosomet kromosomanomali . Denne abnormitet kan således påvises ved rutinemæssig cytogenetik , og de involverede gener BCR-ABL1 kan påvises ved fluorescerende in situ-hybridisering såvel som ved PCR .
Der er kontroverser om såkaldt Ph-negativ CML eller tilfælde af mistanke om CML, hvor Philadelphia-kromosomet ikke kan påvises. Mange sådanne patienter har faktisk komplekse kromosomale abnormiteter, der skjuler (9; 22) translokationen, eller har tegn på translokationen ved hjælp af FISH eller RT-PCR på trods af normal rutinemæssig karyotyping. Den lille delmængde af patienter uden påviselige molekylære beviser for BCR-ABL1-fusion kan bedre klassificeres som en udifferentieret myelodysplastisk/myeloproliferativ lidelse , da deres kliniske forløb har en tendens til at være anderledes end patienter med CML.
CML skal skelnes fra en leukemoid reaktion , som kan have et lignende udseende på en blodudtværing .
Klassifikation
CML er ofte opdelt i tre faser baseret på kliniske egenskaber og laboratoriefund. I mangel af intervention begynder CML typisk i den kroniske fase, og går i løbet af flere år til en accelereret fase og i sidste ende til en eksplosionskrise . Blast -krise er den endelige fase af CML og opfører sig klinisk som en akut leukæmi . Lægemiddelbehandling stopper normalt denne progression, hvis den startes tidligt. En af drivkræfterne for udviklingen fra kronisk fase gennem acceleration og eksplosionskrise er erhvervelse af nye kromosomale abnormiteter (ud over Philadelphia -kromosomet). Nogle patienter er muligvis allerede i den accelererede fase eller sprængningskrise, når de får diagnosen.
Kronisk fase
Ca. 85% af patienterne med CML er i den kroniske fase på diagnosetidspunktet. I denne fase er patienterne normalt asymptomatiske eller har kun milde symptomer på træthed, smerter i venstre side, led- og/eller hoftesmerter eller mavemasse. Varigheden af den kroniske fase er variabel og afhænger af, hvor tidligt sygdommen blev diagnosticeret samt de anvendte behandlinger. I mangel af behandling udvikler sygdommen sig til en accelereret fase. Præcis patientopdeling baseret på kliniske markører og personlig genomisk profil vil sandsynligvis vise sig gavnlig ved vurderingen af sygdomshistorie med hensyn til progression risiko.
Accelereret fase
Kriterier for diagnosticering af overgang til den accelererede fase er noget varierende; de mest anvendte kriterier er dem, der er fremsat af efterforskere ved MD Anderson Cancer Center , af Sokal et al., og Verdenssundhedsorganisationen . WHO -kriterierne er måske mest udbredt og definerer den accelererede fase ved tilstedeværelsen af ≥1 af følgende hæmatologiske/cytogenetiske kriterier eller foreløbige kriterier vedrørende respons på behandling med tyrosinkinasehæmmer (TKI)
-
Hæmatologiske/cytogenetiske kriterier
- Vedvarende eller stigende højt antal hvide blodlegemer (> 10 × 109 /L) reagerer ikke på behandling
- Vedvarende eller stigende splenomegali, reagerer ikke på behandling
- Vedvarende trombocytose (> 1000 × 109 /l) reagerer ikke på behandling
- Vedvarende trombocytopeni (<100 × 109 /l), uden relation til terapi
- ≥ 20% basofiler i det perifere blod
- 10―19% blaster i det perifere blod og/eller knoglemarv
- Yderligere klonale kromosomale abnormiteter i Philadelphia (Ph) kromosom-positive (Ph+) celler ved diagnose, herunder såkaldte større rute-abnormiteter (et andet Ph-kromosom, trisomi 8, isochromosom 17q, trisomi 19), kompleks karyotype og abnormiteter på 3q26. 2
- Enhver ny klonal kromosomal abnormitet i Ph+ -celler, der opstår under behandlingen
-
Foreløbig respons-til-TKI kriterier
- Hæmatologisk resistens (eller manglende fuldstændig hæmatologisk respons d) over for det første TKI
- Enhver hæmatologisk, cytogenetisk eller molekylær indikation af resistens over for to sekventielle TKI'er
- Forekomst af to eller flere mutationer i BCR-ABL1-fusionsgenet under TKI-terapi
Patienten anses for at være i den accelererede fase, hvis noget af ovenstående er til stede. Den accelererede fase er signifikant, fordi den signalerer, at sygdommen skrider frem, og transformation til eksplosionskrise er overhængende. Lægemiddelbehandling bliver ofte mindre effektiv i de avancerede stadier.
Eksplosionskrise
Blast -krise er den sidste fase i udviklingen af CML og opfører sig som en akut leukæmi med hurtig progression og kort overlevelse. Blastkrise diagnosticeres, hvis noget af følgende er til stede hos en patient med CML:
- > 20% blaster i blod eller knoglemarv
- Tilstedeværelsen af en ekstramedullær spredning af sprængninger
Behandling
Den eneste helbredende behandling for CML er en knoglemarvstransplantation eller en allogen stamcelletransplantation. Bortset fra dette er der fire vigtige grundpiller i behandlingen i CML: behandling med tyrosinkinasehæmmere, myelosuppressiv eller leukofereseterapi (for at modvirke leukocytose under tidlig behandling), splenektomi og interferon alfa-2b- behandling. På grund af den høje medianalder for patienter med CML er det relativt sjældent, at CML ses hos gravide kvinder, på trods af dette kan kronisk myelogen leukæmi imidlertid behandles med relativ sikkerhed til enhver tid under graviditeten med interferon-alfa- hormoner.
Kronisk fase
Tidligere blev antimetabolitter (f.eks. Cytarabin , hydroxyurinstof ), alkyleringsmidler , interferon alfa 2b og steroider anvendt som behandling af CML i den kroniske fase, men siden 2000'erne er blevet erstattet af Bcr-Abl tyrosinkinasehæmmere, der specifikt målrettet mod BCR-ABL, det konstitutivt aktiverede tyrosinkinasefusionsprotein forårsaget af Philadelphia kromosomtranslokationen . På trods af overgangen til udskiftning af cytotoksiske antineoplastika (standard kræftlægemidler) med tyrosinkinasehæmmere bruges hydroxykurea undertiden stadig til at modvirke de høje leukocyttal, der opstår under behandling med tyrosinkinasehæmmere som imatinib; i disse situationer kan det være det foretrukne myelosuppressive middel på grund af dets relative mangel på leukemogene virkninger og dermed den relative mangel på potentiale for sekundære hæmatologiske maligniteter som følge af behandling. IRIS, en international undersøgelse, der sammenlignede interferon/cytarabin-kombination og den første af disse nye lægemidler imatinib, med langsigtet opfølgning, viste den klare overlegenhed af tyrosinkinasemålrettet inhibering i forhold til eksisterende behandlinger.
Imatinib
Den første af denne nye klasse af lægemidler var imatinibmesylat (markedsført som Gleevec eller Glivec), godkendt af US Food and Drug Administration (FDA) i 2001. Imatinib viste sig at hæmme udviklingen af CML hos de fleste patienter (65– 75%) tilstrækkeligt til at opnå genvækst af deres normale knoglemarvsstamcellepopulation (et cytogenetisk respons) med stabile proportioner af modning af hvide blodlegemer. Fordi nogle leukæmiceller (som evalueret ved RT-PCR ) vedvarer hos næsten alle patienter, skal behandlingen fortsættes på ubestemt tid. Siden fremkomsten af imatinib er CML blevet den første kræft, hvor en standard medicinsk behandling kan give patienten en normal levetid.
Dasatinib, nilotinib, radotinib og bosutinib
For at overvinde imatinibresistens og for at øge lydhørheden over for TK -hæmmere blev fire nye midler senere udviklet. Det første, dasatinib , blokerer flere yderligere onkogene proteiner ud over mere kraftig hæmning af BCR-ABL-proteinet og blev oprindeligt godkendt i 2007 af den amerikanske FDA til behandling af CML hos patienter, der enten var resistente over for eller intolerante over for imatinib. En anden ny TK -hæmmer, nilotinib , blev også godkendt af FDA for den samme indikation. I 2010 blev nilotinib og dasatinib også godkendt til førstelinjebehandling, hvilket gjorde tre lægemidler i denne klasse tilgængelige til behandling af nydiagnosticeret CML. I 2012 sluttede Radotinib sig til klassen af nye midler til inhibering af BCR-ABL-proteinet og blev godkendt i Sydkorea for patienter, der var resistente over for eller intolerante over for imatinib. Bosutinib modtog henholdsvis amerikansk FDA og EU European Medicines Agency den 4. september 2012 og 27. marts 2013 for behandling af voksne patienter med Philadelphia kromosom-positiv (Ph+) kronisk myelogen leukæmi (CML) med resistens eller intolerance over for tidligere behandling.
Behandlingsresistent CML
Selvom de var i stand til at producere signifikant forbedrede responser sammenlignet med virkningen af imatinib, kunne hverken dasatinib eller nilotinib overvinde lægemiddelresistens forårsaget af en bestemt mutation, der fandt sted i strukturen af BCR-ABL1 kendt som T315I-mutationen (med andre ord, hvor 315. aminosyre muteres fra en threoninrest til en isoleucinrest ). To tilgange blev udviklet til behandling af CML som følge heraf:
I 2007 offentliggjorde Chemgenex resultaterne af et åbent fase 2/3-studie (CGX-635-CML-202), der undersøgte brugen af et ikke BCR-ABL målrettet middel omacetaxin , administreret subkutant (under huden) hos patienter, der havde mislykkedes med imatinib og udviste T315I kinase domænemutation. Dette er en undersøgelse, der pågår gennem 2014. I september 2012 godkendte FDA omacetaxin til behandling af CML i tilfælde af resistens over for andre kemoterapeutiske midler.
Uafhængigt ankom ARIAD-lægemidler, der tilpassede de kemiske strukturer fra første og anden generations TK-hæmmere, til en ny pan-BCR-ABL1-hæmmer, der viste (for første gang) effekt mod T315I, såvel som alle andre kendte mutationer af oncoproteinet . Lægemidlet, ponatinib , fik FDA -godkendelse i december 2012 til behandling af patienter med resistent eller intolerant CML. Ligesom med anden generations TK-hæmmere søges der tidlig godkendelse til også at udvide brugen af ponatinib til også at blive diagnosticeret CML.
Vaccination
I 2005 blev der opmuntret, men blandede resultater af vaccination med BCR/ ABL1 p210 fusionsprotein hos patienter med stabil sygdom, med GM-CSF som adjuvans.
Prognose
Før fremkomsten af tyrosinkinasehæmmere havde median overlevelsestiden for CML -patienter været omkring 3-5 år fra diagnosetidspunktet.
Ved brug af tyrosinkinasehæmmere er overlevelsesraterne forbedret dramatisk. En opfølgning i 2006 på 553 patienter, der brugte imatinib (Gleevec), fandt en samlet overlevelsesrate på 89% efter fem år.
En 2011 -opfølgning af 832 patienter, der brugte imatinib, som opnåede et stabilt cytogenetisk respons, fandt en samlet overlevelsesrate på 95,2% efter 8 år, hvilket svarer til frekvensen i den generelle befolkning. Færre end 1% af patienterne døde på grund af leukæmi -progression.
Epidemiologi
Det Forenede Kongerige
CML tegner sig for 8% af alle leukæmier i Storbritannien, og omkring 680 mennesker blev diagnosticeret med sygdommen i 2011.
Forenede Stater
American Cancer Society anslår, at der i 2014 blev diagnosticeret omkring 5.980 nye tilfælde af kronisk myeloid leukæmi, og omkring 810 mennesker døde af sygdommen. Det betyder, at lidt over 10% af alle nydiagnosticerede leukæmi tilfælde vil være kronisk myeloid leukæmi. Den gennemsnitlige risiko for, at en person får denne sygdom er 1 ud af 588. Sygdommen er mere almindelig hos mænd end kvinder og mere almindelig hos hvide end afroamerikanere. Gennemsnitsalderen ved diagnosen er 64 år, og denne sygdom ses sjældent hos børn.
Referencer
eksterne links
| Klassifikation | |
|---|---|
| Eksterne ressourcer |
- Kronisk myeloid leukæmi hos American Cancer Society
- CML -oplysninger fra The Leukemia & Lymphoma Society
- Kronisk myelocytisk leukæmi (CML) ved Merck Manual of Diagnosis and Therapy Home Edition