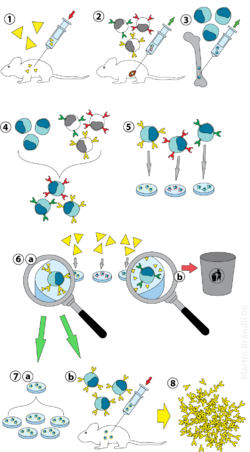
Hybridomteknologi - Hybridoma technology
Hybridomteknologi er en metode til at producere et stort antal identiske antistoffer (også kaldet monoklonale antistoffer ). Denne proces starter med at injicere en mus (eller et andet pattedyr) med et antigen, der fremkalder et immunrespons. En type hvide blodlegemer, B-cellen , producerer antistoffer, der binder til det injicerede antigen. Disse antistofproducerende B-celler høstes derpå fra musen og på sin side er fusioneret med udødelige B-celle cancerceller, en myelom , at frembringe en hybrid cellelinie kaldet en hybridom , som har både antistof-producerende evne af B- celle og myelomets levetid og reproduktivitet. Hybridomerne kan dyrkes i kultur, idet hver kultur starter med en levedygtig hybridomacelle, der producerer kulturer, som hver især består af genetisk identiske hybridomer, der producerer et antistof pr. Kultur (monoklonal) snarere end blandinger af forskellige antistoffer (polyklonale). Myelomcellelinien, der anvendes i denne proces, vælges på grund af dens evne til at vokse i vævskultur og til fravær af antistofsyntese. I modsætning til polyklonale antistoffer , som er blandinger af mange forskellige antistofmolekyler, er de monoklonale antistoffer produceret af hver hybridomelinie alle kemisk identiske.
Produktionen af monoklonale antistoffer blev opfundet af César Milstein og Georges JF Köhler i 1975. De delte Nobelprisen i 1984 for medicin og fysiologi med Niels Kaj Jerne , der bidrog med andre bidrag til immunologi. Udtrykket hybridoma blev opfundet af Leonard Herzenberg under hans sabbatical i César Milsteins laboratorium i 1976–1977.
Metode
Laboratoriedyr ( pattedyr , f.eks. Mus) udsættes først for det antigen, mod hvilket et antistof skal dannes. Normalt gøres dette ved en række injektioner af det pågældende antigen i løbet af flere uger. Disse injektioner efterfølges typisk af anvendelsen af in vivo elektroporation , hvilket væsentligt forbedrer immunresponset. Når først splenocytter er isoleret fra pattedyrets milt , fusioneres B-cellerne med udødeliggjorte myelomaceller. Fusionen af B-cellerne med myelomaceller kan udføres ved hjælp af elektrofusion. Elektrofusion får B-cellerne og myelomacellerne til at tilpasse sig og smelte sammen med anvendelsen af et elektrisk felt. Alternativt kan B-cellerne og myelomaerne smeltes sammen ved kemiske protokoller, der ofte anvendes polyethylenglycol . Myelomacellerne er valgt på forhånd for at sikre, at de ikke selv udskiller antistof, og at de mangler hypoxanthin-guaninphosphoribosyltransferase (HGPRT) genet, hvilket gør dem følsomme over for HAT-mediet (se nedenfor).
Fusionerede celler inkuberes i HAT-medium ( hypoxanthin - aminopterin - thymidin- medium) i ca. 10 til 14 dage. Aminopterin blokerer vejen, der muliggør nukleotidsyntese. Derfor dør ikke-fusionerede myelomaceller, da de ikke kan producere nukleotider ad de novo- eller bjærgningsveje, fordi de mangler HGPRT. Fjernelse af de ikke-fusionerede myelomaceller er nødvendig, fordi de har potentialet til at vokse ud af andre celler, især svagt etablerede hybridomer. Ufuse B-celler dør, da de har en kort levetid. På denne måde overlever kun B-celle-myelomhybrider, da HGPRT-genet, der kommer fra B-cellerne, er funktionelt. Disse celler producerer antistoffer (en egenskab ved B-celler) og er udødelige (en egenskab ved myelomaceller). Det inkuberede medium fortyndes derefter i plader med flere brønde i en sådan grad, at hver brønd kun indeholder en celle. Da antistofferne i en brønd produceres af den samme B-celle, vil de blive rettet mod den samme epitop og er således monoklonale antistoffer.
Det næste trin er en hurtig primær screeningproces, som kun identificerer og udvælger de hybridomer, der producerer antistoffer med passende specificitet. Den første anvendte screeningsteknik kaldes ELISA . Hybridomakultursupernatanten, sekundært enzymmærket konjugat og kromogent substrat inkuberes derefter, og dannelsen af et farvet produkt indikerer et positivt hybridom. Alternativt kan også immunocytokemisk, western blot og immunfældning-massespektrometri-screening anvendes. I modsætning til western blot-analyser letter immunfældning-massespektrometri screening og rangordning af kloner, der binder til de native (ikke-denaturerede) former af antigenproteiner.
B-cellen, der producerer de ønskede antistoffer, kan klones for at producere mange identiske datterkloner. Supplerende medier indeholdende interleukin-6 (såsom briclon ) er essentielle for dette trin. Når en hybridomakoloni er etableret, vokser den konstant i dyrkningsmedium som RPMI-1640 (med antibiotika og føtalt bovint serum) og producerer antistoffer.
Multibrøndsplader anvendes oprindeligt til at dyrke hybridomaerne og skiftes efter selektion til større vævskulturkolber. Dette opretholder hybridomernes trivsel og giver tilstrækkelige celler til kryopræservering og supernatant til efterfølgende undersøgelser. Kultursupernatanten kan give 1 til 60 ug / ml monoklonalt antistof, som holdes ved -20 ° C eller lavere, indtil det kræves.
Ved anvendelse af kultursupernatant eller et oprenset immunglobulinpræparat kan yderligere analyse af et potentielt monoklonalt antistofproducerende hybridom foretages med hensyn til reaktivitet, specificitet og krydsreaktivitet.
Ansøgninger
Anvendelsen af monoklonale antistoffer er talrige og inkluderer forebyggelse, diagnose og behandling af sygdomme. For eksempel kan monoklonale antistoffer skelne delmængder af B-celler og T-celler , hvilket er nyttigt til at identificere forskellige typer leukæmi . Derudover er specifikke monoklonale antistoffer blevet anvendt til at definere celleoverflademarkører på hvide blodlegemer og andre celletyper. Dette førte til klyngen af differentieringsserier af markører. Disse omtales ofte som CD-markører og definerer adskillige hundrede forskellige celleoverfladekomponenter i celler, hver specificeret ved binding af et bestemt monoklonalt antistof. Sådanne antistoffer er yderst nyttige til fluorescensaktiveret cellesortering , den specifikke isolering af bestemte typer celler.
I diagnostisk histopatologi
Ved hjælp af monoklonale antistoffer kan væv og organer klassificeres baseret på deres ekspression af bestemte definerede markører, som afspejler væv eller cellulær oprindelse. Prostata-specifikt antigen , placenta alkalisk phosphatase , human choriongonadotrophin , α-fetoprotein og andre er organassocierede antigener, og produktionen af monoklonale antistoffer mod disse antigener hjælper med at bestemme arten af en primær tumor.
Monoklonale antistoffer er især nyttige til at skelne mellem morfologisk lignende læsioner, såsom pleural og peritoneal mesotheliom , adenocarcinom og til bestemmelse af organ eller vævsoprindelse af udifferentierede metastaser . Udvalgte monoklonale antistoffer hjælper med påvisning af okkulte metastaser ( kræft af ukendt primær oprindelse ) ved immuncytologisk analyse af knoglemarv, andre vævsaspirater samt lymfeknuder og andet væv og kan have øget følsomhed over normal histopatologisk farvning .
En undersøgelse udførte et følsomt immunhistokemisk assay på knoglemarvsaspirater fra 20 patienter med lokal prostatacancer. Tre monoklonale antistoffer (T16, C26 og AE-1), der er i stand til at genkende membran- og cytoskeletale antigener udtrykt af epitelceller til at detektere tumorceller, blev anvendt i assayet. Knoglemarvsaspirationer hos 22% af patienterne med lokal prostatacancer (trin B, 0/5; fase C, 2/4) og 36% patienter med metastatisk prostatacancer (fase D1, 0/7 patienter; trin D2, 4 / 4 patienter) havde antigen-positive celler i deres knoglemarv. Det blev konkluderet, at immunhistokemisk farvning af knoglemarvsaspirater er meget nyttige til at detektere okkulte knoglemarvmetastaser hos patienter med tilsyneladende lokaliseret prostatacancer.
Selvom immuncytokemi ved anvendelse af tumorassocierede monoklonale antistoffer har ført til en forbedret evne til at detektere okkulte brystcancerceller i knoglemarvsaspirater og perifert blod, er yderligere udvikling af denne metode nødvendig, før den kan bruges rutinemæssigt. En væsentlig ulempe ved immuncytokemi er, at kun tumorassocierede og ikke tumorspecifikke monoklonale antistoffer anvendes, og som et resultat kan der forekomme en vis krydsreaktion med normale celler.
For effektivt at iscenesætte brystkræft og vurdere effektiviteten af udrensningsregimer før autolog stamcelleinfusion er det vigtigt at detektere selv små mængder brystcancerceller. Immunhistokemiske metoder er ideelle til dette formål, fordi de er enkle, følsomme og ret specifikke. Franklin et al. udførte en følsom immuncytokemisk analyse ved anvendelse af en kombination af fire monoklonale antistoffer (260F9, 520C9, 317G5 og BrE-3) mod tumorcelleoverfladeglycoproteiner til identifikation af brysttumorceller i knoglemarv og perifert blod. De konkluderede ud fra resultaterne, at immuncytokemisk farvning af knoglemarv og perifert blod er en følsom og enkel måde at opdage og kvantificere brystcancerceller på.
En af hovedårsagerne til metastatisk tilbagefald hos patienter med solide tumorer er den tidlige formidling af maligne celler. Anvendelsen af monoklonale antistoffer (mAbs), der er specifikke for cytokeratiner, kan identificere disseminerede individuelle epiteltumorceller i knoglemarven.
En undersøgelse rapporterer om at have udviklet en immuncytokemisk procedure til samtidig mærkning af cytokeratin-komponent nr. 18 (CK18) og prostata-specifikt antigen (PSA). Dette vil hjælpe med den yderligere karakterisering af disseminerede individuelle epitel-tumorceller hos patienter med prostatacancer. De tolv kontrolaspirater fra patienter med godartet prostatahypertrofi udviste negativ farvning, hvilket yderligere understøtter specificiteten af CK18 ved påvisning af epiteltumorceller i knoglemarv.
I de fleste tilfælde af ondartet sygdom kompliceret af effusion kan neoplastiske celler let genkendes. I nogle tilfælde ses maligne celler imidlertid ikke så let, eller deres tilstedeværelse er for tvivlsom til at kalde det en positiv rapport. Anvendelsen af immuncytokemiske teknikker øger diagnostisk nøjagtighed i disse tilfælde.
Ghosh, Mason og Spriggs analyserede 53 prøver af pleural eller peritoneal væske fra 41 patienter med ondartet sygdom. Konventionel cytologisk undersøgelse havde ikke afsløret nogen neoplastiske celler. Tre monoklonale antistoffer (anti-CEA, Ca1 og HMFG-2) blev brugt til at søge efter maligne celler. Immuncytokemisk mærkning blev udført på ufarvede udstrygninger, som var blevet opbevaret ved -20 ° C i op til 18 måneder. Tolv af de 41 tilfælde, hvor der blev udført immuncytokemisk farvning, afslørede maligne celler. Resultatet repræsenterede en stigning i diagnostisk nøjagtighed på ca. 20%. Undersøgelsen konkluderede, at immuncytokemisk mærkning hos patienter med mistanke om ondartet sygdom burde anvendes rutinemæssigt til undersøgelse af cytologisk negative prøver og har vigtige implikationer med hensyn til patienthåndtering.
En anden anvendelse af immuncytokemisk farvning er til påvisning af to antigener i samme udstrygning. Dobbeltfarvning med letkædede antistoffer og med T- og B-cellemarkører kan indikere et lymfoms neoplastiske oprindelse.
En undersøgelse har rapporteret isoleringen af en hybridomacellelinie (klon 1E10), der producerer et monoklonalt antistof (IgM, k isotype). Dette monoklonale antistof viser specifik immunocytokemisk farvning af nucleoli.
Væv og tumorer kan klassificeres ud fra deres ekspression af visse markører ved hjælp af monoklonale antistoffer. De hjælper med at skelne mellem morfologisk lignende læsioner og ved bestemmelse af organ eller vævsoprindelse af udifferentierede metastaser. Immuncytologisk analyse af knoglemarv, vævsaspirater, lymfeknuder osv. Med udvalgte monoklonale antistoffer hjælper med påvisning af okkulte metastaser. Monoklonale antistoffer øger følsomheden ved påvisning af selv små mængder af invasive eller metastatiske celler. Monoklonale antistoffer (mAbs), der er specifikke for cytokeratiner, kan detektere disseminerede individuelle epiteltumorceller i knoglemarven.
Referencer
eksterne links
- Hybridomer på US National Library of Medicine Medical Subject Headings (MeSH)
- "Hybridomteknologi" . Forståelse af kræft-serien: Immunsystemet . National Cancer Institute . Arkiveret fra originalen den 5. oktober 2014.
- "Hybridomcellekultur" .