Radikal (kemi) - Radical (chemistry)
I kemi er en radikal et atom , molekyle eller ion, der har mindst en uparret valenselektron . Med nogle undtagelser gør disse uparede elektroner radikaler meget kemisk reaktive . Mange radikaler dimerer spontant . De fleste organiske radikaler har korte levetider.
Et bemærkelsesværdigt eksempel på en radikal er hydroxylradikalen (HO · ), et molekyle, der har en uparret elektron på oxygenatomet. To andre eksempler er triplet oxygen og triplet carbene ( ꞉ CH
2) som har to uparrede elektroner.
Radikale kan genereres på en række måder, men typiske metoder involverer redoxreaktioner . Ioniserende stråling , varme, elektriske udladninger og elektrolyse vides at producere radikaler. Radikale er mellemprodukter i mange kemiske reaktioner, mere end det fremgår af de afbalancerede ligninger.
Radikaler er vigtige i forbrænding , atmosfærisk kemi , polymerisation , plasmakemi , biokemi og mange andre kemiske processer. Et flertal af de naturlige produkter genereres af radikalt genererende enzymer. I levende organismer regulerer radikalerne superoxid og nitrogenoxid og deres reaktionsprodukter mange processer, såsom kontrol af vaskulær tone og dermed blodtryk. De spiller også en nøglerolle i formidlingen af forskellige biologiske forbindelser. Sådanne radikaler kan endda være budbringere i en proces kaldet redox -signalering . En radikal kan være fanget i et opløsningsmiddelbur eller på anden måde være bundet.
Dannelse
Radikaler er enten (1) dannet af spin-parrede molekyler eller (2) fra andre radikaler. Radikaler dannes fra spin-parrede molekyler gennem homolyse af svage bindinger eller elektronoverførsel, også kendt som reduktion. Radikaler dannes fra andre radikaler gennem substitutions-, additions- og eliminationsreaktioner.
Radikal dannelse fra spin-parrede molekyler
Homolyse
Homolyse danner to nye radikaler fra et spinparret molekyle ved at bryde en kovalent binding og efterlade hvert af fragmenterne med en af elektronerne i bindingen. Fordi brud på en kemisk binding kræver energi, forekommer homolyse under tilsætning af varme eller lys. Den bond dissociation energi forbundet med homolysis afhænger af stabiliteten af en given forbindelse, og nogle svage bindinger kan homolyze ved relativt lavere temperaturer.
Nogle homolysereaktioner er særlig vigtige, fordi de fungerer som en initiator for andre radikale reaktioner. Et sådant eksempel er homolyse af halogener, som forekommer under lys og fungerer som drivkraft for radikale halogeneringsreaktioner.
En anden bemærkelsesværdig reaktion er homolysen af dibenzoylperoxid, hvilket resulterer i dannelsen af to benzoyloxyradikaler og fungerer som en initiator for mange radikale reaktioner.
Reduktion
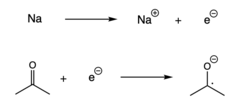
Radikaler kan også dannes, når en enkelt elektron tilsættes til et spinparret molekyle, hvilket resulterer i en elektronoverførsel. Denne reaktion, også kaldet reduktion, finder normalt sted med et alkalimetal, der donerer en elektron til et andet spinparret molekyle.
Radikal dannelse fra andre radikaler
Abstraktion
Hydrogenabstraktion beskriver, når et hydrogenatom fjernes fra et hydrogendonormolekyle (f.eks. Tin eller siliciumhydrid) med dets ene elektron. Abstraktion producerer en ny radikal og et nyt spinparret molekyle. Dette adskiller sig fra homolyse, hvilket resulterer i to radikaler fra et enkelt spinparret molekyle og ikke inkluderer en radikal som sin reaktant. Hydrogenabstraktion er en grundlæggende proces inden for radikal kemi, fordi den fungerer som det sidste forplantningstrin i mange kemiske reaktioner og omdanner carbonradikaler til stabile molekyler. Figuren til højre viser en radikal abstraktion mellem en benzoyloxygruppe og et hydrogenbromidmolekyle, hvilket resulterer i produktion af et benzoesyremolekyle og et bromradikal.
Tilføjelse
Radikal tilføjelse beskriver, når en radikal tilføjes til et spinparret molekyle for at danne en ny radikal. Figuren til højre viser tilsætning af en bromradikal til en alken. Radikal tilsætning følger Anti -Markovnikov -reglen , hvor substituenten sættes til det mindre substituerede carbonatom.
Eliminering
Radikal eliminering kan ses som omvendt af radikal tilsætning. Ved radikal eliminering nedbrydes en ustabil radikal forbindelse i et spinparret molekyle og en ny radikal forbindelse. Nedenfor er vist et eksempel på en radikal eliminationsreaktion, hvor et benzoyloxy -radikal nedbrydes til en phenylradikal og et carbondioxidmolekyle.
Stabilitet
Stabilitet af organiske radikaler

Selvom organiske radikaler generelt er stabile i sig selv, er deres eksistens praktisk talt kun forbigående, fordi de har en tendens til at dimere. Nogle har en ganske lang levetid. Generelt stabiliseres organiske radikaler af en eller alle disse faktorer: tilstedeværelse af elektronegativitet, delokalisering og sterisk hindring. Forbindelsen 2,2,6,6-tetramethylpiperidinyloxyl illustrerer kombinationen af alle tre faktorer. Det er et kommercielt tilgængeligt fast stof, der bortset fra at være magnetisk, opfører sig som en normal organisk forbindelse.
Elektronegativitet
Organiske radikaler er iboende elektronmangel, og jo større elektronegativitet det atom har, hvor den uparrede elektron befinder sig, desto mindre stabil er radikalen. Mellem kulstof, nitrogen og ilt er kulstof for eksempel den mest stabile og ilt den mindst stabile.
Elektronegativitet påvirker også stabiliteten af carbonatomer i forskellige hybridiseringer. Større s-karakter korrelerer med højere elektronegativitet af carbonatomet (på grund af s orbitalers nærhed til kernen), og jo større elektronegativiteten er, desto mindre stabil er en radikal. Sp-hybridiserede carbonatomer (50% s-karakter) danner de mindst stabile radikaler sammenlignet med sp3-hybridiserede carbonatomer (25% s-karakter), der danner de mest stabile radikaler.
Delokalisering
Delokaliseringen af elektroner på tværs af strukturen af en radikal, også kendt som dens evne til at danne en eller flere resonansstrukturer, gør det muligt for elektronmangel at spredes over flere atomer, hvilket minimerer ustabilitet. Delokalisering sker sædvanligvis i nærvær af elektrondonerende grupper, såsom hydroxylgrupper (-OH), ethere (-OR), tilstødende alkener og aminer (-NH2 eller -NR) eller elektron-tilbagetrækningsgrupper, såsom C = O eller C≡N.
Delokaliseringseffekter kan også forstås ved hjælp af molekylær orbitalteori som en linse, mere specifikt ved at undersøge den intramolekylære interaktion mellem den uparrede elektron med en donationsgruppes par elektroner eller den tomme π* orbital i en elektron-tilbagetrækningsgruppe i form af en molekylært kredsløbsdiagram. HOMO'en for en radikal er besat enkeltvis, derfor omtales orbitalen passende som SOMO eller Singly-Occupied Molecular Orbital. For en elektrondonerende gruppe interagerer SOMO med det ensomme par med lavere energi for at danne en ny lavere energifyldt bindingsorbital og en enkeltfyldt ny SOMO, højere i energi end originalen. Mens energien i den uparrede elektron er steget, opvejer faldet i energi fra det ensomme par, der danner det nye bindingsorbitale, stigningen i energi i den nye SOMO, hvilket resulterer i et netto fald i molekylets energi. Derfor hjælper elektron-donerende grupper med at stabilisere radikaler.
Med en gruppe, der i stedet er elektron-tilbagetrækning, interagerer SOMO derefter med den tomme π* orbital. Der er ingen elektroner, der optager den højere energi, der dannes, mens en ny SOMO dannes, der er lavere i energi. Dette resulterer i en lavere energi og højere stabilitet for de radikale arter. Både donationsgrupper og tilbagetrækningsgrupper stabiliserer radikaler.
En anden velkendt omend svagere form for delokalisering er hyperkonjugering . I radikal kemi stabiliseres radikaler ved hyperkonjugering med tilstødende alkylgrupper. Donationen af sigma (σ) CH -bindinger i de delvist tomme radikale orbitaler hjælper med at differentiere radikalernes stabilitet på tertiære, sekundære og primære carbonatomer. Tertiære carbonradikaler har tre σ CH -bindinger, der donerer, sekundære radikaler kun to og primære radikaler kun en. Derfor er tertiære radikaler de mest stabile og primære radikaler de mindst stabile.
Sterisk hindring

Simpelthen, jo større den steriske hindring er, desto vanskeligere er det for reaktioner at finde sted, og den radikale form favoriseres som standard. For eksempel sammenlign den hydrogenabstrakte form af N-Hydroxypiperidin med molekylet TEMPO . TEMPO, eller (2,2,6,6-Tetramethylpiperidin-1-yl) oxyl, er for sterisk forhindret af de yderligere methylgrupper til at reagere, hvilket gør den stabil nok til at blive solgt kommercielt i sin radikale form. N-Hydroxypiperidin har imidlertid ikke de fire methylgrupper til at hæmme vejen for et reagerende molekyle, så strukturen er ustabil.
Facile H-atom donorer
Stabiliteten af mange (eller de fleste) organiske radikaler er ikke indiceret ved deres isolability men er manifesteret i deres evne til at fungere som donorer af H . . Denne egenskab afspejler en svækket binding til hydrogen, normalt OH, men undertiden NH eller CH. Denne adfærd er vigtig, fordi disse H . donorer fungerer som antioxidanter i biologi og i handel. Illustrerende er α-tocopherol ( E-vitamin ). Selve tocopherolradikalen er utilstrækkelig stabil til isolering, men modermolekylet er en yderst effektiv H-atomdonor. CH -bindingen svækkes i triphenylmethyl (trityl) derivater.

Uorganiske radikaler
En lang række uorganiske radikaler er stabile og faktisk isolerbare. Eksempler omfatter de fleste første række-overgangsmetalkomplekser.
Med hensyn til hovedgrupperadikaler er den mest udbredte radikal i universet også den mest udbredte kemikalie i universet, H · . De fleste hovedgrupperadikaler er imidlertid ikke isolerbare på trods af deres iboende stabilitet. Hydrogenradikaler for eksempel kombinere ivrigt til formular H 2 . Nitrogenoxid (NO) er et velkendt eksempel på en isolerbar uorganisk radikal. Fremys salt (Kaliumnitrosodisulfonat, (KSO 3 ) 2 NO) er et beslægtet eksempel. Mange thiazyl grupper er kendte, trods begrænset omfang af π resonans stabilisering .
Mange radikaler kan forestilles som produkterne til brud på kovalente bindinger ved homolyse . De homolytiske bond dissociation energier , sædvanligvis forkortet som "Δ H °" er et mål for bindingsstyrke. Opsplitning H 2 ind 2H · , kræver for eksempel en Δ H ° af 435 k J · mol -1 , mens splitting Cl 2 i to Cl · kræver en Δ H ° af 243 kJ · mol -1 . For svage bindinger kan homolyse induceres termisk. Stærke bindinger kræver fotoner med høj energi eller endda flammer for at fremkalde homolyse.
Diradicals
Diradicals er molekyler, der indeholder to radikale centre. Dioxygen (O 2 ) er det førende eksempel på en stabil diradical. Singlet oxygen , den laveste energi ikke-radikale tilstand af dioxygen, er mindre stabil end diradical på grund af Hunds regel om maksimal multiplicitet . Den relative stabilitet af iltdiradicalen skyldes primært den spin-forbudte karakter af triplet-singlet-overgangen, der kræves for at den kan gribe elektroner, dvs. " oxidere". Den diradiske ilttilstand resulterer også i dens paramagnetiske karakter, hvilket demonstreres ved dets tiltrækning til en ekstern magnet. Diradicals kan også forekomme i metal- oxokomplekser , der låner sig til undersøgelser af spin forbudte reaktioner i overgangsmetalkemi . Carbener i deres triplet-tilstand kan ses som diradicals centreret om det samme atom, mens disse normalt er meget reaktive persistente carbener er kendt, hvor N-heterocykliske carbener er det mest almindelige eksempel.
Triplet carbener og nitrener er diradicals . Deres kemiske egenskaber adskiller sig fra egenskaberne ved deres singletanaloger.
Forekomst af radikaler
Forbrænding
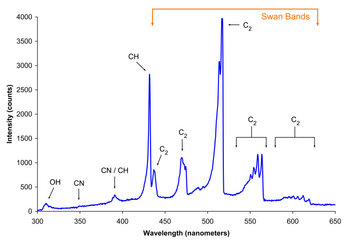
En velkendt radikal reaktion er forbrænding . Den ilt molekyle er en stabil diradikal , bedst repræsenteret af · OO · . Fordi elektronernes spin er parallelle, er dette molekyle stabilt. Mens iltets jordtilstand er denne ureaktive spin-uparrede ( triplet ) diradical, er der en ekstremt reaktiv spin-parret ( singlet ) tilstand tilgængelig. For at forbrænding kan forekomme, skal energibarrieren mellem disse overvindes. Denne barriere kan overvindes af varme, der kræver høje temperaturer. Triplet-singlet-overgangen er også " forbudt ". Dette er en yderligere barriere for reaktionen. Det betyder også, at molekylært oxygen er relativt ureaktivt ved stuetemperatur undtagen i nærvær af et katalytisk tungt atom, såsom jern eller kobber.
Forbrænding består af forskellige radikale kædereaktioner, som singletradikalen kan starte. Den brændbarhed af et givet materiale afhænger stærkt af koncentrationen af radikaler, der skal indhentes, før initierings- og propageringsreaktioner dominerer førende til forbrænding af materialet. Når det brændbare materiale er blevet forbrugt, dominerer afslutningsreaktioner igen, og flammen dør ud. Som angivet ændrer promovering af formerings- eller afslutningsreaktioner antændelighed. For eksempel, fordi bly i sig selv deaktiverer radikaler i benzin-luft-blandingen, blev tetraethyl bly engang almindeligt tilsat til benzin. Dette forhindrer forbrændingen i at starte på en ukontrolleret måde eller i uforbrændte rester ( motoren banker ) eller for tidlig tænding ( forbrænding ).
Når et kulbrinte brændes, er et stort antal forskellige iltradikaler involveret. I første omgang dannes hydroperoxylradikal (HOO ·). Disse reagerer derefter yderligere for at give organiske hydroperoxider, der brydes op i hydroxylradikaler (HO ·).
Polymerisering
Mange polymerisationsreaktioner initieres af radikaler. Polymerisation involverer en indledende radikal tilføjelse til ikke-radikal (normalt en alken) for at give nye radikaler. Denne proces er grundlaget for den radikale kædereaktion . Polymeriseringsteknikken indebærer den metode, hvormed den initierende radikal indføres. For eksempel kan methylmethacrylat (MMA) polymeriseres for at producere poly (methylmethacrylat) (PMMA - plexiglas eller Perspex) via en gentagende række radikale additionstrin :
Nyere radikalpolymerisationsmetoder er kendt som levende radikalpolymerisation . Varianter inkluderer reversibel additionsfragmenteringskædeoverførsel ( RAFT ) og atomoverføringsradikalpolymerisering ( ATRP ).
Som en udbredt radikal reagerer O 2 med mange organiske forbindelser for at generere radikaler sammen med hydroperoxidradikalen . Tørreolier og alkydmaling hærder på grund af radikal tværbinding initieret af ilt fra atmosfæren.
Atmosfæriske radikaler
Den mest almindelige radikal i den nedre atmosfære er molekylær dioxygen. Fotodissociation af kildemolekyler producerer andre radikaler. I den lavere atmosfære produceres vigtig radikal ved fotodissociation af nitrogendioxid til et oxygenatom og nitrogenoxid (se ligning 1. 1 nedenfor), som spiller en central rolle i smogdannelse - og fotodissociationen af ozon for at give de ophidsede oxygenatom O (1D) (se ligning 1. 2 nedenfor). Netto- og returreaktionerne vises også ( hhv. Ligning 1, 3 og ligning 1, 4 ).
-
( ligning 1. 1 )
-
( ligning 1. 2 )
-
( ligning 1. 3 )
-
( ligning 1. 4 )
I den øvre atmosfære er fotodissociationen af normalt ureaktive chlorfluorcarboner (CFC'er) ved ultraviolet stråling fra solen en vigtig kilde til radikaler (se ligning 1 nedenfor). Disse reaktioner giver chlor -radikal, Cl · , som katalyserer omdannelsen af ozon til O 2 og således lette ozonnedbrydning ( eq 2. 2. - . Ækv 2. 4 nedenfor).
-
( ligning 2. 1 )
-
( ligning 2. 2 )
-
( ligning 2. 3 )
-
( ligning 2. 4 )
-
( ligning 2. 5 )
Sådanne reaktioner forårsager nedbrydning af ozonlaget , især da chlorradikalen er fri til at engagere sig i en anden reaktionskæde; brugen af chlorfluorcarboner som kølemiddel er derfor blevet begrænset.
I biologi

Radikale spiller en vigtig rolle i biologien. Mange af disse er nødvendige for livet, såsom intracellulært dræb af bakterier af fagocytiske celler, såsom granulocytter og makrofager . Radikale er involveret i cellesignaleringsprocesser , kendt som redox -signalering . For eksempel producerer radikalt angreb af linolsyre en række 13-hydroxyoctadecadienoinsyrer og 9-hydroxyoctadecadienoinsyrer , som kan virke til at regulere lokaliserede vævsinflammatoriske og/eller helbredende reaktioner, smerteopfattelse og spredning af maligne celler. Radikale angreb på arachidonsyre og docosahexaensyre producerer en lignende, men bredere vifte af signalprodukter.
Radikale kan også være involveret i Parkinsons sygdom , senil og lægemiddelinduceret døvhed , skizofreni og Alzheimers . Det klassiske frie radikalsyndrom, jernlagringssygdommen hæmokromatose , er typisk forbundet med en konstellation af frie radikalerelaterede symptomer, herunder bevægelsesforstyrrelse, psykose, hudpigmentære melaninabnormiteter , døvhed, gigt og diabetes mellitus. Den frie radikaler teori om aldring foreslår, at radikale ligger til grund for modningen selv. Tilsvarende processen med mito hormesis antyder, at gentagen udsættelse for radikaler kan forlænge levetiden.
Fordi radikaler er nødvendige for livet, har kroppen en række mekanismer til at minimere radikalinduceret skade og reparere skader, der opstår, såsom enzymerne superoxiddismutase , katalase , glutathionperoxidase og glutathionreduktase . Desuden spiller antioxidanter en central rolle i disse forsvarsmekanismer. Disse er ofte den tre vitaminer, vitamin A , vitamin C og E-vitamin og polyphenol antioxidanter . Desuden er der god dokumentation for, at bilirubin og urinsyre kan fungere som antioxidanter for at hjælpe med at neutralisere visse radikaler. Bilirubin kommer fra nedbrydning af de røde blodlegemers indhold, mens urinsyre er et nedbrydningsprodukt af puriner . For meget bilirubin kan dog føre til gulsot , som i sidste ende kan skade centralnervesystemet, mens for meget urinsyre forårsager gigt .
Reaktive oxygenarter
Reaktive iltarter eller ROS er arter såsom superoxid , hydrogenperoxid og hydroxylradikal , der normalt er forbundet med celleskader. ROS dannes som et naturligt biprodukt af det normale metabolisme af ilt og har vigtige roller i cellesignalering. To vigtige iltcentrerede radikaler er superoxid og hydroxylradikal . De stammer fra molekylær ilt under reducerende betingelser. På grund af deres reaktivitet kan de samme radikaler imidlertid deltage i uønskede sidereaktioner, der resulterer i celleskader. For store mængder af disse radikaler kan føre til celleskade og død , hvilket kan bidrage til mange sygdomme som kræft , slagtilfælde , myokardieinfarkt , diabetes og større lidelser. Mange former for kræft menes at være resultatet af reaktioner mellem radikaler og DNA , hvilket potentielt kan resultere i mutationer, der kan påvirke cellecyklussen negativt og potentielt føre til malignitet. Nogle af symptomerne på ældning, såsom åreforkalkning , tilskrives også radikal induceret oxidation af kolesterol til 7-ketocholesterol. Ud grupper bidrager til alkohol -induceret lever- beskadigelse, måske mere end selve alkohol. Radikaler produceret af cigaret røg er impliceret i inaktivering af alfa 1-antitrypsin i lungen . Denne proces fremmer udviklingen af emfysem .
Oxybenzone har vist sig at danne radikaler i sollys, og kan derfor også være forbundet med celleskader. Dette skete kun, når det blev kombineret med andre ingredienser, der sædvanligvis findes i solcremer, såsom titaniumoxid og octylmethoxycinnamat .
ROS angriber den flerumættede fedtsyre , linolsyre , for at danne en række 13-hydroxyoctadecadienoinsyre og 9-hydroxyoctadecadienoinsyreprodukter, der fungerer som signalmolekyler, der kan udløse reaktioner, der modvirker den vævsskade, der forårsagede deres dannelse. ROS angriber andre flerumættede fedtsyrer, f.eks. Arachidonsyre og docosahexaensyre , for at producere en lignende serie af signalprodukter.
Historie og nomenklatur

Indtil sidst i det 20. århundrede blev ordet "radikal" brugt i kemi til at angive enhver forbundet gruppe af atomer, såsom en methylgruppe eller en carboxyl , uanset om det var en del af et større molekyle eller et molekyle alene. Kvalifikatoren "gratis" var derefter nødvendig for at angive den ubundne sag. Efter de seneste nomenklaturrevisioner kaldes en del af et større molekyle nu for en funktionel gruppe eller substituent , og "radikal" indebærer nu "fri". Den gamle nomenklatur kan dog stadig forekomme i nogle bøger.
Begrebet radikal var allerede i brug, da den nu forældede radikale teori blev udviklet. Louis-Bernard Guyton de Morveau introducerede udtrykket "radikal" i 1785, og udtrykket blev ansat af Antoine Lavoisier i 1789 i hans Traité Élémentaire de Chimie . En radikal blev derefter identificeret som rodbasen for visse syrer (det latinske ord "radix", der betyder "rod"). Historisk set blev udtrykket radikal i radikal teori også brugt til bundne dele af molekylet, især når de forbliver uændrede i reaktioner. Disse kaldes nu funktionelle grupper . For eksempel blev methylalkohol beskrevet som bestående af en methyl "radikal" og en hydroxyl "radikal". Det er heller ikke radikaler i moderne kemisk forstand, da de er permanent bundet til hinanden og ikke har uparrede, reaktive elektroner; de kan imidlertid observeres som radikaler i massespektrometri, når de brydes fra hinanden ved bestråling med energiske elektroner.
I en moderne sammenhæng den første organisk (carbonholdig) gruppe identificeret var triphenylmethyl gruppe , (C 6 H 5 ) 3 C · . Denne art blev opdaget af Moses Gomberg i 1900. I 1933 foreslog Morris S. Kharasch og Frank Mayo , at frie radikaler var ansvarlige for anti-Markovnikov-tilsætning af hydrogenbromid til allylbromid .
På de fleste kemiske områder hævder den historiske definition af radikaler, at molekylerne har elektron -spin uden nul. I felter, herunder spektroskopi , kemisk reaktion og astrokemi , er definitionen dog lidt anderledes. Gerhard Herzberg , der vandt Nobelprisen for sin forskning i radikalers elektronstruktur og geometri, foreslog en løsere definition af frie radikaler: "enhver forbigående (kemisk ustabil) art (atom, molekyle eller ion)". Hovedpunktet i hans forslag er, at der er mange kemisk ustabile molekyler, der har nul -spin, såsom C 2 , C 3 , CH 2 og så videre. Denne definition er mere praktisk til diskussioner om forbigående kemiske processer og astrokemi; derfor foretrækker forskere inden for disse felter at bruge denne løse definition.
Skildring i kemiske reaktioner
I kemiske ligninger betegnes radikaler ofte med en prik placeret umiddelbart til højre for atomsymbolet eller molekylformlen som følger:
Radikale reaktionsmekanismer bruger enhovede pile til at skildre bevægelsen af enkelte elektroner:
Den homolytiske spaltning af brydningsbåndet tegnes med en 'fiskekrog' pil for at skelne fra den sædvanlige bevægelse af to elektroner afbildet af en standard krøllet pil. Den anden elektron i brudbåndet bevæger sig også for at parre sig med den angribende radikale elektron; dette er ikke udtrykkeligt angivet i denne sag.
Radikale deltager også i radikal tilsætning og radikal substitution som reaktive mellemprodukter . Kædereaktioner, der involverer radikaler, kan normalt opdeles i tre forskellige processer. Disse er initiering , formering og afslutning .
- Indledningsreaktioner er dem, der resulterer i en nettostigning i antallet af radikaler. De kan involvere dannelse af radikaler fra stabile arter som i reaktion 1 ovenfor, eller de kan involvere reaktioner af radikaler med stabile arter for at danne flere radikaler.
- Formeringsreaktioner er de reaktioner, der involverer radikaler, hvor det samlede antal radikaler forbliver det samme.
- Afslutningsreaktioner er de reaktioner, der resulterer i et netto fald i antallet af radikaler. Typisk to grupper kombineres til dannelse af en mere stabil art, for eksempel: 2Cl · → Cl 2
Se også
- Elektronpar
- Globalt harmoniseret system for klassificering og mærkning af kemikalier
- Hofmann – Löffler -reaktion
- Forskning i frie radikaler











![{\ displaystyle {\ ce {NO2 -> [h \ nu] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da627b27ee3e5b4dc45b156c54a91e1d79ffbd1)

![{\ displaystyle {\ ce {NO2 + O2 -> [h \ nu] NO + O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eae7fc4c91c01822b8db1423a88911a1eb56a171)

![{\ displaystyle {\ ce {CFCS -> [h \ nu] Cl.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcc02008a4a0f755ebbd69f8cfaf0ddfcfb751ac)

![{\ displaystyle {\ ce {O3 -> [h \ nu] O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1)

![{\ displaystyle {\ ce {2O3 -> [h \ nu] 3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40)


