Adhæsion - Adhesion
| Del af en serie om |
| Kontinuummekanik |
|---|
| : |

Proces for fastgørelse af et stof til overfladen af et andet stof.
Note 1 : Adhæsion kræver energi, der kan komme fra kemiske og/eller fysiske
forbindelser, idet sidstnævnte er reversibel, når der bruges tilstrækkelig energi.Note 2 : I biologi afspejler vedhæftning cellens adfærd kort tid efter kontakt
med overfladen.Note 3 : Ved kirurgi bruges vedhæftning, når to væv uventet smelter sammen.
Adhæsion er tendensen til, at forskellige partikler eller overflader klæber til hinanden ( samhørighed refererer til tendensen fra lignende eller identiske partikler/overflader til at klæbe til hinanden).
De kræfter, der forårsager vedhæftning og samhørighed, kan opdeles i flere typer. De intermolekylære kræfter, der er ansvarlige for forskellige former for klistermærker og klæbende tape, falder ind under kategorierne kemisk vedhæftning , dispersiv vedhæftning og diffus vedhæftning . Ud over de kumulative størrelser af disse intermolekylære kræfter er der også visse nye mekaniske virkninger .
Overflade energi
Overfladeenergi er konventionelt defineret som det arbejde , der kræves for at bygge et område af en bestemt overflade . En anden måde at se overfladeenergien på er at relatere den til det arbejde, der kræves for at spalte en bulkprøve, hvilket skaber to overflader. Hvis de nye overflader er identiske, er overfladenergien γ for hver overflade lig med halvdelen af spaltningsarbejdet, W: γ = (1/2) W 11 .
Hvis overfladerne er ulige, gælder Young-Dupré-ligningen : W 12 = γ 1 + γ 2 -γ 12 , hvor γ 1 og γ 2 er overfladeenergierne på de to nye overflader, og γ 12 er grænsefladeenergien.
Denne metode kan også bruges til at diskutere spaltning, der sker i et andet medium: γ 12 = (1/2) W 121 = (1/2) W 212 . Disse to energimængder refererer til den energi, der er nødvendig for at spalte en art i to stykker, mens den er indeholdt i et medium af de andre arter. På samme måde for et treartsystem: γ 13 + γ 23 - γ 12 = W 12 + W 33 - W 13 - W 23 = W 132 , hvor W 132 er energien fra spaltning af arter 1 fra art 2 i et medium af art 3 .
En grundlæggende forståelse af terminologien for spaltningsenergi , overfladeenergi og overfladespænding er meget nyttig til at forstå den fysiske tilstand og de begivenheder, der sker på en given overflade, men som diskuteret nedenfor giver teorien om disse variabler også nogle interessante effekter, som vedrører det praktiske ved klæbende overflader i forhold til deres omgivelser.
Mekanismer
Der er ingen enkelt teori om vedhæftning, og bestemte mekanismer er specifikke for bestemte materialescenarier. Fem adhæsionsmekanismer er blevet foreslået for at forklare, hvorfor et materiale klæber til et andet:
Mekanisk
Klæbende materialer fylder hulrum eller porer på overfladerne og holder overflader sammen ved at låse hinanden sammen . Andre sammenlåsende fænomener observeres på forskellige længder. Syning er et eksempel på to materialer, der danner en stor mekanisk binding, velcro danner et i mellemstor skala, og nogle tekstilklæbemidler (lim) danner et i lille skala.
Kemisk
To materialer kan danne en forbindelse ved leddet. De stærkeste led er, hvor atomer i de to materialer deler eller bytter elektroner (henholdsvis kendt som kovalent binding eller ionisk binding ). En svagere binding dannes, hvis et hydrogenatom i et molekyle tiltrækkes til et atom af nitrogen , ilt eller fluor i et andet molekyle, et fænomen kaldet hydrogenbinding .
Kemisk adhæsion opstår, når overfladeatomer på to separate overflader danner ioniske, kovalente eller hydrogenbindinger. Det tekniske princip bag kemisk adhæsion i denne forstand er ret ligetil: Hvis overflademolekyler kan bindes, vil overfladerne blive bundet sammen af et netværk af disse bindinger. Det skal nævnes, at disse attraktive ioniske og kovalente kræfter kun er effektive over meget små afstande - mindre end et nanometer . Dette betyder generelt ikke kun, at overflader med potentiale for kemisk binding skal bringes meget tæt sammen, men også at disse bindinger er ret sprøde, da overfladerne derefter skal holdes tæt sammen.
Spredt
Ved dispergerende adhæsion, også kendt som fysisorption , holdes to materialer sammen af van der Waals kræfter : tiltrækningen mellem to molekyler, der hver har et område med let positiv og negativ ladning. I det enkle tilfælde er sådanne molekyler derfor polære med hensyn til gennemsnitlig ladningstæthed , selvom der i større eller mere komplekse molekyler kan være flere "poler" eller områder med større positiv eller negativ ladning. Disse positive og negative poler kan være en permanent egenskab af et molekyle ( Keesom -kræfter ) eller en forbigående virkning, som kan forekomme i ethvert molekyle, da elektronernes tilfældige bevægelse inden for molekylerne kan resultere i en midlertidig koncentration af elektroner i et område ( London kræfter ).


I overfladevidenskab refererer udtrykket adhæsion næsten altid til dispersiv vedhæftning. I et typisk fast-væske-gassystem (såsom en dråbe væske på et fast stof omgivet af luft) bruges kontaktvinklen til at evaluere vedhæftningsevne indirekte, mens en centrifugal adhæsionsbalance giver mulighed for direkte kvantitative vedhæftningsmålinger. Generelt betragtes tilfælde, hvor kontaktvinklen er lav, for større vedhæftning pr. Arealenhed. Denne tilgang antager, at den lavere kontaktvinkel svarer til en højere overfladeenergi. Teoretisk set er det mere præcise forhold mellem kontaktvinkel og vedhæftningsarbejde mere involveret og er givet ved Young-Dupre-ligningen . Trefasesystemets kontaktvinkel er ikke kun en funktion af dispersiv adhæsion (interaktion mellem molekylerne i væsken og molekylerne i det faste stof), men også samhørighed (interaktion mellem væskemolekylerne selv). Stærk vedhæftning og svag samhørighed resulterer i en høj grad af befugtning , en lyofil tilstand med lave målte kontaktvinkler. Omvendt resulterer svag vedhæftning og stærk samhørighed i lyofobe forhold med høje målte kontaktvinkler og dårlig befugtning.
London dispersionskræfter er særligt nyttige til funktionen af klæbemiddelanordninger , fordi de ikke kræver nogen af overfladerne for at have permanent polaritet. De blev beskrevet i 1930'erne af Fritz London , og er blevet observeret af mange forskere. Dispersive kræfter er en konsekvens af statistisk kvantemekanik . London teoretiserede, at attraktive kræfter mellem molekyler, der ikke kan forklares ved ionisk eller kovalent interaktion, kan skyldes polære øjeblikke inden for molekyler. Multipoler kunne stå for tiltrækning mellem molekyler, der har permanente multipolmomenter, der deltager i elektrostatisk interaktion . Eksperimentelle data viste imidlertid, at mange af de forbindelser, der blev observeret for at opleve van der Waals -kræfter, slet ikke havde multipol. London foreslog, at øjeblikkelige dipoler induceres rent i kraft af molekyler, der er i nærheden af hinanden. Ved at løse det kvantemekaniske system af to elektroner som harmoniske oscillatorer i en vis begrænset afstand fra hinanden, blive forskudt omkring deres respektive hvilestillinger og interagere med hinandens felter, viste London, at energien i dette system er givet ved:
Mens det første udtryk simpelthen er nulpunktsenergien , beskriver det negative andet udtryk en attraktiv kraft mellem tilstødende oscillatorer. Det samme argument kan også udvides til at omfatte et stort antal koblede oscillatorer, og dermed undgår man problemer, der især ville negere de store attraktive virkninger af permanente dipoler, der annulleres gennem symmetri.
Den additive karakter af dispersionseffekten har en anden nyttig konsekvens. Overvej en enkelt sådan dispersiv dipol , kaldet oprindelsesdipolen. Da enhver oprindelsesdipol i sig selv er orienteret for at blive tiltrukket af de tilstødende dipoler, den inducerer, mens de andre, mere fjerne dipoler ikke er korreleret med den oprindelige dipol af nogen faseforhold (dermed i gennemsnit ikke bidrager med noget), er der en netto attraktiv kraft i en masse af sådanne partikler. Når man overvejer identiske partikler, kaldes dette kohesionskraft.
Når man diskuterer vedhæftning, skal denne teori konverteres til termer vedrørende overflader. Hvis der er en netto attraktiv energi af kohæsion i en masse af lignende molekyler, vil spaltning af denne masse til at producere to overflader give overflader med en dispergerende overfladeenergi, da energiens form forbliver den samme. Denne teori danner grundlag for eksistensen af van der Waals -kræfter på overfladen, som findes mellem alle molekyler, der har elektroner . Disse kræfter observeres let ved spontan springning af glatte overflader i kontakt . Glatte overflader af glimmer , guld, forskellige polymerer og faste gelatineløsninger holder sig ikke fra hinanden, når deres adskillelse bliver lille nok - i størrelsesordenen 1-10 nm. Ligningen, der beskriver disse attraktioner, blev forudsagt i 1930'erne af De Boer og Hamaker:
hvor P er kraften (negativ for tiltrækning), z er separationsafstanden, og A er en materialespecifik konstant kaldet Hamaker-konstanten .

Effekten er også tydelig i forsøg, hvor der laves et polydimethylsiloxan (PDMS) -stempel med små periodiske poststrukturer. Overfladen med stolperne placeres med forsiden nedad på en glat overflade, således at overfladearealet mellem hver stolpe er hævet over den glatte overflade, som et tag understøttet af søjler. På grund af disse attraktive spredende kræfter mellem PDMS og det glatte substrat, falder den forhøjede overflade - eller “tag” - ned på substratet uden nogen ydre kraft bortset fra van der Waals attraktion. Enkle glatte polymeroverflader - uden nogen mikrostrukturer - bruges almindeligvis til disse dispergerende klæbeegenskaber. Mærkater og klistermærker, der klæber til glas uden brug af kemiske klæbemidler, er ret almindelige som legetøj og dekorationer og nyttige som aftagelige etiketter, fordi de ikke hurtigt mister deres klæbeegenskaber, ligesom klæbende bånd, der bruger klæbende kemiske forbindelser.
Det er vigtigt at bemærke, at disse kræfter også virker over meget små afstande - 99% af det arbejde, der er nødvendigt for at bryde van der Waals -bindinger, udføres, når overflader er trukket mere end et nanometer fra hinanden. Som et resultat af denne begrænsede bevægelse i både van der Waals og ioniske/kovalente bindingssituationer efterlader praktisk vedhæftningseffektivitet på grund af enten eller begge disse interaktioner meget at ønske. Når først en revne er påbegyndt, formerer den sig let langs grænsefladen på grund af grænsefladebindingernes sprøde karakter.
Som en yderligere konsekvens øger det øgede overfladeareal ofte lidt for at øge vedhæftningens styrke i denne situation. Dette følger af den førnævnte revnsvigt - spændingen ved grænsefladen er ikke ensartet fordelt, men snarere koncentreret på området for fejl.
Elektrostatisk
Nogle ledende materialer kan passere elektroner for at danne en forskel i elektrisk ladning ved leddet. Dette resulterer i en struktur, der ligner en kondensator og skaber en attraktiv elektrostatisk kraft mellem materialerne.
Spredende
Nogle materialer kan smelte sammen ved leddet ved diffusion . Dette kan forekomme, når molekylerne i begge materialer er mobile og opløselige i hinanden. Dette ville være særligt effektivt med polymerkæder, hvor den ene ende af molekylet diffunderer ind i det andet materiale. Det er også mekanismen involveret i sintring . Når metal- eller keramikpulvere presses sammen og opvarmes, diffunderer atomer fra den ene partikel til den næste. Dette forbinder partiklerne til en.
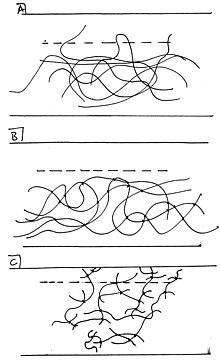
Spredningskræfter ligner lidt mekanisk binding på molekylært niveau. Diffusiv binding opstår, når arter fra en overflade trænger ind i en tilstødende overflade, mens de stadig er bundet til fasen af deres oprindelsesoverflade. Et lærerigt eksempel er det på polymer-på-polymer-overflader. Diffusiv binding i polymer-på-polymer-overflader er resultatet af sektioner af polymerkæder fra en overflade, der interdigiteres med dem på en tilstødende overflade. Bevægelsesfriheden for polymererne har en stærk effekt på deres evne til at interdigitere og dermed på diffus binding. For eksempel er tværbundne polymerer mindre i stand til diffusion og interdigitation, fordi de er bundet sammen på mange kontaktpunkter og ikke er frie til at sno sig ind i den tilstødende overflade. Ikke tværbundne polymerer ( termoplast ) er på den anden side friere til at vandre ind i den tilstødende fase ved at forlænge haler og sløjfer hen over grænsefladen.
En anden omstændighed, under hvilken diffus bonding opstår, er "scission". Kædespredning er opskæring af polymerkæder, hvilket resulterer i en højere koncentration af distale haler. Den øgede koncentration af disse kædeender giver anledning til en forhøjet koncentration af polymerhaler, der strækker sig over grænsefladen. Spaltning opnås let ved ultraviolet bestråling i nærvær af iltgas , hvilket tyder på, at klæbemiddelanordninger, der anvender diffus limning, faktisk drager fordel af langvarig udsættelse for varme/lys og luft. Jo længere en sådan enhed er udsat for disse forhold, jo flere haler bliver saksede og forgrener sig ud over grænsefladen.
Når de er på tværs af grænsefladen, danner halerne og sløjferne de bindinger, der er gunstige. I tilfælde af polymer-på-polymer-overflader betyder dette flere van der Waals-kræfter. Selvom disse kan være sprøde, er de ret stærke, når der dannes et stort netværk af disse bindinger. Det yderste lag af hver overflade spiller en afgørende rolle i de klæbende egenskaber ved sådanne grænseflader, da selv en lille mængde interdigitation - så lidt som en eller to haler på 1,25 ångstrømslængde - kan øge van der Waals -bindingerne med en størrelsesorden .
Styrke
Vedhæftningsstyrken mellem to materialer afhænger af, hvilken af de ovennævnte mekanismer, der opstår mellem de to materialer, og det overfladeareal, som de to materialer kommer i kontakt med. Materialer, der vådes mod hinanden, har en tendens til at have et større kontaktområde end dem, der ikke gør det. Befugtning afhænger af materialernes overfladeenergi.
Materialer med lav overfladeenergi, såsom polyethylen , polypropylen , polytetrafluorethylen og polyoxymethylen, er vanskelige at binde uden særlig overfladeforberedelse.
En anden faktor, der bestemmer styrken af en klæbende kontakt, er dens form. Klæbende kontakter med kompleks form begynder at løsne sig ved "kanterne" af kontaktområdet. Processen med ødelæggelse af klæbende kontakter kan ses i filmen.
Andre effekter
I samklang med de primære overfladekræfter beskrevet ovenfor er der flere omstændighedseffekter i spil. Selvom kræfterne hver især bidrager til størrelsen af vedhæftningen mellem overfladerne, spiller følgende en afgørende rolle for den samlede styrke og pålidelighed af en klæbemiddel.
Strengning
Stringing er måske den mest afgørende af disse effekter, og ses ofte på klæbende bånd. Strengning opstår, når en adskillelse af to overflader begynder, og molekyler ved grænsefladen broer ud over hullet, frem for at revne som selve grænsefladen. Den mest betydningsfulde konsekvens af denne effekt er tilbageholdenhed af revnen. Ved at tilvejebringe de ellers sprøde grænsefladebindinger med en vis fleksibilitet, kan de molekyler, der snor sig over hullet, stoppe revnen fra at forplante sig. En anden måde at forstå dette fænomen på er ved at sammenligne det med stresskoncentrationen på tidspunktet for fejl, der er nævnt tidligere. Da spændingen nu er spredt ud over et eller andet område, har spændingen på et givet tidspunkt mindre chance for at overvinde den samlede klæbende kraft mellem overfladerne. Hvis der opstår fejl ved en grænseflade, der indeholder et viskoelastisk klæbemiddel, og en revne forplanter sig, sker det ved en gradvis proces kaldet "fingering", snarere end en hurtig, sprød fraktur. Stringing kan gælde for både det diffusive bindingsregime og det kemiske bindingsregime. Strenge af molekyler, der bygger bro over kløften, ville enten være de molekyler, der tidligere havde diffunderet over grænsefladen eller det viskoelastiske klæbemiddel, forudsat at der var et betydeligt volumen af det ved grænsefladen.
Mikrostrukturer
Samspillet mellem molekylære skala -mekanismer og hierarkiske overfladestrukturer vides at resultere i høje niveauer af statisk friktion og binding mellem par overflader. Teknologisk avancerede klæbemidler gør nogle gange brug af mikrostrukturer på overflader, såsom tæt pakket periodiske stolper. Disse er biomimetiske teknologier inspireret af de klæbende evner ved fødderne på forskellige leddyr og hvirveldyr (især geckoer ). Ved at blande periodiske brud i glatte, klæbende overflader opnår grænsefladen værdifulde revnedannende egenskaber. Fordi revnedannelse kræver meget større belastning end revnedannelse, er overflader som disse meget sværere at adskille, da en ny revne skal genstartes hver gang den næste individuelle mikrostruktur nås.
Hysterese
Hysterese refererer i dette tilfælde til omstruktureringen af den klæbende grænseflade over et stykke tid, hvilket resulterer i, at det arbejde, der er nødvendigt for at adskille to overflader, er større end det arbejde, der blev opnået ved at bringe dem sammen (W> γ 1 + γ 2 ). For det meste er dette et fænomen forbundet med diffus binding. Jo mere tid der gives til et par overflader, der udviser diffus binding til omstrukturering, jo mere diffusion vil forekomme, jo stærkere bliver vedhæftningen. Den førnævnte reaktion af visse polymer-på-polymer-overflader til ultraviolet stråling og iltgas er et eksempel på hysterese, men det vil også ske over tid uden disse faktorer.
Udover at kunne observere hysterese ved at afgøre, om W> γ 1 + γ 2 er sandt, kan man også finde beviser for det ved at udføre "stop-start" -målinger. I disse eksperimenter glider to overflader kontinuerligt mod hinanden og lejlighedsvis stoppet i en bestemt mængde tid. Resultater fra forsøg på polymer-på-polymer-overflader viser, at hvis stoppetiden er kort nok, er det let at genoptage glat glidning. Hvis stoppetiden imidlertid overskrider en grænse, er der en indledende stigning i modstand mod bevægelse, hvilket indikerer, at stoppetiden var tilstrækkelig til, at overfladerne kunne omstruktureres.
Fugtbarhed og absorption
Nogle atmosfæriske virkninger på klæbemidlers funktionalitet kan karakteriseres ved at følge teorien om overfladeenergi og grænsefladespænding . Det vides, at γ 12 = (1/2) W 121 = (1/2) W 212 . Hvis γ 12 er høj, finder hver art det gunstigt at hænge sammen, mens den er i kontakt med en fremmed art, frem for at dissociere og blande sig med den anden. Hvis dette er sandt, følger det, at når grænsefladespændingen er høj, er vedhæftningskraften svag, da hver art ikke finder det gunstigt at binde sig til den anden. Grænsefladespændingen af en væske og et fast stof er direkte relateret til væskens befugtning (i forhold til det faste stof), og dermed kan man ekstrapolere, at samhørigheden stiger i ikke-befugtende væsker og falder i befugtende væsker. Et eksempel, der bekræfter dette, er polydimethylsiloxangummi , der har et selvklæbende arbejde på 43,6 mJ/m 2 i luft, 74 mJ/m 2 i vand (en ikke-befugtende væske) og 6 mJ/m 2 i methanol (en befugtning væske).
Dette argument kan udvides til tanken om, at når en overflade er i et medium, som bindingen er gunstig for, vil det være mindre sandsynligt, at den klæber til en anden overflade, da mediet optager de potentielle steder på overfladen, som ellers ville være tilgængelige at klæbe til en anden overflade. Dette gælder naturligvis meget stærkt for befugtning af væsker, men også for gasmolekyler, der kan adsorbere på den pågældende overflade og derved optage potentielle vedhæftningssteder. Dette sidste punkt er faktisk ret intuitivt: Hvis du efterlader et klæbemiddel udsat for luft for længe, bliver det snavset, og dets klæbestyrke falder. Dette observeres i forsøget: når glimmer spaltes i luft, er dens spaltningsenergi, W 121 eller W glimmer/luft/glimmer , mindre end spaltningsenergien i vakuum, W glimmer/ vakuum /glimmer , med en faktor 13.
Lateral vedhæftning
Lateral adhæsion er vedhæftningen forbundet med at glide et objekt på et substrat, såsom at glide en dråbe på en overflade. Når de to objekter er faste stoffer, enten med eller uden en væske mellem dem, beskrives den laterale adhæsion som friktion . Imidlertid adfærd ved lateral adhæsion mellem en dråbe og en overflade er tribologisk meget forskellig fra friktion mellem faste stoffer, og den naturligt klæbende kontakt mellem en flad overflade og en væskedråbe gør den laterale vedhæftning i dette tilfælde til et individuelt felt. Lateral adhæsion kan måles ved hjælp af centrifugaladhæsionsbalancen (CAB), som bruger en kombination af centrifugale og tyngdekræfter til at afkoble de normale og laterale kræfter i problemet.
Se også
Referencer
Yderligere læsning
- John Comyn, Adhesion Science , Royal Society of Chemistry Paperbacks, 1997
- AJ Kinloch, Adhesion and Adhesives: Science and Technology , Chapman og Hall, 1987