Leishmania -Leishmania
| Leishmania | |
|---|---|

|
|
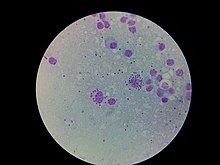
| L. donovani i knoglemarvscelle | |
|
Videnskabelig klassificering |
|
| Domæne: | Eukaryota |
| Phylum: | Euglenozoa |
| Klasse: | Kinetoplastea |
| Bestille: | Trypanosomatida |
| Slægt: |
Leishmania Borovsky 1898 ( Ross 1903) |
| Arter | |
|
L. aethiopica |
|
Leishmania / l Jeg ʃ m eɪ n jeg ə / er en slægt af trypanosomer , der er ansvarlige for sygdommen leishmaniasis . De spredes af sandfluer af slægten Phlebotomus i den gamle verden og af slægten Lutzomyia i den nye verden . Mindst 93 sandfluearter er påviste eller sandsynlige vektorer over hele verden. Deres primære værter er hvirveldyr ; Leishmania inficerer sædvanligvis hyraxer , canids , gnavere og mennesker .
Historie
Den første skriftlige henvisning til de iøjnefaldende symptomer på kutan leishmaniasis dukkede op i Paleotropics inden for orientalske tekster, der går tilbage til det 7. århundrede f.Kr. (angiveligt transkriberet fra kilder flere hundrede år ældre, mellem 1500 og 2000 f.Kr.). På grund af dens brede og vedvarende forekomst i antikken som en mystisk sygdom med forskellige symptomatiske resultater, er leishmaniasis blevet døbt med forskellige navne lige fra "hvid spedalskhed" til " sort feber ". Nogle af disse navne antyder links til negative kulturelle overbevisninger eller mytologi, som stadig lever ind i den sociale stigmatisering af leishmaniasis i dag.
Medlemmer af en gammel slægt af Leishmania -parasitten, Paleoleishmania , er blevet påvist i fossiliserede sandfluer, der går tilbage til den tidlige kridtperiode , men årsagen til sygdommen blev først opdaget i 1901 som et samtidigt fund af William Boog Leishman og Charles Donovan . De visualiserede uafhængigt mikroskopiske encellede parasitter (senere kaldet Leishman-Donovan-kroppe), der lever i cellerne i inficerede menneskelige organer. Den parasitiske slægt ville senere blive klassificeret som trypanosomatide protozoer under den fylogenetiske betegnelse, Leishmania donovani . Flere arter er siden blevet klassificeret og grupperet under to store undergenerater, dvs. Leishmania Viannia (generelt placeret i Neotropics ) eller Leishmania Leishmania (generelt placeret i Paleotropics , med den store undtagelse for undergruppen L. mexicana ).
Epidemiologi
Leishmania påvirker i øjeblikket 6 millioner mennesker i 98 lande. Omkring 0,9-1,6 millioner nye tilfælde opstår hvert år, og 21 arter vides at forårsage sygdom hos mennesker.
Struktur
Leishmania- arter er encellede eukaryoter med en veldefineret kerne og andre celleorganeller, herunder kinetoplaster og flagella . Afhængigt af stadiet af deres livscyklus findes de i to strukturelle varianter, som:
- Den amastigot formular findes i mononukleære fagocytter og kredsløbssygdomme hos mennesker. Det er en intracellulær og ikke -motil form, der er blottet for ekstern flagella. Det korte flagellum er indlejret i den forreste ende uden at rage ud. Den er oval i form og måler 3-6 µm i længden og 1-3 µm i bredden. Kinetoplasten og basallegemet ligger mod den forreste ende.
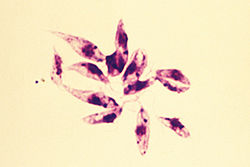
- Den promastigote formular findes i fordøjelseskanalen af sandfluer. Det er en ekstracellulær og bevægelig form. Den er betydeligt større og meget langstrakt og måler 15-30 µm i længden og 5 µm i bredden. Den er spindelformet, tilspidset i begge ender. Et langt flagellum (omkring kropslængden) projiceres udadtil i den forreste ende. Kernen ligger i midten, og foran den er kinetoplasten og basallegemet.
Udvikling
Detaljerne om udviklingen af denne slægt diskuteres, men Leishmania har tilsyneladende udviklet sig fra en forfædret trypanosom -slægt. Den ældste slægt er Bodonidae , efterfulgt af Trypanosoma brucei , sidstnævnte er begrænset til det afrikanske kontinent. Trypanosoma cruzi -grupper med trypanosomer fra flagermus, sydamerikanske pattedyr og kænguruer tyder på en oprindelse på den sydlige halvkugle. Disse klader er kun fjernt beslægtede.
De resterende klader i dette træ er Blastocrithidia , Herpetomonas og Phytomonas . De fire slægter Leptomonas , Crithidia , Leishmania og Endotrypanum danner terminalgrenene, hvilket tyder på en forholdsvis ny oprindelse. Flere af disse slægter kan være polyfyletiske og kan have brug for yderligere opdeling.
Oprindelsen til selve slægten Leishmania er uklar. En teori foreslår en afrikansk oprindelse med migration til Amerika. En anden foreslår migration fra Amerika til den gamle verden via Beringstrædet landbro for omkring 15 millioner år siden. En tredje teori foreslår en palearktisk oprindelse. Sådanne migrationer ville medføre efterfølgende migration af vektor og reservoir eller successive tilpasninger undervejs. En nyere migration er L. infantums fra Middelhavslande til Latinamerika (kendt som L. chagasi ), siden europæisk kolonisering af den nye verden , hvor parasitterne hentede deres nuværende New World -vektorer i deres respektive økosystemer. Dette er årsagen til de epidemier, der nu er tydelige. En nylig epidemi af den nye verden vedrører foxhounds i USA.
Selv om det blev antydet, at Leishmania kunne have udviklet sig i Neotropics . dette er sandsynligvis sandt for arter, der tilhører undergenera Viannia og Endotrypanum . Der er imidlertid tegn på, at den primære udvikling af undergeneraterne Leishmania og Sauroleishmania er den gamle verden. Mens Mundinia -arterne ser ud til at være mere universelle i deres udvikling. En teori er, at forskellige slægter blev isoleret geografisk i forskellige perioder, og det var dette, der gav anledning til denne evolutionære mosaicisme. Men der er ingen tvivl om, at Leishmaniinae er en monofyletisk gruppe.
En stor datasætanalyse tyder på, at Leishmania udviklede sig for 90 til 100 millioner år siden i Gondwana . Krybdyr inficerende arter stammer fra pattedyr klader.
Sauroleishmania -arter blev oprindeligt defineret ud fra, at de inficerede krybdyr ( firben ) frem for pattedyr . Baseret på molekylære beviser er de blevet flyttet til understamstatus inden for Leishmania . Denne subgenus udviklede sig sandsynligvis fra en gruppe, der oprindeligt inficerede pattedyr.
Taksonomi
53 arter genkendes i denne slægt. Status for flere af disse er omstridt, så det endelige antal kan variere. Mindst 20 arter inficerer mennesker. For at gøre tingene mere komplekse kan hybrider være involveret, da det er blevet rapporteret i Brasilien med en hybrid mellem Leishmania (V.) guyanensis og Leishmania (V.) shawi shawi .
Slægten er i øjeblikket opdelt i 4 undergenerater: Leishmania , Sauroleishmania , Mundinia og Viannia . Opdelingen i de to undergenera ( Leishmania og Viannia ) blev foretaget af Lainson og Shaw i 1987 på grundlag af deres placering i insekttarmen. Arterne i Viannia -slægten udvikler sig i bag tarmen: L. (V.) braziliensis er blevet foreslået som typearten for denne subgenus. Denne opdeling er blevet bekræftet af alle efterfølgende undersøgelser. Shaw, Camargo og Teixeira skabte underklassen Mundinia, mens han reviderede Leishmaniinae i 2016.
Endotrypanum er nært beslægtet med Leishmania . Nogle Endotypanum -arter er unikke, fordi de inficerer erytrocytterne hos deres værter (dovendyr). Alle arter er begrænset til Central- og Sydamerika. E. colombiensis -infektioner er fundet hos mennesker.
Sauroleishmania blev oprindeligt beskrevet af Ranquein 1973 som en separat slægt, men molekylære undersøgelser tyder på, at dette faktisk er en subgenus snarere end en separat slægt.
Den foreslåede opdeling af Leishmania i Euleishmania og Paraleishmania -grupper i 2000 understregede den dybe fylogene afstand mellem parasitter, hvoraf nogle var blevet navngivet som Leishmania -arter. Den Euleishmania omfattede arter nu er placeret i underslægter Leishmania , Sauroleishmania , Mundinia og Viannia . Den foreslåede Paraleishmania omfattede arter af Endotypanum, Leishmamnia - L. colomubensis , L. herreri , L. hertigi og L. deanei og L. equatorensis . I en nylig revision fik disse arter forskellig generisk status.
Fire subgenera af Leishmania er nu anerkendt - Leishmania , Sauroleishmania , Viannia og Mundinia ( L. enriettii -komplekset). Slægten Endotrypanum og Porcisia tilhører Paraleishmania .
Der er fire Mundinia -arter - L. (Mundinia) enriettii , L. (Mundinia) martiniquensis , L. (Mundinia) macropodum og L. (Mundinia) orientalis, som findes i Thailand.
L. archibaldis specifikke status er uklar, men den er nært beslægtet med L. donovani .
L. herreri tilhører slægten Endotypanum frem for Leishmania .
L. donovani og L. infantum er nært beslægtede.
Noter
Selenoenzymet Seltryp ser ud til at være unikt for denne rækkefølge. Det er blevet fjernet fra undergenus Viannia .
L. deanei og L. hertigi , som begge inficerer porcupines er blevet flyttet til slægten Porcisia.
Klassifikation
Subgenus Leishmania Ross, 1903 sensu Saf'janova, 1982
- Leishmania aethiopica Bray, Ashford & Bray, 1973
- Leishmania amazonensis Lainson & Shaw, 1972 (inkluderer garnhami Scorza et al., 1979 )
- Leishmania arabica Peters, Elbihari & Evans, 1986
- Leishmania aristidesi Lainson & Shaw, 1979
- Leishmania donovani (Laveran & Mesnil, 1903)
- Leishmania forattinii Yoshida, Cuba, Pacheco, Cupolillo, Tavares, Machado, Homen & Grimaldi, 1993
- Leishmania gerbilli Wang, Qu & Guan, 1964
- Leishmania infantum Nicolle, 1908 (underart chagasi Cunha & Chagas, 1937 )
- Leishmania killicki Rioux, Lamotte & Pratlong, 1986
- Leishmania major Yakimoff & Schokhor, 1914
- Leishmania mexicana Biagi, 1953
- Leishmania pifanoi Medina & Romero, 1959
- Leishmania tropica (Wright, 1903)
- Leishmania turanica Strelkova, Shurkhal, Kellina, Eliseev, Evans, Peters, Chapman, Le Blancq & van Eys, 1990
- Leishmania venezeulensis Bonfante-Garrido, 1980
- Leishmania waltoni Shaw, Pratlong & Dedet 2015
Subgenus Mundinia Shaw, Camargo og Teixeira 2016
- Leishmania enriettii Muniz & Medina, 1948
- Leishmania macropodum Barratt, Kaufer, Peters, Craig, Lawrence, Roberts, Lee, McAuliffe, Stark, Ellis, 2017
- Leishmania martiniquensis Desbois, Pratlong, Quist og Dedet, 2014
- Leishmania orientalis Jariyapan, Daroontum, Jaiwong, Chanmol, .Intakhan, Sor-Suwan, Siriyasatien, Somboon, Bates, Bates, 2018
Subgenus Sauroleishmania Ranque, 1973 sensu Saf'janova, 1982
- Leishmania adleri Heisch, 1958
- Leishmania agamae David, 1929
- Leishmania ceramodactyli Adler & Theodor, 1929
- Leishmania gulikae Ovezmukhammedov & Saf'janova, 1987
- Leishmania gymnodactyli † Khodukin & Sofiev, 1940
- Leishmania helioscopi † Chodukin & Sofiev, 1940
- Leishmania hemidactyli Mackie, Gupta & Swaminath, 1923
- Leishmania hoogstraali McMillan, 1965
- Leishmania nicollei Chodukin & Sofieff, 1940
- Leishmania platycephala Telford, 2009
- Leishmania phrynocephali Chodukin & Sofieff, 1940
- Leishmania senegalensis Ranque, 1973
- Leishmania sofieffi ↑ Markov, Lukina & Markova, 1964
- Leishmania tarentolae Wenyon, 1921
- Leishmania zmeevi ↑ Andruchko & Markov 1955
- Leishmania zuckermani Paperna, Boulard, Hering-Hagenbeck & Landau, 2001
↑ Arter beskrevet som Sauroleishmania . Deres udvikling er ikke som andre medlemmer af undergenus, og derfor er deres taksonomiske position tvivlsom.
Subgenus Viannia Lainson & Shaw 1987
- Leishmania braziliensis Vianna, 1911
- Leishmania guyanensis Floch, 1954
- Leishmania lainsoni Silveira, Shaw, Braga & Ishikawa, 1987
- Leishmania lindenbergi Silveira, Ishikawa, De Souza & Lainson, 2002
- Leishmania naiffi Lainson & Shaw, 1989
- Leishmania panamensis Lainson & Shaw, 1972
- Leishmania peruviana Velez, 1913
- Leishmania shawi Lainson, Braga & de Souza, 1989
- Leishmania utingensis Braga, Lainson, Ishikawa & Shaw 2003
Relaterede slægter
Forholdet mellem disse slægter og Leishmania er i øjeblikket uklart, men de er nært beslægtede.
Slægt Endotrypanum
- Endotrypanum colombiensis (Kreutzer, Corredor, Grimaldi, Grogl, Rowton, Young, Morales, McMahon-Pratt, Guzman & Tesh, 1991)
- Endotrypanum equatorensis (Grimaldi, Kreutzer, Hashiguchi, Gomet, Mimory & Tesh, 1992)
- Endotrypanum herreri (Zeledon, Ponce & Murillo, 1979)
- Endotrypanum monterogeii Shaw, 1969
- Endotrypanum schaudinni Mesnil og Brimont, 1908
Slægt Novymonas Kostygov og Yurchenko 2016
- Novymonas esmeraldas Votýpka, Kostygov, Maslov og Lukeš 2016
Slægt Porcisia Shaw, Camargo og Teixeira 2016
- Porcisia deanei (Lainson & Shaw 1977)
- Porcisia hertigi (Herrer 1971)
Slægt Zelonia Shaw, Camargo og Teixeira 2016
- Zelonia australiensis Barratt, Kaufer, Peters, Craig, Lawrence, Roberts, Lee, McAuliffe, Stark, Ellis 2017
- Zelonia costaricensis (Yurchenko, Lukes, Jirku, Zeledon, Maslov 2006)
Biokemi og cellebiologi
Leishmanias biokemi og cellebiologi ligner andre kinetoplastids . De deler de samme morfologiske træk, herunder et enkelt flagellum, der har en invagination, flagellæren i bunden, en kinetoplast , som findes i den enkelte mitokondrion , og et subpelikulært udvalg af mikrotubuli, der udgør hoveddelen af den cytoskelettet .
Lipophosphoglycan pels
Leishmania har et lipophosphoglycan -lag på ydersiden af cellen. Lipophosphoglycan er en udløser for vejlignende receptor 2 , en signalreceptor involveret i at udløse et medfødt immunrespons hos pattedyr.
Lipophosphoglycans præcise struktur varierer afhængigt af parasitens art og livscyklusstadium . Glycan -komponenten er særlig variabel, og forskellige lipophosphoglycan -varianter kan bruges som en molekylær markør for forskellige livscyklusfaser. Lectiner , en gruppe proteiner, der binder forskellige glycaner, bruges ofte til at påvise disse lipophosphoglycan -varianter. For eksempel binder jordnødde -agglutinin en bestemt lipophosphoglycan, der findes på overfladen af den infektiøse form af L. major .
Lipophosphoglycan bruges af parasitten til at fremme dens overlevelse i værten og de mekanismer, hvormed parasitten gør dette, centrerer omkring modulering af værtens immunrespons. Dette er afgørende, da Leishmania -parasitterne lever inden for makrofager og skal forhindre makrofagerne i at dræbe dem. Lipophosphoglycan har en rolle i at modstå komplementsystemet , hæmmer det oxidative burst -respons, inducerer et inflammationsrespons og forhindrer naturlige dræber -T -celler, der erkender, at makrofagen er inficeret med Leishmania -parasitten.
| Type | Patogen | Beliggenhed |
|---|---|---|
| Kutane leishmaniasis (lokaliserede og diffuse) infektioner fremstår som indlysende hudreaktioner. | Den mest almindelige er den orientalske ømme (forårsaget af den gamle verdens arter L. major , L. tropica og L. aethiopica ). I den nye verden er de mest almindelige syndere L. mexicana . | Kutane infektioner er mest almindelige i Afghanistan , Brasilien , Iran , Peru , Saudi -Arabien og Syrien . |
| Mukokutane leishmaniasis -infektioner starter som en reaktion ved biddet og kan gå med metastase ind i slimhinden og blive fatale. | L. braziliensis | Mukokutane infektioner er mest almindelige i Bolivia , Brasilien og Peru . Mukokutane infektioner findes også i Karamay , Kina Xinjiang Uygur autonome region. |
| Viscerale leishmaniasis -infektioner genkendes ofte af feber, hævelse af lever og milt og anæmi . De er kendt under mange lokale navne, hvoraf den mest almindelige sandsynligvis er kala azar , | Udelukkende forårsaget af arter af L. donovani -komplekset ( L. donovani , L. infantum syn. L. chagasi ). | Viscerale infektioner, der findes i tropiske og subtropiske områder på alle kontinenter undtagen Australien , er mest almindelige i Bangladesh , Brasilien , Indien , Nepal og Sudan . Visceral leishmaniasis findes også i en del af Kina, såsom Sichuan -provinsen, Gansu -provinsen og Xinjiang Uygur autonome region. |
Intracellulær infektionsmekanisme
For at undgå ødelæggelse af immunsystemet og trives, 'gemmer' Leishmania sig inde i værtscellerne. Denne placering gør det muligt at undgå virkningen af det humorale immunrespons (fordi patogenet er sikkert inde i en celle og uden for den åbne blodbanen), og det kan endvidere forhindre immunsystemet i at ødelægge sin vært gennem ikke -farlige overfladesignaler, der modvirker apoptose . De primære celletyper Leishmania -infiltrater er fagocytotiske celler, såsom neutrofiler og makrofager .
Normalt vil en fagocytotisk immuncelle som en makrofag indtage et patogen i et lukket endosom og derefter fylde dette endosom med enzymer, der fordøjer patogenet. I tilfælde af Leishmania har disse enzymer imidlertid ingen effekt, hvilket gør det muligt for parasitten at formere sig hurtigt. Denne uhæmmede vækst af parasitter overvælder i sidste ende værtsmakrofagen eller andre immunceller og får den til at dø.
Overført af sandfluen kan de protozoiske parasitter af L. major skifte strategien for det første immunforsvar fra at spise/betændelse/dræbe til spise/ingen betændelse/ingen dræbe deres værtsfagocyt og ødelægge det til egen fordel. De bruger de villigt fagocytoserende polymorfonukleære neutrofile granulocytter (PMN'er) rigorøst som et vanskeligt skjulested, hvor de formerer sig ukendt fra immunsystemet og kommer ind i de langlivede makrofager for at etablere en "skjult" infektion .
Optagelse og overlevelse
Ved mikrobiel infektion bevæger PMN sig ud fra blodbanen gennem karernes endotelag til stedet for det inficerede væv (dermalt væv efter fluebid). De indleder straks det første immunrespons og fagocytiserer invadereren ved genkendelse af fremmede og aktiverende overflader på parasitten. Aktiveret PMN udskiller kemokiner , især IL-8 , for at tiltrække yderligere granulocytter og stimulere fagocytose. Endvidere øger L. major udskillelsen af IL-8 med PMN'er. Denne mekanisme observeres også under infektion med andre obligatoriske intracellulære parasitter . For mikrober som disse findes der flere intracellulære overlevelsesmekanismer. Overraskende forårsager myntsprøjtningen af apoptotiske og levedygtige patogener langt et mere fulminat sygdomsforløb end injektion af kun levedygtige parasitter. Når det antiinflammatoriske signal phosphatidylserin normalt findes på apoptotiske celler, udsættes på overfladen af døde parasitter, slukker L. major den oxidative burst og derved forhindrer drab og nedbrydning af det levedygtige patogen.
I tilfældet Leishmania genereres afkom ikke i PMN'er, men på denne måde kan de overleve og vedvarende vikle sig på det primære infektionssted. Promastigoteformerne frigiver også Leishmania kemotaktisk faktor (LCF) til aktivt at rekruttere neutrofiler, men ikke andre leukocytter , for eksempel monocytter eller NK -celler . Ud over det blokeres produktionen af interferon gamma (IFNγ) -inducerbart protein 10 (IP10) af PMN'er i forbindelse med Leishmania , hvad der indebærer lukning af inflammatorisk og beskyttende immunrespons ved NK- og Th1- cellerekruttering. Patogenerne forbliver levedygtige under fagocytose, da deres primære værter, PMN'erne, udsætter apoptotisk celle-associeret molekylært mønster (ACAMP), der signalerer "intet patogen".
Vedholdenhed og tiltrækningskraft
Levetiden for neutrofile granulocytter er ret kort. De cirkulerer i blodbanen i cirka 6 til 10 timer efter at have forladt knoglemarv , hvorefter de undergår spontan apoptose . Mikrobielle patogener er blevet rapporteret at påvirke cellulær apoptose ved forskellige strategier. På grund af hæmning af caspase 3-aktivering kan L. major naturligvis forårsage forsinkelse af neutrofile apoptose og forlænge deres levetid i mindst 2-3 dage. Den forlængede levetid er meget gavnlig for udviklingen af infektion, fordi de sidste værtsceller for disse parasitter er makrofager, som normalt migrerer til infektionsstederne inden for to eller tre dage. Patogenerne er ikke dronish; i stedet overtager de kommandoen på det primære infektionssted. De fremkalder produktion af PMN'er af kemokinerne MIP-1α og MIP-1β ( makrofaginflammatorisk protein ) til rekruttering af makrofager.
En vigtig faktor for at forlænge infektionen er hæmningen af det adaptive immunsystem . Dette sker især i de intercellulære faser, når amastigoter søger nye makrofager at inficere og er mere modtagelige for immunrespons. Næsten alle typer fagocytter er målrettet. For eksempel har mincle vist sig at være målrettet af L. major . Interaktion mellem mincle og et protein frigivet af parasitten resulterer i et svækket immunrespons i dendritiske celler .
Silent fagocytose teori
For at redde integriteten af det omgivende væv fra de giftige cellekomponenter og proteolytiske enzymer indeholdt i neutrofiler, ryddes de apoptotiske PMN'er lydløst af makrofager. Døde PMN'er afslører "spis mig" -signalet phosphatidylserin, som overføres til plasmamembranens ydre folder under apoptose. På grund af forsinket apoptose optages de parasitter, der vedvarer i PMN'er, i makrofager under anvendelse af en absolut fysiologisk og ikke -logistisk proces. Strategien for denne "stille fagocytose" har følgende fordele for parasitten:
- Optagelse af apoptotiske celler dæmper makrofagdræbende aktivitet, hvilket fører til en overlevelse af patogenerne.
- Patogener inde af PMN'er ikke har nogen direkte kontakt til makrofag overflade receptorer , fordi de ikke kan se parasitten inde den apoptotiske celle. Aktiveringen af fagocytten til immunaktivering forekommer altså ikke.
Undersøgelser har imidlertid vist, at dette er usandsynligt, da patogenerne ses at efterlade apoptopiske celler, og der ikke er kendt beviser for makrofagoptagelse ved denne metode.
Molekylær Biologi
Et vigtigt aspekt af Leishmania -protozoen er dens glycoconjugatlag af lipophosphoglycan (LPG). Dette holdes sammen med et phosphoinositidmembrananker og har en trepartsstruktur bestående af et lipiddomæne, et neutralt hexasaccharid og et phosphoryleret galactose-mannose med en afslutning i en neutral hætte. Disse parasitter udvikler ikke kun postphlebotomus fordøjelse, men det menes også at være afgørende for oxidative udbrud og dermed tillade passage for infektion. Karakteristika for intracellulær fordøjelse omfatter et endosom, der fusionerer med et lysosom , frigiver syrehydrolaser , der nedbryder DNA , RNA , proteiner og kulhydrater .
Genomik
Genomerne for fire Leishmania- arter ( L. major , L. infantum , L. donovani og L. braziliensis ) er blevet sekventeret og afslører mere end 8300 proteinkodende og 900 RNA- gener. Næsten 40% af proteinkodende gener falder ind i 662 familier, der indeholder mellem to og 500 medlemmer. De fleste af de mindre genfamilier er tandem -arrays med et til tre gener, mens de større genfamilier ofte er spredt i tandem -arrays på forskellige loci i genomet . Hver af de 35 eller 36 kromosomer er organiseret i et lille antal genklynger af ti-til-hundrede gener på den samme DNA-streng. Disse klynger kan organiseres i head-to-head (divergerende) eller tail-to-tail (konvergent) måde, hvor sidstnævnte ofte adskilles af tRNA- , rRNA- og/eller snRNA- gener. Transkription af proteinkodende gener initierer tovejs i de divergerende streng-switch-regioner mellem genklynger og strækker sig polykistronisk gennem hver genklynge, før den afsluttes i streng-switch-regionen, der adskiller konvergente klynger. Leishmania -telomerer er normalt relativt små og består af et par forskellige typer gentagelsessekvenser. Der kan findes beviser for rekombination mellem flere forskellige grupper af telomerer. De L. store og L. infantum genomer indeholder kun omkring 50 kopier af inaktive udartet Ingi / L1Tc-relaterede elementer (DIREs), mens L. braziliensis også indeholder flere telomer-associeret transposable elementer og splejsede leader-associerede retroelements. De Leishmania genomer deler et konserveret kerne proteom på omkring 6200 gener med de tilhørende trypanosomatids Trypanosoma brucei og Trypanosoma cruzi , men omkring 1000 Leishmania -specifikke gener er kendte, som for det meste tilfældigt fordelt over hele genomet. Der findes relativt få (ca. 200) artsspecifikke forskelle i genindhold mellem de tre sekventerede Leishmania- genomer, men omkring 8% af generne ser ud til at udvikle sig med forskellige hastigheder mellem de tre arter, hvilket indikerer forskellige selektive tryk, der kan relateres til sygdomspatologi. Omkring 65% af proteinkodende gener mangler i øjeblikket funktionel tildeling.
Leishmania -arter producerer flere forskellige varmechokproteiner . Disse inkluderer Hsp83, en homolog for Hsp90 . Et regulatorisk element i 3 'UTR af Hsp83 styrer translation af Hsp83 på en temperaturfølsom måde. Denne region danner en stabil RNA -struktur, der smelter ved højere temperaturer.
Seksuel reproduktion
Et mikrobielt patogenes reproduktive system er en af de grundlæggende biologiske processer, der betinger mikroorganismens økologi og sygdomsspredning. I 2009 Akopyants et al. vist, at L. major har en seksuel cyklus, herunder en meiotisk proces. Der dannes hybride afkom, der har fulde genomiske komplementer fra begge forældre. Parring kun forekommer i sandfluer vektor og hybrider kan transmitteres til den mammale vært ved sandfluer bid. Hos L. braziliensis er parringer i naturen overvejende mellem beslægtede individer, hvilket resulterer i ekstrem indavl. Hastigheden af krydsning mellem forskellige stammer af Leishmania i sandfluvektoren afhænger af hyppigheden af co-infektion. Sådanne udkrydsningshændelser synes at være sjældne i L. major og L. donovani .
L. infantum producerer proteiner BRCA1 og RAD51, der interagerer med hinanden for at fremme homolog rekombinationsreparation. Disse proteiner spiller en nøglerolle ved meiose. Således giver meiotiske hændelser den adaptive fordel ved effektiv rekombinationsreparation af DNA -skader, selv når de ikke fører til udkrydsning.
Se også
Referencer
Yderligere læsning
- Van Zandbergen, G; Bollinger, A; Wenzel, A; Kamhawi, S; Voll, R; Klinger, M; Muller, A; Holscher, C; Herrmann, M; Sække, D; Solbach, W; Laskay, T (2006). "Leishmanias sygdomsudvikling afhænger af tilstedeværelsen af apoptotiske promastigoter i det virulente inokulum" . Procedurer fra National Academy of Sciences . 103 (37): 13837–42. Bibcode : 2006PNAS..10313837V . doi : 10.1073/pnas.0600843103 . PMC 1564231 . PMID 16945916 .
- Shaw, Jeffrey Jon (1969). Sloths 'haemoflagellater . HK Lewis: London.
- Ansari MY, Dikhit MR, Sahoo GC, Das P (2012). "Sammenlignende modellering af HGPRT -enzym af L. donovani og bindingsaffiniteter for forskellige analoger af GMP". Int J Biol Macromol . 50 (3): 637–49. doi : 10.1016/j.ijbiomac.2012.01.010 . PMID 22327112 .
eksterne links
- International Leishmania Network (ILN) har grundlæggende oplysninger om sygdommen og forbindelser til mange aspekter af sygdommen og dens vektor.
- En diskussionsliste (Leish-L) er også tilgængelig med over 600 abonnenter på listen, lige fra molekylærbiologer til folkesundhedsarbejdere, fra mange lande både i og uden for endemiske regioner. Kommentarer og spørgsmål modtages gerne.
- KBD: Kinetoplastid Biology and Disease , er et websted dedikeret til leishmaniasis, sovende sygdom og Chagas sygdom (amerikansk trypanosomiasis). Den indeholder gratis adgang til peer-reviewed artikler i fuldtekst om disse emner. Webstedet indeholder mange artikler om den unikke kinetoplastid -organel og genetisk materiale deri.
- Seksuel reproduktion i leishmania-parasitter, kort gennemgang af et "videnskabeligt" papir
- Drug Search for Leishmaniasis World Community Grid