Flowcytometri - Flow cytometry
 Et flowcytometerrør med sugerør
| |
| Klassifikation | Cytometri |
|---|---|
| Analytikere | Celler eller partikler |
| Andre teknikker | |
| Relaterede | Skær tæller |
Flow- cytometri (FC) er en teknik, der anvendes til at detektere og måle fysiske og kemiske karakteristika af en population af celler eller partikler.
I denne proces suspenderes en prøve indeholdende celler eller partikler i en væske og injiceres i flowcytometerinstrumentet. Prøven er fokuseret på ideelt at strømme en celle ad gangen gennem en laserstråle, hvor det spredte lys er karakteristisk for cellerne og deres komponenter. Celler er ofte mærket med fluorescerende markører, så lys absorberes og derefter udsendes i et bånd af bølgelængder. Titusinder af celler kan hurtigt undersøges, og de indsamlede data behandles af en computer.
Flowcytometri bruges rutinemæssigt i grundforskning, klinisk praksis og kliniske forsøg . Anvendelser til flowcytometri omfatter:
- Celletælling
- Cellesortering
- Bestemmelse af cellekarakteristika og funktion
- Påvisning af mikroorganismer
- Biomarkør påvisning
- Proteinteknisk registrering
- Diagnose af sundhedsforstyrrelser såsom blodkræft
En flowcytometri -analysator er et instrument, der leverer kvantificerbare data fra en prøve. Andre instrumenter, der anvender flowcytometri, indbefatter cellesorterere, der fysisk adskiller og derved renser celler af interesse baseret på deres optiske egenskaber.
Historie
Den første impedansbaserede flowcytometriindretning, der anvender Coulter -princippet , blev beskrevet i US patent 2.656.508, udstedt i 1953, til Wallace H. Coulter . Mack Fulwyler var opfinderen af forløberen til nutidens flowcytometre - især cellesortereren. Fulwyler udviklede dette i 1965 med sin publikation i Science . Den første fluorescensbaserede flowcytometri-enhed (ICP 11) blev udviklet i 1968 af Wolfgang Göhde fra universitetet i Münster , ansøgte om patent den 18. december 1968 og blev først kommercialiseret i 1968/69 af den tyske udvikler og producent Partec gennem Phywe AG i Göttingen . På det tidspunkt blev absorptionsmetoder stadig bredt foretrukket af andre forskere frem for fluorescensmetoder . Kort tid efter blev flowcytometriinstrumenter udviklet, herunder Cytofluorograph (1971) fra Bio/Physics Systems Inc. (senere: Ortho Diagnostics), PAS 8000 (1973) fra Partec, det første FACS (fluorescensaktiverede cellesorteringsinstrument) fra Becton Dickinson (1974), ICP 22 (1975) fra Partec/Phywe og Epics fra Coulter (1977/78). Det første mærkefrie højfrekvente impedansflowcytometer baseret på et patenteret mikrofluidisk "lab-on-chip", Ampha Z30, blev introduceret af Amphasys (2012).
Navn på teknologien
Det oprindelige navn på den fluorescensbaserede flowcytometri-teknologi var "pulscytofotometri" ( tysk : Impulszytophotometrie ), baseret på den første patentansøgning om fluorescensbaseret flowcytometri. På den femte American Engineering Foundation -konference om automatiseret cytologi i Pensacola (Florida) i 1976 - otte år efter indførelsen af det første fluorescensbaserede flowcytometer (1968) - blev det enigt om almindeligt at bruge navnet "flowcytometri", et udtryk der hurtigt blev populær.
Flowcytometre
Moderne flowcytometre er i stand til at analysere mange tusinde partikler pr. Sekund i "realtid" og kan, hvis de er konfigureret som cellesorterere, aktivt adskille og isolere partikler med specificerede optiske egenskaber ved lignende hastigheder. Et flowcytometer ligner et mikroskop , bortset fra at flowcytometri i stedet for at producere et billede af cellen tilbyder høj gennemstrømning, automatiseret kvantificering af specificerede optiske parametre på celle-for-celle basis. For at analysere faste væv skal der først fremstilles en encellet suspension.
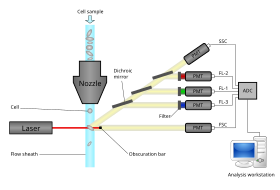
Et flowcytometer har fem hovedkomponenter: en flowcelle, et målesystem, en detektor, et forstærkningssystem og en computer til analyse af signalerne. Flowcellen har en væskestrøm (kappevæske), som bærer og justerer cellerne, så de passerer en enkelt fil gennem lysstrålen til registrering. Målesystemet anvender normalt måling af impedans (eller ledningsevne) og optiske systemer - lamper ( kviksølv , xenon ); vandkølede lasere med høj effekt ( argon , krypton , farvelaser); laveffekt luftkølede lasere (argon (488 nm), rød-HeNe (633 nm), grøn-HeNe, HeCd (UV)); diodelasere (blå, grøn, rød, violet), hvilket resulterer i lyssignaler. Detektoren og analog-til-digital konvertering (ADC) -systemet konverterer analoge målinger af fremspredt lys (FSC) og sidespredt lys (SSC) samt farvespecifikke fluorescenssignaler til digitale signaler, der kan behandles af en computer . Amplifikationssystemet kan være lineært eller logaritmisk .
Processen med at indsamle data fra prøver ved hjælp af flowcytometeret betegnes "erhvervelse". Erhvervelse formidles af en computer, der er fysisk forbundet med flowcytometeret, og den software, der håndterer den digitale grænseflade med cytometeret. Softwaren er i stand til at justere parametre (f.eks. Spænding, kompensation) for prøven, der testes, og hjælper også med at vise indledende prøveoplysninger, mens prøvedata indhentes for at sikre, at parametre er indstillet korrekt. Tidlige flowcytometre var generelt eksperimentelle enheder, men teknologiske fremskridt har muliggjort udbredte applikationer til brug i en række forskellige kliniske og forskningsformål. På grund af denne udvikling er der udviklet et betydeligt marked for instrumentering, analysesoftware samt de reagenser, der anvendes ved anskaffelse, såsom fluorescensmærkede antistoffer .
Moderne instrumenter har normalt flere lasere og fluorescensdetektorer. Den nuværende rekord for et kommercielt instrument er ti lasere og 30 fluorescensdetektorer. Forøgelse af antallet af lasere og detektorer giver mulighed for mærkning af flere antistoffer og kan mere præcist identificere en målpopulation ved hjælp af deres fænotypiske markører. Visse instrumenter kan endda tage digitale billeder af individuelle celler, hvilket giver mulighed for analyse af fluorescerende signalplacering inden for eller på overfladen af celler.
Hardware
Fluidics system af et flowcytometer
Celler skal passere ensartet gennem midten af fokuserede laserstråler for nøjagtigt at måle optiske egenskaber for celler i ethvert flowcytometer. Formålet med det fluidiske system er at flytte cellerne en efter en gennem laserstrålen og gennem instrumentet. Fluidics i et flowcytometer med cellesorteringsfunktioner bruger også strømmen til at transportere sorterede celler ind i opsamlingsrør eller brønde.
Hydrodynamisk fokusering
Til præcis placering af celler i en flydende jet bruges hydrodynamisk fokusering i de fleste cytometre. Cellerne i suspension kommer ind i instrumentet, der er omgivet af en ydre kappevæske. Prøvekernen fastholdes i midten af kappevæsken. Prøveindgangshastigheden eller hvor hurtigt cellerne strømmer igennem til laserforespørgslen kan styres af trykket fra kappevæsken på prøvekernen. Under optimale forhold blandes den centrale væskestrøm og kappevæske ikke.
Akustisk assisteret hydrodynamisk fokusering
Akustisk fokuseringsteknologi bruges i nogle flowcytometre til at understøtte hydrodynamisk fokusering. Akustiske bølger (> 2 MHz) fokuserer prøven forud for introduktion til kappevæske. Den præfokuserede prøve injiceres derefter i den hydrodynamiske kerne og strømmer gennem instrumentet. Dette kan hjælpe med at øge datanøjagtigheden under høje prøveinputhastigheder.
Optik og elektronik
Optiske filtre
Lys, der udsendes fra fluoroforer, ligger i et spektrum af bølgelængder, så kombination af flere fluoroforer kan forårsage overlapning. For at tilføje specificitet bruges optiske filtre og dikroiske spejle til at filtrere og flytte lys til detektorer såsom fotomultiplikatorrør (PMT'er) eller lavinefotodioder (APD). Optiske filtre er designet som bandpass (BP), long pass (LP) eller short pass (SP) filtre. De fleste flowcytometre bruger dikroiske spejle og båndpasfiltre til at vælge specifikke bånd i det optiske spektrum.
Prismer, gitre og spektral flowcytometri
Spektral flowcytometri bruger prismer eller diffraktionsgitre til at sprede det udsendte lys fra en markør hen over et detektormatrix. Dette gør det muligt at måle hele spektret fra hver partikel. De målte spektre fra enkeltceller blandes efterfølgende ved hjælp af referencespektre for alle brugte farvestoffer og autofluorescensspektret. Dette kan muliggøre et bredere paneldesign og anvendelse af nye biologiske markører.
Imaging flowcytometri
Imaging flowcytometri (IFC) fanger flerkanalsbilleder af celler. Detektorer, der bruges i billeddannelsesplatforme, kan udstyres med ladningskoblet enhed (CCD) eller komplementær metaloxid-halvleder (CMOS) til at tage billeder af individuelle celler.
Dataanalyse
Kompensation
Hver fluorokrom har et bredt fluorescensspektrum. Når der bruges mere end et fluorokrom, kan overlapningen mellem fluorokromer forekomme. Denne situation kaldes spektrumoverlapning. Denne situation skal overvindes. For eksempel er emissionsspektret for FITC og PE, at lyset, der udsendes af fluoresceinet, overlapper den samme bølgelængde, som det passerer gennem filteret, der bruges til PE. Denne spektrale overlapning korrigeres ved at fjerne en del af FITC -signalet fra PE -signalerne eller omvendt. Denne proces kaldes farvekompensation, som beregner et fluorokrom i procent for at måle sig selv.
Kompensation er den matematiske proces, hvorved spektraloverlapning af multiparameter flowcytometriske data korrigeres. Da fluorokromer kan have et bredt spektrum, kan de overlappe hinanden, hvilket forårsager det uønskede resultat af forvirring under analysen af data. Denne overlapning, kendt som overløb og kvantificeret i overspringningskoefficienten, skyldes normalt detektorer for et bestemt fluorokrom, der måler en betydelig bølgelængde fra en anden fluorokrom. Lineær algebra bruges oftest til at foretage denne korrektion.
Når grafer over en eller flere parametre vises, er det generelt for at vise, at de andre parametre ikke bidrager til den viste fordeling. Især ved brug af parametre, der er mere end dobbelt, er dette problem mere alvorligt. I øjeblikket er der ikke fundet nogen værktøjer til effektivt at vise multidimensionale parametre. Kompensation er meget vigtig for at se skelnen mellem celler.
Gating
De data, der genereres af flowcytometre, kan plottes i en enkelt dimension , for at producere et histogram eller i todimensionelle prikplots eller endda i tre dimensioner. Regionerne på disse grunde kan successivt separeres, baseret på fluorescens intensitet , ved at skabe en række delmængde ekstraktioner, betegnet "porte". Der findes specifikke gating -protokoller til diagnostiske og kliniske formål, især i relation til hæmatologi . Individuelle enkeltceller skelnes ofte fra celledubletter eller højere aggregater ved deres "flyvetid" (betegnet også som en "pulsbredde") gennem den snævert fokuserede laserstråle
Plotterne laves ofte på logaritmiske skalaer. Fordi forskellige fluorescerende farvestoffers emissionsspektre overlapper hinanden, skal signaler ved detektorerne kompenseres elektronisk såvel som beregningsmæssigt. Data akkumuleret ved hjælp af flowcytometeret kan analyseres ved hjælp af software. Når dataene er indsamlet, er det ikke nødvendigt at forblive forbundet til flowcytometeret, og analyse udføres oftest på en separat computer. Dette er især nødvendigt i kernefaciliteter, hvor der er stor efterspørgsel efter brugen af disse maskiner.
Beregningsanalyse
Nylige fremskridt med automatiseret befolkningsidentifikation ved hjælp af beregningsmetoder har tilbudt et alternativ til traditionelle gating -strategier. Automatiserede identifikationssystemer kan potentielt hjælpe fund med sjældne og skjulte populationer. Repræsentative automatiserede metoder omfatter FLOCK i Immunology Database and Analysis Portal (ImmPort), SamSPECTRAL og flowClust i Bioconductor og FLAME i GenePattern . T-Distributed Stochastic Neighbor Embedding (tSNE) er en algoritme designet til at udføre dimensionalitetsreduktion for at muliggøre visualisering af komplekse multidimensionelle data i et todimensionalt "kort". Samarbejdsindsats har resulteret i et åbent projekt kaldet FlowCAP (Flow Cytometry: Critical Assessment of Population Identification Methods) for at tilvejebringe en objektiv måde at sammenligne og evaluere flowcytometri -dataklyngemetoder og også at etablere vejledning om passende brug og anvendelse af disse metoder.
FMO kontrol
Fluorescens minus en (FMO) kontrol er vigtig for datatolkning ved opbygning af flerfarvede paneler - hvor en celle farves med flere fluorokromer samtidigt. FMO -kontroller giver et mål for fluorescensoverløb i en given kanal og giver mulighed for kompensation. For at generere en FMO -kontrol farves en prøve med alle fluorokromerne undtagen den, der testes - hvilket betyder, at hvis du bruger 4 forskellige fluorokromer, skal din FMO -kontrol kun indeholde 3 af dem (eksempel: fluorokromer - A, B, C, D; FMO'er - ABC_, AB_D, A_CD, _BCD).
Cellesortering efter flowcytometri
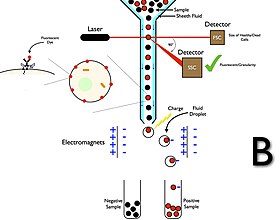
Cellesortering er en metode til at rense cellepopulationer baseret på tilstedeværelse eller fravær af specifikke fysiske egenskaber. I flowcytometre med sorteringsmuligheder registrerer instrumentet celler ved hjælp af parametre, herunder cellestørrelse, morfologi og proteinekspression, og derefter dråbeteknologi til at sortere celler og gendanne delmængderne til post-eksperimentel brug.
Den første prototypesorterer blev bygget på Los Alamos National Laboratory (LANL) i 1965 af fysikeren Mack J. Fulwyler ved at slutte sig til en Coulter volumen sensor med den nyligt opfundne inkjet printer. Levende cellesorterer eller fluorescensaktiveret cellesorterer (FACS) blev genereret af Len Herzenberg , der efterfølgende vandt Kyoto-prisen i 2006 for sit sædvanlige arbejde.
Flowcytometri cellesorterere har et opsamlingssystem i modsætning til flowcytometri analysatorer. Indsamlingsprocessen starter, når en prøve injiceres i en strøm af kappevæske, der passerer gennem strømningscellen og laser aflytter. Strømmen bærer derefter cellen gennem en vibrerende dyse, som genererer dråber, hvor de fleste indeholder enten en celle eller ingen celler. En elektrisk opladningsring placeres lige på det punkt, hvor strømmen bryder til dråber, og en ladning placeres på ringen baseret umiddelbart før fluorescensintensitet måles; den modsatte ladning fanges på dråben, da den bryder fra strømmen, og dråberne oplades derfor. De ladede dråber falder derefter gennem et elektrostatisk afbøjningssystem , der omdirigerer dråber til beholdere baseret på deres ladning. I nogle systemer påføres ladningen direkte på strømmen, og dråben, der afbrydes, bevarer ladningen af det samme tegn som strømmen. Strømmen returneres derefter til neutral, efter at dråben bryder af. Efter indsamling kan disse celler dyrkes, manipuleres og studeres yderligere.
Etiketter

Flowcytometri bruger lysegenskaberne spredt fra celler eller partikler til identifikation eller kvantitativ måling af fysiske egenskaber. Etiketter, farvestoffer og pletter kan bruges til multi-parametrisk analyse (forstå flere egenskaber ved en celle). Immunophenotyping er analysen af heterogene populationer af celler ved hjælp af mærkede antistoffer og andre fluoroforholdige reagenser, såsom farvestoffer og pletter.
Fluorescerende etiketter
En lang række fluoroforer kan bruges som mærker i flowcytometri. Fluoroforer eller simpelthen "fluorer" er typisk knyttet til et antistof, der genkender en målfunktion på eller i cellen; de kan også være knyttet til en kemisk enhed med affinitet til cellemembranen eller en anden cellulær struktur. Hver fluorofor har en karakteristisk top excitation og emissionsbølgelængde , og emissionsspektrene overlapper ofte. Følgelig afhænger kombinationen af etiketter, der kan bruges, af bølgelængden af lampen eller laser (erne), der bruges til at excitere fluorokromerne og af de tilgængelige detektorer. Det maksimale antal skelnes fluorescerende etiketter menes at være 17 eller 18, og dette kompleksitetsniveau nødvendiggør besværlig optimering for at begrænse artefakter såvel som komplekse dekonvolutionsalgoritmer til at adskille overlappende spektre. Flowcytometri bruger fluorescens som et kvantitativt værktøj; den største følsomhed af flowcytometri er uovertruffen af andre fluorescerende detektionsplatforme, såsom konfokal mikroskopi . Absolut fluorescensfølsomhed er generelt lavere i konfokalmikroskopi, fordi out-of-focus-signaler afvises af det konfokale optiske system, og fordi billedet er opbygget i serie fra individuelle målinger på alle steder på tværs af cellen, hvilket reducerer den tid, der er til rådighed til at indsamle signal .
Quantum prikker
Kvanteprikker bruges undertiden i stedet for traditionelle fluoroforer på grund af deres smallere emissionstoppe.
Isotopmærkning
Massecytometri overvinder fluorescerende mærkningsgrænse ved at anvende lanthanidisotoper, der er knyttet til antistoffer. Denne metode kunne teoretisk tillade brug af 40 til 60 adskilbare etiketter og er blevet demonstreret for 30 etiketter. Massecytometri er fundamentalt forskellig fra flowcytometri: celler indføres i et plasma , ioniseres og tilhørende isotoper kvantificeres via tidspunkter for massespektrometri . Selvom denne metode tillader brug af et stort antal etiketter, har den i øjeblikket lavere kapacitet end flowcytometri. Det ødelægger også de analyserede celler og udelukker deres genopretning ved at sortere.
Cytometrisk perle array
Ud over evnen til at mærke og identificere individuelle celler via fluorescerende antistoffer kan cellulære produkter såsom cytokiner, proteiner og andre faktorer også måles. På samme måde som ELISA sandwich -assays anvender cytometric bead array ( CBA ) assays flere perlepopulationer, der typisk differentieres efter størrelse og forskellige niveauer af fluorescensintensitet til at skelne mellem flere analytter i et enkelt assay. Mængden af den opsamlede analyt påvises via et biotinyleret antistof mod en sekundær epitop af proteinet efterfulgt af en streptavidin-R-phycoerythrin-behandling. Fluorescerende intensitet af R-phycoerythrin på perlerne kvantificeres på et flowcytometer udstyret med en 488 nm excitationskilde. Koncentrationer af et protein af interesse i prøverne kan opnås ved at sammenligne de fluorescerende signaler med dem fra en standardkurve genereret ved en seriel fortynding af en kendt koncentration af analytten. Almindeligvis også omtalt som cytokin bead array (CBA).
Impedans flowcytometri
Impedansbaserede enkeltcelleanalysesystemer er almindeligt kendt som Coulter -tællere . De repræsenterer en veletableret metode til at tælle og dimensionere stort set enhver form for celler og partikler. Den etiketfrie teknologi er for nylig blevet forbedret med en " lab-on-a-chip " baseret tilgang og ved at anvende højfrekvent vekselstrøm (AC) i radiofrekvensområdet (fra 100 kHz til 30 MHz) i stedet for en statisk direkte strøm (DC) eller lavfrekvent AC -felt. Denne patenterede teknologi giver en meget nøjagtig celleanalyse og giver yderligere oplysninger som membran kapacitans og levedygtighed . Den relativt lille størrelse og robusthed tillader batteridrevet brug på stedet i marken.
Målbare parametre
- Apoptose (kvantificering, måling af DNA -nedbrydning, mitokondrielt membranpotentiale, ændringer i permeabilitet, caspaseaktivitet )
- Celleadhærens (f.eks. Adhæsion af patogen-værtceller)
- Cell pigmenter såsom klorofyl eller phycoerythrin
- Celleoverflade antigener ( Cluster of differentiation (CD) markører)
- Cell levedygtighed
- Cirkulerende tumorceller : isolering og oprensning
- Karakteriserer multilægemiddelresistens (MDR) i kræftceller
- Kromosom analyse og sortering (bibliotekskonstruktion, kromosom maling)
- Variation af DNA- kopiantal (ved Flow-FISH- eller BACs-on-Beads-teknologi)
- Enzymatisk aktivitet
- Glutathion
- Intracellulære antigener (forskellige cytokiner , sekundære mediatorer osv.)
- Membranens flydende
- Overvågning af elektropermeabilisering af celler
- Nukleare antigener
- Oxidativ burst
- pH , intracellulært ioniseret calcium , magnesium , membranpotentiale
- Proteinekspression og lokalisering
- Proteinmodifikationer, fosfo-proteiner
- Spredning af lys kan bruges til at måle volumen (ved spredning fremad ) og morfologisk kompleksitet (ved sidespredning) af celler eller andre partikler, selv dem, der er ikke-fluorescerende. Disse forkortes konventionelt som henholdsvis FSC og SSC.
- Totalt DNA -indhold ( cellecyklusanalyse , celle kinetik , proliferation , ploidi , aneuploidi , endoreduplikation , etc.)
- Samlet RNA -indhold
- Transgene produkter in vivo , især det grønne fluorescerende protein eller beslægtede fluorescerende proteiner
- Forskellige kombinationer (DNA/overfladeantigener osv.)
Ansøgninger
Teknologien har anvendelser inden for en række områder, herunder molekylærbiologi , patologi , immunologi , virologi, plantebiologi og havbiologi . Det har bred anvendelse inden for medicin især inden for transplantation, hæmatologi, tumorimmunologi og kemoterapi, prænatal diagnose, genetik og sædsortering til kønsvalg . Flowcytometri anvendes bredt til at detektere sædcellernes abnormitet forbundet med DNA -fragmentering i mandlige fertilitetsassays . Det bruges også i vid udstrækning i forskning til påvisning af DNA -skader , caspasespaltning og apoptose . Fotoakustisk flowcytometri bruges i undersøgelsen af multilægemiddelresistente bakterier (oftest MRSA) til at detektere, differentiere og kvantificere bakterier i blodet markeret med farvede bakteriofager. Inden for neurovidenskab kan co-ekspression af celleoverflade og intracellulære antigener også analyseres. I mikrobiologi kan den bruges til at screene og sortere transposonmutante biblioteker konstrueret med en GFP-kodende transposon (TnMHA) eller til at vurdere levedygtighed. I proteinteknik bruges flowcytometri sammen med gærdisplay og bakteriedisplay til at identificere celleoverflade-viste proteinvarianter med ønskede egenskaber. De største fordele ved flowcytometri frem for histologi og IHC er muligheden for præcist at måle mængderne af antigener og muligheden for at plette hver celle med flere antistoffer-fluoroforer, i nuværende laboratorier kan omkring 10 antistoffer bindes til hver celle. Dette er meget mindre end massecytometer, hvor op til 40 kan måles i øjeblikket, men til en højere pris og et langsommere tempo.
Akvatisk forskning
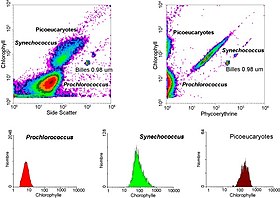
I akvatiske systemer bruges flowcytometri til analyse af autofluorescerende celler eller celler, der er fluorescensmærket med tilføjede pletter. Denne forskning startede i 1981, da Clarice Yentsch brugte flowcytometri til at måle fluorescensen i en rød tidevand, der producerer dinoflagellat. Det næste år offentliggjorde forskere flowcytometriske målinger af flere algearter, som kunne skelnes ud fra deres fluorescensegenskaber. I 1983 samlede havforskere deres egne flowcytometre eller brugte kommercielt tilgængelige flowcytometre på havvandsprøver opsamlet ud for Bermuda for at demonstrere, at fytoplanktonceller kunne skelnes fra ikke-levende materiale, og at cyanobakterier kunne sorteres fra et blandet samfund og derefter dyrkes i laboratoriet. Flowcytometri tillod også havforskere at skelne mellem svagt fluorescerende Prochlorococcus og heterotrofiske mikroorganismer, en sondring, der er vanskelig med mikroskopibaserede vurderinger. Teknologiske fremskridt gør det nu muligt for akvatiske forskere at bruge flowcytometre kontinuerligt under krydstogter, og flowcytometre bruges til at levere billeder af individuelle planteplanktonceller. Havforskere bruger flowcytometers sorteringsevne til at foretage diskrete målinger af cellulær aktivitet og mangfoldighed, til at foretage undersøgelser af de mutualistiske forhold mellem mikroorganismer, der lever i umiddelbar nærhed, og til at måle biogeokemiske hastigheder for flere processer i havet.
Celleproliferationsassay
Celleproliferation er hovedfunktionen i immunsystemet. Ofte er det nødvendigt at analysere cellernes proliferative karakter for at kunne drage nogle konklusioner. Et sådant assay til bestemmelse af celleproliferation er sporingsfarvestoffet carboxyfluoresceindiacetat succinimidylester (CFSE). Det hjælper med at overvåge proliferative celler. Denne analyse giver kvantitative såvel som kvalitative data under tidsserieeksperimenter. Dette farvestof binder kovalent med de langlivede molekyler, der er til stede inde i cellen. Når cellerne deler sig, deler molekylerne sig også, og dattercellerne besidder det halve farvestof end forældrepopulationen. Dette fald i intensiteten kan visualiseres ved flowcytometri. I litteraturen er denne kraftfulde teknik med flowcytometri og CFSE blevet brugt til at finde effektiviteten af T-celler til at dræbe målcellerne i kræft, såsom leukæmi. For at visualisere målcelledøden, både hurtig og langsom, har forskere brugt CFSE -mærkning med antistoffarvning af visse slags celler og fluorescensmærkede mikroperler. Dette gav også information om proliferationen af målcellerne efter behandlingen af visse cytokiner.
Se også
- Annexin A5 affinitetsassay , en test for celler, der gennemgår apoptose, bruger ofte flowcytometri
- Cellecyklusanalyse
- Skær tæller
- Cytometri
- Dielektroforese
- Flowcytometri Standard
- Massecytometri
- Mikrofluorimetri
- Levedygtighedsanalyse
Noter
Referencer
Yderligere læsning
- Carey JL, McCoy Jr JP, Keren DF (2007). Flowcytometri i klinisk diagnose (4. udgave). Chicago, IL: American Society for Clinical Pathology (ASCP) Press. ISBN 978-0-89189-548-0.
- Darzynkiewicz Z, Roederer M, Tanke HJ, red. (2004). Metoder i cellebiologi, cytometri . 75 (4. udgave). Elsevier /Academic Press. ISBN 0-12-480283-4.
- Darzynkiewicz Z, Robinson JP, Roederer M (2009). Væsentlige cytometri metoder (1. udgave). Amsterdam: Elsevier/Academic Press. ISBN 978-0-12-375045-7.
- Darzynkiewicz Z, et al., Red. (2011). Nylige fremskridt inden for cytometri. Del A . Metoder i cellebiologi. 102 . Elsevier/Academic Press. ISBN 978-0-12-374912-3.
- Darzynkiewicz Z, et al., Red. (2011). Nylige fremskridt inden for cytometri. Del B . Metoder i cellebiologi. 103 . Elsevier/Academic Press. ISBN 978-0-12-385493-3.
- Lloyd D (1993). Flowcytometri i mikrobiologi . London: Springer-Verlag. ISBN 978-3-540-19796-6.
- Ormerod MG (1999). Flowcytometri (2. udgave). Oxford, Storbritannien: Bios Scientific Publishers. ISBN 978-1-85996-107-0.
- Ormerod MG, red. (2000). Flowcytometri: en praktisk tilgang (3. udgave). Oxford [England]: Oxford University Press. ISBN 978-0-19-963824-6.
- Ormerod MG (2008). Flowcytometri: en grundlæggende introduktion . Redhill: MG Ormerod. ISBN 978-0-9559812-0-3.
- Robinson JP, et al. (1993). Håndbog i flowcytometri metoder . New York: Wiley-Liss. ISBN 978-0-471-59634-9.
- Shapiro HM (2003). Praktisk flowcytometri (4. udgave). New York: Wiley-Liss. ISBN 978-0-471-41125-3.
- Sklar LA (2005). Flowcytometri til bioteknologi . New York: Oxford University Press. ISBN 978-0-19-515234-0.
eksterne links
|
Biblioteksressourcer om flowcytometri |
-
 Medier relateret til Flowcytometri på Wikimedia Commons
Medier relateret til Flowcytometri på Wikimedia Commons - Flow+cytometri på US National Library of Medicine Medical Subject Headings (MeSH)