Glutathion S -overførsel -Glutathione S-transferase
| Glutathion S -overførsel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Krystallografisk struktur af glutathion S -transferase fra Anopheles cracens .
| |||||||||
| Identifikatorer | |||||||||
| EF -nr. | 2.5.1.18 | ||||||||
| CAS -nr. | 50812-37-8 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz -visning | ||||||||
| BRENDA | BRENDA indgang | ||||||||
| ExPASy | NiceZyme udsigt | ||||||||
| KEGG | KEGG -indtastning | ||||||||
| MetaCyc | metabolisk vej | ||||||||
| PRIAM | profil | ||||||||
| PDB -strukturer | RCSB PDB PDBe PDBsum | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
Glutathion S -overførsler ( GST'er ), tidligere kendt som ligandiner , er en familie af eukaryote og prokaryote fase II metaboliske isozymer, der er bedst kendt for deres evne til at katalysere konjugering af den reducerede form af glutathion (GSH) til xenobiotiske substrater med henblik på afgiftning . GST -familien består af tre superfamilier: de cytosoliske , mitokondrielle og mikrosomale - også kendt som MAPEG - proteiner . Medlemmer af GST -superfamilien er ekstremt forskellige i aminosyresekvens , og en stor brøkdel af sekvenserne deponeret i offentlige databaser har ukendt funktion. Den Enzyme Funktion Initiative (EFI) bruger GSTer som model superfamilien at identificere nye GST funktioner.
GST'er kan udgøre op til 10% af cytosolisk protein i nogle pattedyrsorganer. GST'er katalyserer konjugeringen af GSH-via en sulfhydrylgruppe-til elektrofile centre på en lang række forskellige substrater for at gøre forbindelserne mere vandopløselige. Denne aktivitet afgifter endogene forbindelser såsom peroxiderede lipider og muliggør nedbrydning af xenobiotika. GST'er kan også binde toksiner og fungere som transportproteiner, hvilket gav anledning til den tidlige betegnelse for GST'er, ligandin .
Klassifikation
| Glutathione S -transferase, C -terminal domæne | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktur af det xenobiotiske substratbindingssted for rotteglutathion S -transferase mu 1 bundet til GSH -adduktet af phenanthren -9,10 -oxid.
| |||||||||
| Identifikatorer | |||||||||
| Symbol | GST_C | ||||||||
| Pfam | PF00043 | ||||||||
| InterPro | IPR004046 | ||||||||
| SCOP2 | 2gst / SCOPe / SUPFAM | ||||||||
| OPM superfamilie | 178 | ||||||||
| OPM -protein | 5i9k | ||||||||
| CDD | cd00299 | ||||||||
| |||||||||
Proteinsekvens og struktur er vigtige yderligere klassificeringskriterier for de tre superfamilier (cytosoliske, mitokondrielle og MAPEG) af GST'er: mens klasser fra den cytosoliske superfamilie af GST'er besidder mere end 40% sekvenshomologi , kan de fra andre klasser have mindre end 25% . Cytosoliske GST'er er opdelt i 13 klasser baseret på deres struktur: alfa, beta, delta, epsilon, zeta, theta, mu, nu, pi, sigma, tau, phi og omega. Mitokondrielle GST'er er i klassen kappa. MAPEG-superfamilien af mikrosomale GST'er består af undergrupper betegnet I-IV, mellem hvilke aminosyresekvenser deler mindre end 20% identitet. Humane cytosoliske GST'er tilhører alfa-, zeta-, theta-, mu-, pi-, sigma- og omega -klasserne, mens seks isozymer tilhørende klasse I, II og IV i MAPEG -superfamilien vides at eksistere.
Nomenklatur
Standardiseret GST-nomenklatur, der først blev foreslået i 1992, identificerer den art, som isozymet af interesse tilhører, med en initial med små bogstaver (f.eks. "H" for mennesker), der går forud for forkortelsen GST. Isozymklassen identificeres efterfølgende med et stort bogstav (f.eks. "A" for alfa) efterfulgt af et arabisk tal, der repræsenterer klassens underfamilie (eller underenhed). Fordi både mitokondrielle og cytosoliske GST'er eksisterer som dimerer , og der kun dannes heterodimerer mellem medlemmer af samme klasse, betegnes den anden underfamiliekomponent i enzymdimeren med en bindestreg efterfulgt af et yderligere arabisk tal. Derfor, hvis en human glutathion S- overførsel er en homodimer i pi-klasse underfamilien 1, vil dens navn blive skrevet som "hGSTP1-1".
Den tidlige nomenklatur for GST'er omtalte dem som "Y" -proteiner med henvisning til deres adskillelse i "Y" -fraktionen (i modsætning til "X og Z" -fraktionerne) ved hjælp af Sephadex G75 -kromatografi. Da GST-underenheder blev identificeret, blev de omtalt som Ya, Yp osv. Med om nødvendigt et tal, der identificerer monomerisoformen (f.eks. Yb1). Litwack et al foreslog udtrykket "Ligandin" for at dække proteiner, der tidligere var kendt som "Y" proteiner.
I klinisk kemi og toksikologi bruges udtrykkene alpha GST, mu GST og pi GST mest almindeligt.
Struktur
| Identifikatorer | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | GST_N | ||||||||
| Pfam | PF02798 | ||||||||
| Pfam klan | CL0172 | ||||||||
| InterPro | IPR004045 | ||||||||
| PROSIT | PS50404 | ||||||||
| SCOP2 | 1g7o / SCOPe / SUPFAM | ||||||||
| |||||||||
Glutathionbindingsstedet eller "G -stedet" er placeret i det thioredoxinlignende domæne for både cytosoliske og mitokondrielle GST'er. Regionen, der indeholder den største variation i de forskellige klasser, er helix α2 , hvor en af tre forskellige aminosyrerester interagerer med glycinresten af glutathion. To undergrupper af cytosoliske GST'er er blevet karakteriseret baseret på deres interaktion med glutathion: Y-GST-gruppen, der bruger en tyrosinrest til at aktivere glutathion, og S/C-GST, der i stedet bruger serin- eller cysteinrester .
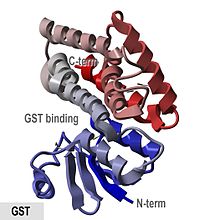
- "GST -proteiner er kugleformede proteiner med et N -terminalt blandet spiralformet og beta -strenget domæne og et hel -spiralformet C -terminalt domæne."
Den porcine pi-class enzym pGTSP1-1 var den første GST at dens struktur bestemmes, og den er repræsentativ for andre medlemmer af den cytosoliske GST-superfamilien, som indeholder en thioredoxin-lignende N -terminale domæne samt en C -terminale domæne bestående af alfa -spiraler .
Cytosoliske GST'er hos pattedyr er dimere , idet begge underenheder er fra samme klasse af GST'er, selvom de ikke nødvendigvis er identiske. De monomerer er ca. 25 kDa i størrelse. De er aktive over en lang række forskellige substrater med betydelig overlapning. Følgende tabel viser alle GST-enzymer i hver klasse, der vides at eksistere i Homo sapiens , som findes i UniProtKB/Swiss-Prot- databasen.
| GST -klasse | Homo sapiens GST -klassemedlemmer (22) |
|---|---|
| Alpha | GSTA1 , GSTA2 , GSTA3 , GSTA4 , GSTA5 |
| Delta | |
| Kappa | GSTK1 |
| Mu | GSTM1 , GSTM1L (RNAi) , GSTM2 , GSTM3 , GSTM4 , GSTM5 |
| Omega | GSTO1 , GSTO2 |
| Pi | GSTP1 |
| Theta | GSTT1 , GSTT2 , GSTT4 |
| Zeta | GSTZ1 (aka MAAI-Maleylacetoacetate isomerase) |
| Mikrosomalt | MGST1 , MGST2 , MGST3 |
Udvikling
Miljømæssig udfordring ved naturlige giftstoffer været med til at forberede Drosophilae for DDT udfordring,
Fungere
Aktiviteten af GST'er er afhængig af en stabil forsyning af GSH fra de syntetiske enzymer gamma-glutamylcystein-syntetase og glutathionsyntetase , samt virkningen af specifikke transportører til at fjerne konjugater af GSH fra cellen. GST'ernes primære rolle er at afgifte xenobiotika ved at katalysere det nukleofile angreb af GSH på elektrofile carbon-, svovl- eller nitrogenatomer i de ikke -polære xenobiotiske substrater og derved forhindre deres interaktion med afgørende cellulære proteiner og nukleinsyrer. Specifikt er funktionen af GST'er i denne rolle todelt: at binde både substratet ved enzymets hydrofobe H -sted og GSH på det tilstødende, hydrofile G -sted, som tilsammen danner enzymets aktive sted ; og efterfølgende for at aktivere thiolgruppen af GSH, hvilket muliggør det nukleofile angreb på substratet. Glutathionmolekylet binder i en kløft mellem N - og C -terminale domæner - de katalytisk vigtige rester foreslås at opholde sig i det N -terminale domæne. Begge underenheder af GST-dimeren, hvad enten den er hetero- eller homodimer i naturen, indeholder et enkelt ikke-substratbindingssted samt et GSH-bindingssted. I heterodimere GST-komplekser, såsom dem, der er dannet af de cytosoliske mu- og alfa-klasser, er kløften mellem de to underenheder imidlertid hjemsted for et yderligere xenobiotisk bindingssted med høj affinitet, der ikke kan danne grundlag for enzymernes evne til at danne heterodimerer.
Forbindelserne, der er målrettet på denne måde af GST'er, omfatter en bred vifte af miljømæssige eller på anden måde eksogene toksiner, herunder kemoterapeutiske midler og andre lægemidler, pesticider, herbicider, kræftfremkaldende stoffer og epoxider med variabel afledning; faktisk er GST'er ansvarlige for konjugeringen af β 1 -8,9 -epoxid, et reaktivt mellemprodukt dannet af aflatoxin B 1 , som er et afgørende middel til beskyttelse mod toksinet i gnavere. Afgiftningsreaktionerne omfatter de første fire trin i mercaptursyresyntese , hvor konjugering til GSH tjener til at gøre substraterne mere opløselige og tillader dem at blive fjernet fra cellen af transportører, såsom multilægemiddelresistens-associeret protein 1 ( MRP1 ). Efter eksport konverteres konjugeringsprodukterne til mercaptursyre og udskilles via urinen eller galden .
De fleste pattedyrisoenzymer har affinitet til substratet 1-chlor-2,4-dinitrobenzen , og spektrofotometriske assays, der anvender dette substrat, bruges almindeligvis til at rapportere GST-aktivitet. Nogle endogene forbindelser, f.eks. Bilirubin, kan imidlertid hæmme aktiviteten af GST'er. Hos pattedyr har GST-isoformer cellespecifikke fordelinger (f.eks. Α-GST i hepatocytter og π-GST i galdevejen i den menneskelige lever).
GST'er har en rolle i bioaktiveringsprocessen af clopidogrel prodrug.
Rolle i cellesignalering
Selvom de er bedst kendt for deres evne til at konjugere xenobiotika til GSH og derved afgifte cellulære miljøer, er GST'er også i stand til at binde ikke -substrate ligander med vigtige cellesignalimplikationer . Flere GST -isozymer fra forskellige klasser har vist sig at hæmme funktionen af en kinase involveret i MAPK -vejen, der regulerer celleproliferation og død , hvilket forhindrer kinasen i at udføre sin rolle i at lette signalkaskaden.
Cytosolisk GSTP1-1, et velkarakteriseret isozym af pattedyrs GST-familien, udtrykkes primært i hjerte-, lunge- og hjernevæv; faktisk er det den mest almindelige GST udtrykt uden for leveren. Baseret på dens overekspression i et flertal af humane tumorcellelinjer og forekomst i kemoterapeutisk resistente tumorer, menes GSTP1-1 at spille en rolle i udviklingen af kræft og dets potentielle resistens over for lægemiddelbehandling. Yderligere beviser for dette kommer fra viden om, at GSTP selektivt kan hæmme C -Jun -phosphorylering af JNK og forhindre apoptose. I tider med lav cellulær stress dannes et kompleks gennem direkte protein -protein -interaktioner mellem GSTP og C -terminen af JNK, hvilket effektivt forhindrer virkningen af JNK og dermed dets induktion af JNK -vejen. Cellulært oxidativt stress forårsager dissociation af komplekset, oligomerisering af GSTP og induktion af JNK -vejen, hvilket resulterer i apoptose . Forbindelsen mellem GSTP-inhibering af den pro-apoptotiske JNK-vej og isozymets overekspression i lægemiddelresistente tumorceller kan i sig selv stå for tumorcellernes evne til at undslippe apoptose medieret af lægemidler, der ikke er substrater for GSTP.
Ligesom GSTP er GSTM1 involveret i at regulere apoptotiske veje gennem direkte protein -protein -interaktioner, selvom det virker på ASK1 , som er opstrøms for JNK. Mekanismen og resultatet ligner den for GSTP og JNK, idet GSTM1 sekvestrerer ASK1 gennem kompleks dannelse og forhindrer dets induktion af de pro-apoptotiske p38- og JNK-dele af MAPK-signalkaskaden. Ligesom GSTP interagerer GSTM1 med sin partner i fravær af oxidativ stress, selvom ASK1 også er involveret i varmechokrespons , hvilket ligeledes forhindres under ASK1 -sekvestrering. Det faktum, at høje niveauer af GST er forbundet med resistens mod apoptose induceret af en række stoffer, herunder kemoterapeutiske midler, understøtter dets formodede rolle i forebyggelse af MAPK -signalering.
Implikationer for kræftudvikling
Der er en voksende mængde beviser, der understøtter GSTs rolle, især GSTP, i kræftudvikling og kemoterapeutisk resistens. Forbindelsen mellem GSTP og kræft er mest indlysende ved overekspression af GSTP i mange kræftformer, men det understøttes også af det faktum, at den transformerede fænotype af tumorceller er forbundet med afvigende regulerede kinasesignalveje og cellulær afhængighed af overudtrykte proteiner. At de fleste kræftbekæmpende lægemidler er dårlige substrater for GSTP indikerer, at forhøjet GSTP's rolle i mange tumorcellelinjer ikke er at afgifte forbindelserne, men skal have et andet formål; denne hypotese tillægges også troværdighed ved den almindelige konstatering af GSTP -overekspression i tumorcellelinjer, der ikke er lægemiddelresistente.
Klinisk betydning
Ud over deres roller i kræftudvikling og kemoterapeutisk lægemiddelresistens er GST'er impliceret i en række sygdomme i kraft af deres engagement i GSH. Selvom beviserne er minimale for påvirkningen af GST -polymorfier i alfa-, mu-, pi- og theta -klasser om modtagelighed for forskellige former for kræft, har talrige undersøgelser impliceret sådanne genotypiske variationer i astma , åreforkalkning , allergi og andre inflammatoriske sygdomme.
Fordi diabetes er en sygdom, der involverer oxidativ skade, og GSH -metabolisme er dysfunktionel hos diabetespatienter, kan GST'er repræsentere et potentielt mål for behandling af diabetisk medicin. Desuden er insulinadministration kendt for at resultere i øget GST -genekspression gennem PI3K/AKT/mTOR -vejen og reduceret intracellulær oxidativ stress, mens glucagon reducerer sådan genekspression.
Omega-klasse GST (GSTO) gener er især forbundet med neurologiske sygdomme, såsom Alzheimers , Parkinsons og amyotrofisk lateral sklerose ; igen menes oxidativ stress at være synderen, med nedsat GSTO -genekspression, der resulterer i en lavere alder for sygdommens begyndelse.
Frigivelse af GST'er som en indikation på organskade
De høje intracellulære koncentrationer af GST'er kombineret med deres cellespecifikke cellulære distribution gør det muligt for dem at fungere som biomarkører til lokalisering og overvågning af skader på definerede celletyper. Eksempelvis indeholder hepatocytter høje niveauer af alfa GST, og serum alpha GST har vist sig at være en indikator for hepatocytskade ved transplantation , toksicitet og virusinfektioner.
Tilsvarende hos mennesker indeholder renale proximale tubulære celler høje koncentrationer af alfa GST, mens distale tubulære celler indeholder pi GST. Denne specifikke fordeling gør det muligt at måle urin -GST'er til at kvantificere og lokalisere nyretubulær skade ved transplantation , nefrotoksicitet og iskæmisk skade.
I prækliniske undersøgelser af gnavere har urin og serum alpha GST vist sig at være følsomme og specifikke indikatorer for henholdsvis renal proximal tubulær og hepatocytnekrose.
GST-tags og GST pull-down assay
GST kan sættes til et protein af interesse for at rense det fra opløsning i en proces kendt som en pull-down assay . Dette opnås ved at indsætte den GST -DNA -kodende sekvens ved siden af den, der koder for proteinet af interesse. Efter transkription og translation vil GST -proteinet og proteinet af interesse således udtrykkes sammen som et fusionsprotein . Fordi GST -proteinet har en stærk bindingsaffinitet for GSH, kan perler overtrukket med forbindelsen sættes til proteinblandingen; som et resultat vil proteinet af interesse, der er knyttet til GST, klæbe til perlerne og isolere proteinet fra resten af dem i opløsning. Perlerne udvindes og vaskes med frit GSH for at frigøre proteinet af interesse fra perlerne, hvilket resulterer i et oprenset protein. Denne teknik kan bruges til at belyse direkte protein -protein -interaktioner. En ulempe ved denne analyse er, at proteinet af interesse er knyttet til GST, hvilket ændrer dets oprindelige tilstand.
Et GST-tag bruges ofte til at adskille og rense proteiner, der indeholder GST-fusionsproteinet. Mærket er 220 aminosyrer (omtrent 26 kDa) i størrelse, hvilket i forhold til mærker som f.eks. Myc-mærket eller FLAG-mærket er ret stort. Det kan smeltes til enten N -terminen eller C -terminen af et protein. Imidlertid indbefatter mange kommercielt tilgængelige kilder til GST-mærkede plasmider et thrombin- spaltningssted til spaltning af GST-mærket under proteinrensning.
Se også
- Affinitetskromatografi
- Bakteriel glutathiontransferase
- Glutathion S -overførsel Mu 1
- Glutathione S -transferase, C -terminal domæne
- GSTP1
- Maltosebindende protein
- Protein mærke
Referencer
Low et al 2007
- Lav, Wai Yee; Ng, Hooi Ling; Morton, Craig J .; Parker, Michael W .; Batterham, Philip; Robin, Charles (2007). "Molekylær udvikling af Glutathion S-transferaser i slægten Drosophila " . Genetik . Genetics Society of America / Oxford University Press (OUP). 177 (3): 1363–1375. doi : 10.1534/genetik.107.075838 . ISSN 0016-6731 . PMC 2147980 . PMID 18039872 .
eksterne links
- Oversigt over Glutathione S -Transferaser
- Glutathione+S-Transferase på US National Library of Medicine Medical Subject Headings (MeSH)
- EF 2.5.1.18
- Fremstilling af GST -fusionsproteiner
- GST Gene Fusion System Håndbog

