Subventrikulær zone - Subventricular zone
| Subventrikulær zone | |
|---|---|
| Identifikatorer | |
| NeuroLex ID | nlx_144262 |
| Anatomiske udtryk for neuroanatomi | |

Den subventrikulære zone ( SVZ ) er et område, der er placeret på ydervæggen af hver lateral ventrikel i hvirveldyrhjernen . Det er til stede i både den embryonale og voksne hjerne. I fosterlivet refererer SVZ til en sekundær proliferativ zone indeholdende neurale stamceller , som deler sig for at producere neuroner i processen med neurogenese . De primære neurale stamceller i hjernen og rygmarven, kaldet radiale glialceller , ligger i stedet i ventrikulærzonen (VZ) (såkaldt fordi VZ linjer indersiden af de udviklende ventrikler ).
I den cerebrale cortex , der udvikler sig , som ligger i dorsal telencephalon , er SVZ og VZ forbigående væv, der ikke eksisterer hos den voksne. SVZ for det ventrale telencephalon vedvarer dog hele livet. Den voksne SVZ består af fire forskellige lag med variabel tykkelse og celletæthed samt cellulær sammensætning. Sammen med tandede gyrus i hippocampus , SVZ'en er et af to steder, hvor neurogenese er blevet fundet at forekomme i den voksne pattedyrs hjerne. Voksen SVZ neurogenese har form af neuroblast -forstadier til interneuroner, der migrerer til olfaktorisk pære gennem den rostrale vandringsstrøm . SVZ ser også ud til at være involveret i dannelsen af astrocytter efter en hjerneskade.
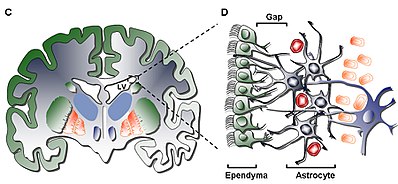
Struktur
Lag I
Det inderste lag (lag I) indeholder et enkelt lag (monolag) af ependymale celler, der beklæder ventrikelhulen; disse celler besidder apikale cilia og flere basale ekspansioner, der kan stå parallelt eller vinkelret på ventrikeloverfladen. Disse udvidelser kan interagere intimt med de astrocytiske processer, der er forbundet med det hypocellulære lag (lag II).
Lag II
Det sekundære lag (lag II) sørger for et hypocellulært mellemrum, der støder op til førstnævnte og har vist sig at indeholde et netværk af funktionelt korrelerede Glial Fibrillary Acid Protein ( GFAP ) -positive astrocytiske processer, der er knyttet til overgangskomplekser, men mangler cellelegemer bortset fra den sjældne neuronale somata. Medens funktionen af dette lag er endnu ukendt hos mennesker, er det blevet antaget, at de astrocytiske og ependymale sammenkoblinger af Layer kan I og II handle for at regulere neuronale funktioner, etablere metabolisk homeostase , og / eller kontrollere neuronal stamcelle proliferation og differentiering under udviklingen . Potentielt kan sådanne egenskaber ved laget fungere som en rest af det tidlige udviklingsliv eller vej til cellulær migration givet lighed med et homologt lag i kvæg SVZ vist sig at have vandrende celler, der kun er fælles for pattedyr af højere orden.
Lag III
Det tredje lag (lag III) danner et bånd af astrocytcellelegemer , der menes at opretholde en subpopulation af astrocytter, der er i stand til at formere sig in vivo og danne multipotente neurosfærer med selvfornyelsesevner in vitro. Mens nogle oligodendrocytter og ependymale celler er fundet inden for båndet, tjener de ikke kun en ukendt funktion, de er ualmindelige i sammenligning med populationen af astrocytter, der ligger i laget. Den astrocytter stede i Layer III kan opdeles i tre populationer gennem elektronmikroskopi , med ingen unikke funktioner endnu genkendelige; den første type er en lille astrocyt af lange, vandrette, tangentielle fremskrivninger, der for det meste findes i lag II; den anden type findes mellem lag II og III samt inden for astrocytbåndet, kendetegnet ved dets store størrelse og mange organeller; den tredje type findes typisk i de laterale ventrikler lige over hippocampus og ligner i størrelse den anden type, men indeholder få organeller.
Lag IV
Den fjerde og sidste lag (Layer IV) tjener som en overgangszone mellem Layer III med dens bånd af astrocytter og hjernen parenkym . Det identificeres ved en høj tilstedeværelse af myelin i regionen.
Celletyper
Fire celletyper er beskrevet i SVZ:
1. Ciliated Ependymal Cells (Type E): er placeret vendt mod lumen i ventriklen og fungerer til at cirkulere cerebrospinalvæsken .
2. Spredende neuroblaster (type A): ekspres PSA-NCAM ( NCAM1 ), Tuj1 ( TUBB3 ) og Hu, og migrer i linje rækkefølge til olfaktorisk pære
3. Langsomme formeringsceller (type B): udtrykker Nestin og GFAP , og fungerer til at skjule migrerende type A -neuroblaster
4. Aktivt prolifererende celler eller transitforstærkende progenitorer (type C): udtrykker Nestin og danner klynger indbyrdes mellem kæder i hele regionen
Fungere
SVZ er et kendt sted for neurogenese og selvfornyende neuroner i den voksne hjerne , der tjener som sådan på grund af de interagerende celletyper, ekstracellulære molekyler og lokaliseret epigenetisk regulering, der fremmer sådan cellulær spredning. Sammen med den subgranulære zone i dentate gyrus fungerer den subventrikulære zone som en kilde til neurale stamceller (NSC'er) i processen med voksen neurogenese . Det rummer den største population af formerende celler i den voksne hjerne hos gnavere, aber og mennesker. I 2010 blev det vist, at balancen mellem neurale stamceller og neurale stamceller (NPC'er) opretholdes ved en interaktion mellem den epidermale vækstfaktorreceptorsignalvej og Notch -signalvejen.
Selv om det endnu ikke er blevet undersøgt indgående i den menneskelige hjerne, er SVZ-funktionen i gnaverhjernen i et vist omfang undersøgt og defineret for dets evner. Med sådan forskning har det vist sig, at den dobbeltfunktionelle astrocyt er den dominerende celle i gnaver SVZ; denne astrocyt fungerer ikke kun som en neuronal stamcelle, men også som en understøttende celle, der fremmer neurogenese gennem interaktion med andre celler. Denne funktion induceres også af mikroglia og endotelceller , der interagerer i samarbejde med neuronale stamceller for at fremme neurogenese in vitro, samt ekstracellulære matrixkomponenter såsom tenascin-C (hjælper med at definere grænser for interaktion) og Lewis X (binder vækst- og signalfaktorer til neurale forstadier). Den menneskelige SVZ er imidlertid forskellig fra gnaver SVZ på to forskellige måder; den første er, at astrocytterne af mennesker ikke er i tæt sammenstilling med det ependymale lag, snarere adskilt af et lag, der mangler cellelegemer; den anden er, at den menneskelige SVZ mangler kæder af migrerende neuroblaster set i gnavere SVZ, hvilket igen sørger for et mindre antal neuronale celler i mennesket end gnaveren. Af denne grund, mens gnaver SVZ viser sig som en værdifuld kilde til information om SVZ og dets struktur-til-funktion-forhold, vil den menneskelige model vise sig væsentligt anderledes.
Epigenetiske DNA -modifikationer har en central rolle i regulering af genekspression under differentiering af neurale stamceller . Omdannelsen af cytosin til 5-methylcytosin (5mC) i DNA med DNA-methyltransferase DNMT3A ser ud til at være en vigtig type epigenetisk modifikation, der forekommer i SVZ.
Derudover foreslår nogle nuværende teorier, at SVZ også kan tjene som et sted for spredning for hjernetumor stamceller (BTSC'er), der ligner neurale stamceller i deres struktur og evne til at differentiere til neuroner , astrocytter og oligodendrocytter . Undersøgelser har bekræftet, at en lille population af BTSC'er ikke kun kan producere tumorer, men de kan også opretholde det gennem medfødt selvfornyelse og multipotente evner. Selvom dette ikke tillader slutning om, at BTSC'er stammer fra neurale stamceller, rejser det et interessant spørgsmål om forholdet mellem vores egne celler og dem, der kan forårsage så meget skade.
Aktuel forskning
Der er i øjeblikket mange forskellige aspekter af SVZ undersøgt af enkeltpersoner i den offentlige og private sektor. Sådanne forskningsinteresser spænder fra SVZ's rolle i neurogenese , rettet neuronal migration, til den tidligere nævnte tumorigenese , såvel som mange andre. Nedenfor er der resuméer af arbejdet i tre forskellige laboratoriegrupper, der primært fokuserer på et aspekt af SVZ; disse omfatter SVZ's rolle i celleerstatning efter hjerneskade, simulering af NSC -proliferation og rolle i forskellige tumorigene kræftformer.
Rolle i celleerstatning efter hjerneskade
I deres anmeldelse har Romanko et al. karakteriseret virkningen af akut hjerneskade på SVZ. Samlet set fastslog forfatterne, at moderate fornærmelser mod SVZ tillod genopretning, mens mere alvorlige skader forårsagede permanent skade på regionen. Derudover er den neurale stamcellepopulation i SVZ sandsynligvis ansvarlig for denne skadesreaktion.
Bestrålingens virkninger på SVZ tilvejebragt en genkendelse af mængden eller dosis af stråling, der kan gives, bestemmes hovedsageligt af tolerancen for de normale celler nær tumoren . Som beskrevet førte den stigende dosis af stråling og alder til fald i tre celletyper af SVZ, men alligevel blev reparationskapaciteten af SVZ observeret på trods af manglen på nekrose af hvidt stof ; dette skete sandsynligvis fordi SVZ gradvist var i stand til at erstatte neuroglia i hjernen. Kemoterapeutika blev også testet for deres virkninger på SVZ, da de i øjeblikket bruges til mange sygdomme, men alligevel fører til komplikationer i centralnervesystemet . For at gøre dette blev methotrexat (MTX) brugt alene og i kombination med stråling for at finde ud af, at cirka 70% af den totale atomtæthed af SVZ var blevet opbrugt, men alligevel givet tab af neuroblastceller ( stamceller ), var det bemærkelsesværdigt at finde at SVZ NSC'er stadig ville generere neurosfærer, der ligner emner, der ikke modtog en sådan behandling. I forbindelse med afbrydelse af blodtilførslen til hjernen viste det sig, at cerebral hypoxi / iskæmi (H / I) også reducerede celletallet af SVZ med 20%, hvor 50% af neuroner i striatum og neocortex blev ødelagt, men celletyper af de dræbte SVZ var lige så uensartede som selve regionen. Ved efterfølgende test blev det fundet, at en anden del af hver celle blev elimineret, men alligevel forblev den mediale SVZ -cellepopulation for det meste i live. Dette kan tilvejebringe en vis modstandsdygtighed for sådanne celler, idet de uengagerede stamceller fungerer som den prolifererende befolkning efter iskæmi . Mekanisk hjerneskade fremkalder også cellemigration og spredning, som det blev observeret hos gnavere, og det kan også øge celleantallet, hvilket negerer den tidligere holdte opfattelse, at der ikke kan genereres nye neuronale celler.
Afslutningsvis var denne gruppe i stand til at bestemme, at celler i SVZ er i stand til at producere nye neuroner og glia gennem livet, da den ikke lider skade, da den er følsom over for skadelige virkninger. Derfor kan SVZ genoprette sig selv efter let skade og muligvis sørge for udskiftning af celleterapi til andre berørte områder i hjernen.
Neuropeptid Ys rolle i neurogenese
I et forsøg på at karakterisere og analysere mekanismen vedrørende spredning af neuronale celler inden for den subventrikulære zone, Decressac et al. observerede spredning af neurale forstadier i musens subventrikulære zone gennem injektion af neuropeptidet Y (NPY). NPY er et almindeligt udtrykt protein i centralnervesystemet, der tidligere har vist sig at stimulere spredning af neuronale celler i olfaktorisk epitel og hippocampus . Den peptid ’s virkninger blev observeret gennem BrdU mærkning og celle fænotypebestemmelse der fremlagt bevis for migrationen af neuroblaster gennem rostralt vandrende strøm til lugtekolben (bekræfter tidligere forsøg), og til striatum . Sådanne data understøtter forfatterens hypotese i, at neurogenese ville blive stimuleret ved introduktion af et sådant peptid .
Som NPY er en 36 aminosyre peptid forbundet med mange fysiologiske og patologiske tilstande, det har flere receptorer , der er bredt udtrykt i den udviklende og modne gnaverhjerne. Givet in vivo -undersøgelser udført af denne gruppe viste Y1 -receptoren imidlertid specifikt medierede neuroproliferative virkninger gennem induktion af NPY med øget ekspression i den subventrikulære zone. Identifikation af Y1 -receptoren kaster også lys over, at fænotypen af udtrykte celler fra sådanne mitotiske hændelser faktisk er celler, der er DCX + ( neuroblaster, der migrerer direkte til striatum ). Sammen med virkningerne af NPY -injektion på striatal dopamin- , GABA- og glutamatparametre til regulering af neurogenese i den subventrikulære zone (tidligere undersøgelse) er dette fund stadig under overvejelse, da det kunne være en sekundær modulator af de førnævnte neurotransmittere .
Som det er nødvendigt for al forskning, gennemførte denne gruppe sine eksperimenter med et bredt perspektiv på anvendelsen af deres fund, som de hævdede potentielt kunne gavne potentielle kandidater til endogen hjernereparation gennem stimulering af den subventrikulære zone neurale stamcelleproliferation. Denne naturlige molekylære regulering af voksen neurogenese ville være et supplement til terapier af passende molekyler, såsom den testede NPY- og Y1 -receptor, ud over farmakologiske derivater, for at sikre håndterbare former for neurodegenerative lidelser i striatalområdet.
Som en potentiel kilde til hjernetumorer
I et forsøg på at karakterisere den subventrikulære zones rolle i potentiel tumorigenese , Quinones-Hinojosa et al. fandt ud af, at hjernetumor stamceller (BTSC'er) er stamceller, der kan isoleres fra hjernetumorer ved lignende assays, der bruges til neuronale stamceller. Ved dannelse af klonale kugler, der ligner neurosfærer i neuronale stamceller, var disse BTSC'er i stand til at differentiere sig til neuroner , astrocytter og oligodendrocytter in vitro , men endnu vigtigere i stand til at starte tumorer ved lave cellekoncentrationer, hvilket giver en selvfornyelseskapacitet. Det blev derfor foreslået, at en lille population af BTSC'er med sådanne selvfornyelsesevner opretholder tumorer i sygdomme som leukæmi og brystkræft .
Flere karakteriserende faktorer fører til, at den foreslåede idé om neuronale stamceller (NSC'er) er oprindelsen til BTSC'er, da de deler flere funktioner. Disse funktioner er vist i figuren.
Denne gruppe giver bevis for SVZs tilsyneladende rolle i tumorigenese, som demonstreret ved besiddelse af mitogene receptorer og deres reaktion på mitogen stimulering, specifikt type C -celler, der udtrykker den epidermale vækstfaktorreceptor (EGFR), hvilket gør dem meget proliferative og invasive. Derudover viste det sig, at eksistensen af mikroglia og endotelceller i SVZ forstærker neurogenese , samt giver mulighed for en retningsbestemt migration af neuroblaster fra SVZ.
For nylig er den menneskelige SVZ blevet karakteriseret hos hjernetumorpatienter på fænotypisk og genetisk niveau. Disse data viser, at for halvdelen af patienterne er SVZ et nøjagtigt sted for tumorigenese, mens det for de resterende patienter repræsenterer en infiltreret region. Det er således klart muligt, at der hos mennesker eksisterer et forhold mellem NSC-generationen i regionen og de konsekvent selvfornyende celler i primære tumorer, der viger for sekundære tumorer, når de først er fjernet eller bestrålet.
Selvom det stadig er klart at bevise, om SVZ-stamcellerne er oprindelsescellen for hjernetumorer, såsom gliomer, er der stærke beviser, der tyder på øget tumoraggressivitet og dødelighed hos de patienter, hvis gliomer af høj kvalitet infiltrerer eller kontakter SVZ.
Ved prostatakræft er tumorinduceret neurogenese karakteriseret ved rekruttering af neurale stamceller (NPC) fra SVZ. NPC'er infiltrerer tumoren, hvor de differentieres til autonome neuroner (hovedsageligt adrenerge neuroner), der stimulerer tumorvækst.