Afvisning af transplantation - Transplant rejection
| Afvisning af transplantation | |
|---|---|
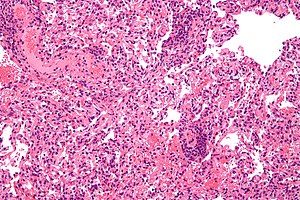 | |
| Mikrograf, der viser afvisning af lungetransplantation . Lunge biopsi . H & E plet . | |
| Specialitet | Immunologi |
| Behandling | Immunsuppressive lægemidler |
Transplantatafvisning forekommer, når transplanteret væv afvises af modtagerens immunsystem , hvilket ødelægger det transplanterede væv. Afvisning af transplantation kan reduceres ved at bestemme den molekylære lighed mellem donor og modtager og ved brug af immunsuppressive lægemidler efter transplantation.
Forebyggelse af afvisning af forplantning
Den første vellykkede organtransplantation, udført i 1954 af Joseph Murray , involverede identiske tvillinger, og der blev derfor ikke observeret afvisning. Ellers korrelerer antallet af mismatchede genvarianter, nemlig alleler , kodende celleoverflademolekyler kaldet større histokompatibilitetskompleks (MHC), klasser I og II, med hastigheden og sværhedsgraden af transplantatafstødning. Hos mennesker kaldes MHC også humant leukocytantigen (HLA).
Selvom cytotoksisk crossmatch-assay kan forudsige afstødning medieret af cellulær immunitet , har genetiske ekspressionstest, der er specifikke for organtypen, der skal transplanteres, f.eks. AlloMap Molecular Expression Testing , en høj negativ forudsigelsesværdi. Transplantation af kun ABO -kompatible transplantater (matchende blodgrupper mellem donor og modtager) hjælper med at forhindre afstødning medieret af humoristisk immunitet .
ABO-inkompatible transplantationer
Fordi meget små børn (generelt under 12 måneder, men ofte så gamle som 24 måneder) ikke har et veludviklet immunsystem, er det muligt for dem at modtage organer fra ellers uforenelige donorer. Dette er kendt som ABO-inkompatibel (ABOi) transplantation. Graftoverlevelse og patientdødelighed er omtrent det samme mellem ABOi og ABO-kompatible (ABOc) modtagere. Mens fokus har været på spædbarnshjerttransplantationer, gælder principperne generelt for andre former for fast organtransplantation.
De vigtigste faktorer er, at modtageren ikke har produceret isohemagglutininer , og at de har lave niveauer af T- celleuafhængige antigener . UNOS -regler tillader ABOi -transplantation hos børn under to år, hvis isohemagglutinintitre er 1: 4 eller derunder, og hvis der ikke findes en matchende ABOc -modtager. Undersøgelser har vist, at den periode, hvorunder en modtager kan gennemgå ABOi -transplantation, kan forlænges ved udsættelse for ikke -selv A- og B -antigener. Hvis modtageren (f.eks. Type B-positiv med en type AB-positiv transplantat) kræver modtagende gentransplantation, kan modtageren modtage et nyt organ af enten blodtype.
Der er opnået begrænset succes med ABO-inkompatible hjertetransplantationer hos voksne, selvom dette kræver, at de voksne modtagere har lave niveauer af anti-A eller anti-B antistoffer. Nyretransplantation er mere vellykket med lignende langsigtede transplantatoverlevelsesrater som ABOc-transplantationer.
Immunologiske mekanismer til afvisning
Afvisning er et adaptivt immunrespons via cellulær immunitet (medieret af dræber -T -celler, der inducerer apoptose af målceller) samt humoral immunitet (medieret af aktiverede B -celler, der udskiller antistofmolekyler ), selvom handlingen er forbundet med komponenter i medfødt immunrespons ( fagocytter) og opløselige immunproteiner). Forskellige typer af transplanterede væv har en tendens til at favorisere forskellige balancer af afstødningsmekanismer.
Immunisering
Et dyrs eksponering for antigenerne fra et andet medlem af den samme eller lignende art er allostimulering , og vævet er allogent . Transplanterede organer erhverves ofte fra en kadaver (normalt en vært, der var bukket under for traumer), hvis væv allerede havde pådraget sig iskæmi eller betændelse .
Dendritiske celler (DC'er), som er de primære antigenpræsenterende celler (APC'er), af donorvævet vandrer til modtagerens perifere lymfoide væv ( lymfoide follikler og lymfeknuder ), og præsentere donorens selv peptider til modtagerens lymfocytter (immunceller bosat i lymfoide væv). Lymfocytter omfatter to klasser, der vedtager adaptiv immunitet , også kaldet specifik immunitet. Lymfocytter af specifikke immunitet T -celler - herunder underklasserne hjælper T -celler og dræber -T -celler - og B -celler .
Modtagerens hjælper T-celler koordinere specifik immunitet rettet mod donorens selv -peptider eller ved donorens Major histokompatibilitetskompleks -molekyler, eller i begge.
Immunhukommelse
Når T4 -hukommelseshjælper -T -cellernes CD4 -receptorer binder til MHC -klasse II -molekylerne, der udtrykkes på overfladerne af målcellerne i transplantatvævet, kan hukommelseshjælperens T -cellers T -celle -receptorer (TCR'er) genkende deres målantigen, der præsenteres af MHC -klasse II -molekylerne. Hukommelseshjælperens T -celle producerer efterfølgende kloner, der som effektorceller udskiller immunsignalmolekyler ( cytokiner ) i omtrent den cytokinbalance, der havde hersket ved hukommelseshjælperens T -celle, for at memorisere antigenet. Da priminghændelsen i dette tilfælde fandt sted midt i betændelse, er immunhukommelsen proinflammatorisk.
Cellulær immunitet
Transplantavstødning er en type IV ("forsinket") overfølsomhedsreaktion medieret af T -celler, hvor transplantatmodtagerens T -celler bliver alloreaktive, genkender større histokompatibilitetskompleks (MHC) antigener på det donerede organ og fremmer lokale immun- og inflammatoriske reaktioner for at forsvare sig mod den opfattede trussel. T-cellerne kan genkende det donerede organs MHC-antigener gennem en af to ruter: en direkte vej, hvor det transplanterede organs antigenpræsenterende celler (såsom dendritiske celler, der indeholder MHC klasse I-molekyler) migrerer til modtagerens lymfeknuder og aktiverer T-celler der bor der; eller en indirekte vej, hvor modtagerens dendritiske celler kan endocytose donorproteiner såsom donor MHC -proteiner og aktivere T -celler i sekundære lymfoide væv. Alloreaktive dræber -T -celler, også kaldet cytotoksiske T -lymfocytter (CTL'er), har CD8 -receptorer, der dokker til det transplanterede vævs MHC klasse I -molekyler, som viser donorens selvpeptider. (I den levende donor hjalp en sådan præsentation af selvantigener med at opretholde selvtolerance.) Derefter genkender T -cellers receptorer (TCR'er) af de dræbende T -cellers deres matchende epitop og udløser målcellens programmerede celledød ved apoptose.
Humoral immunitet
Udviklet gennem en tidligere primær eksponering, der grundlagde specifik immunitet over for ikke -selvantigenet , kan en transplantatmodtager have specifikt antistof, der krydsreagerer med donorvævet ved transplantationshændelsen, en sekundær eksponering . Dette er typisk for mindre eksponering af blodgrupper (f.eks. Kell) efter allogen blodtransfusion eller traumer under graviditeten. Ved sekundær eksponering interagerer disse krydsreaktive antistofmolekyler med aspekter af medfødt immunitet - opløselige immunproteiner kaldet komplement og medfødte immunceller kaldet fagocytter - som betænder og ødelægger det transplanterede væv.
Antistof
Udskilt af en aktiveret B -celle, derefter kaldet plasmacelle , er et antistofmolekyle et opløseligt immunoglobulin (Ig), hvis grundenhed er formet som bogstavet Y : de to arme er Fab -regionerne , mens den enkelte stilk er Fc -regionen . Hver af de to spidser i Fab -regionen er paratopen , der binder en matchende molekylær sekvens og dens 3D -form (konformation), som i det hele taget kaldes epitop , inden for målantigenet.
Opsonisering
IgG's Fc -region muliggør også opsonisering af en fagocyt , en proces, hvorved Fc -receptoren på fagocytten - såsom neutrofiler i blod og makrofager i væv - binder antistofmolekylets FC -stilk, og fagocytten udviser forbedret optagelse af antigenet, der er knyttet til antistofmolekylets Fab -region.
Komplement kaskade
Når paratopen af Ig -klasse gamma (IgG) binder dets matchende epitop, skifter IgG's Fc -region konformationelt og kan være vært for et komplementprotein, hvilket initierer komplementkaskaden, der slutter ved at slå et hul i en cellemembran. Med mange huller så stansede, siver væske ind i cellen og brister den.
Celleaffald kan genkendes som skaderelaterede molekylære mønstre (DAMP'er) ved mønstergenkendelsesreceptorer (PRR'er), såsom Toll-lignende receptorer (TLR'er), på membraner af fagocytter , som derefter udskiller proinflammatoriske cytokiner , der rekrutterer flere fagocytter til trafik til området ved at registrere koncentrationsgradienten af de udskillede cytokiner ( kemotaksi ).
| Væv | Mekanisme |
|---|---|
| Blod | Antistoffer (isohaemagglutininer) |
| Nyre | Antistoffer, cellemedieret immunitet (CMI) |
| Hjerte | Antistoffer, CMI |
| Hud | CMI |
| Knoglemarv | CMI |
| Hornhinde | Normalt accepteret, medmindre det vaskulariseres: CMI |
Medicinske kategorier
Hyperakut afvisning
Initieret ved forudeksisterende humoral immunitet , hyperakut afstødning manifesterer inden for få minutter efter transplantation, og hvis væv efterlades implanteret bringer systemisk inflammatorisk respons syndrom . Af høj risiko i nyre transplantationer er hurtig sammenklumpning, nemlig agglutinering af røde blodlegemer (RBC'er eller erytrocytter), som et antistof binder flere målceller på én gang.
Selvom nyrer rutinemæssigt kan fås fra menneskelige donorer, mangler de fleste organer, hvilket fører til overvejelse af xenotransplantationer fra andre arter. Grise er især sandsynlige kilder til xenotransplantationer, valgt ud fra de anatomiske og fysiologiske egenskaber, de deler med mennesker. Imidlertid har sukker galactose-alfa-1,3-galactose (αGal) været impliceret som en vigtig faktor i hyperakut afstødning ved xenotransplantation . I modsætning til stort set alle andre pattedyr laver mennesker og andre primater ikke αGal, og genkender det faktisk som et antigen. Under transplantation genkender xenoreaktive naturlige antistoffer αGal på transplantatendotelet som et antigen, og det resulterende komplement-medierede immunrespons fører til en afvisning af transplantationen.
Akut afvisning
Fremkaldelse med dannelse af cellulær immunitet , akut afstødning forekommer i nogen grad i alle transplantationer, undtagen mellem identiske tvillinger, medmindre der opnås immunsuppression (som regel gennem narkotika). Akut afvisning begynder så tidligt som en uge efter transplantation, risikoen er størst i de første tre måneder, selvom den kan forekomme måneder til år senere. Meget vaskulært væv, såsom nyre eller lever, er ofte vært for de tidligste tegn - især ved endotelceller, der beklæder blodkar - selvom det til sidst forekommer i omtrent 10 til 30% af levertransplantationer og 10 til 20% af nyretransplantationer. En enkelt episode med akut afstødning kan genkendes og behandles hurtigt, normalt forhindrer organsvigt, men tilbagevendende episoder fører til kronisk afvisning . Det menes, at processen med akut afstødning medieres af den cellemedierede vej, specifikt af mononukleære makrofager og T-lymfocytter. Histologi for akut afstødning defineres ved tæt lymfocytisk cellulært infiltrat såvel som vaskulitis af organdonorskibe.
Kronisk afvisning
Udtrykket kronisk afvisning beskrev oprindeligt langsigtet tab af funktion i transplanterede organer via fibrose af det transplanterede vævs blodkar. Dette er nu kronisk allograft vaskulopati , men kronisk afvisning efterlader afvisning på grund af flere patentaspekter af immunitet.
Kronisk afvisning forklarer langvarig morbiditet hos de fleste lungetransplantationsmodtagere, medianoverlevelsen cirka 4,7 år, cirka halvdelen af spændet i forhold til andre større organtransplantationer. I histopatologi er tilstanden bronchiolitis obliterans , som klinisk præsenteres som progressiv luftstrømobstruktion, der ofte involverer dyspnø og hoste , og patienten til sidst bukker under for lungeinsufficiens eller sekundær akut infektion.
Luftstrømningsobstruktion, der ikke kan tilskrives anden årsag, er mærket bronchiolitis obliterans syndrom (BOS), bekræftet af et vedvarende fald - tre eller flere uger - i tvunget ekspiratorisk volumen (FEV 1 ) med mindst 20%. BOS ses hos over 50% af lungetransplantationsmodtagere med 5 år og hos over 80% med ti år. Først bemærket er infiltration af lymfocytter efterfulgt af epitelcelleskade , derefter inflammatoriske læsioner og rekruttering af fibroblaster og myofibroblaster , som formerer sig og udskiller proteiner, der danner arvæv. Generelt menes uforudsigelig, BOS -progression varierer meget: lungefunktionen kan pludselig falde, men stabilisere sig i årevis eller hurtigt udvikle sig til døden inden for få måneder. Risikofaktorer omfatter tidligere akutte afstødningsepisoder, gastroøsofageal reflukssygdom , akutte infektioner, bestemte aldersgrupper, HLA-fejltilpasning, lymfocytisk bronkiolitis og transplantatdysfunktion (f.eks. Luftvejsiskæmi).
Afvisning på grund af manglende overholdelse
En hovedårsag til transplantatafvisning er manglende overholdelse af foreskrevne immunsuppressive midler. Dette er især tilfældet for unge modtagere, med non-adherence-hastigheder nær 50% i nogle tilfælde.
Afvisning af afvisning
Diagnose af akut afvisning er baseret på kliniske data - patientens tegn og symptomer, men kræver også laboratoriedata som f.eks. Blod eller endda vævsbiopsi . Laboratoriepatologen søger generelt tre hovedhistologiske tegn: (1) infiltrering af T -celler , måske ledsaget af infiltrerende eosinofiler , plasmaceller og neutrofiler , især i oplysende forhold, (2) strukturelt kompromis af vævsanatomi, varierende efter transplanteret vævstype, og (3) skade på blodkar. Vævsbiopsi er imidlertid begrænset af prøveudtagningsbegrænsninger og risici/komplikationer ved den invasive procedure. Cellulær magnetisk resonansbilleddannelse (MRI) af immunceller, der er radioaktivt mærket in vivo, kan - på samme måde som Gene Expression Profiling (GEP) - tilbyde ikke -invasiv testning.
Afvisning behandling
Hyperakut afvisning manifesterer sig alvorligt og inden for få minutter, og derfor er behandlingen øjeblikkelig: fjernelse af vævet. Kronisk afstødning betragtes generelt som irreversibel og dårligt egnet til behandling - kun genransplantation er generelt indiceret, hvis det er muligt - selvom inhaleret ciclosporin undersøges for at forsinke eller forhindre kronisk afstødning af lungetransplantationer. Akut afvisning behandles med en eller flere af et par strategier. På trods af behandling er afvisning stadig en væsentlig årsag til transplantationssvigt.
Immunsuppressiv behandling
Et kort forløb af højdosis kortikosteroider kan påføres og gentages. Triple terapi tilføjer en calcineurin-hæmmer og et anti-proliferativt middel . Hvor calcineurinhæmmere eller steroider er kontraindiceret, anvendes mTOR -hæmmere .
Immunsuppressive lægemidler :
- Kortikosteroider
- Calcineurin -hæmmere
- Anti-proliferativer
- mTOR -hæmmere
Antistofbaserede behandlinger
Antistof, der er specifikt for at vælge immunkomponenter, kan føjes til immunsuppressiv behandling. Det monoklonale anti-T-celle-antistof OKT3 , der engang blev brugt til at forhindre afstødning og stadig lejlighedsvis bruges til behandling af alvorlig akut afstødning, er faldet i unåde, da det normalt medfører alvorligt cytokinfrigivelsessyndrom og sen post-transplantation lymfoproliferativ lidelse . (OKT3 er kun tilgængelig i Det Forenede Kongerige til brug med navngivne patienter.)
Antistoflægemidler :
- Monoklonale anti-IL-2Ra-receptorantistoffer
- Monoklonale anti-IL-6R-receptorantistoffer
- Polyklonale anti-T-celle antistoffer
- Anti-thymocyt globulin (ATG)
- Anti-lymfocytglobulin (ALG)
- Monoklonale anti-CD20 antistoffer
Blodoverførsel
Tilfælde, der er ildfaste for immunosuppressiv eller antistofbehandling, behandles undertiden med fotopherese eller ekstrakorporeal fotoimmunbehandling (ECP) for at fjerne antistofmolekyler, der er specifikke for det transplanterede væv.
Marvtransplantation
Knoglemarvstransplantation kan erstatte transplantatmodtagerens immunsystem med donorens, og modtageren accepterer det nye organ uden afvisning. Marvens hæmatopoietiske stamceller - reservoiret af stamceller, der genopfylder udmattede blodlegemer, herunder hvide blodlegemer, der danner immunsystemet - skal være af den person, der donerede organet eller af en identisk tvilling eller en klon . Der er imidlertid risiko for graft-versus-host-sygdom (GVHD), hvorved modne lymfocytter, der kommer ind med margen, genkender de nye værtsvæv som fremmede og ødelægger dem.
Genterapi
Genterapi er en anden metode, der kan bruges. I denne metode ville de gener, der får kroppen til at afvise transplantationer, blive deaktiveret. Forskning udføres stadig, og ingen genterapier bruges til dato til behandling af patienter. Aktuel forskning har en tendens til at fokusere på Th1 og Th17, som formidler allograftafstødning via CD4- og CD8 T -cellerne .
Se også
Referencer
eksterne links
| Klassifikation | |
|---|---|
| Eksterne ressourcer |
