Neuropsykofarmakologi - Neuropsychopharmacology
Neuropsykofarmakologi , en tværfaglig videnskab relateret til psykofarmakologi (hvordan medicin påvirker sindet) og grundlæggende neurovidenskab , er undersøgelsen af de neurale mekanismer, som lægemidler virker på for at påvirke adfærd. Det indebærer forskning af mekanismer inden for neuropatologi , farmakodynamik (lægemiddelvirkning) , psykiatrisk sygdom og bevidsthedstilstande . Disse undersøgelser indledes på det detaljerede niveau, der involverer neurotransmission / receptoraktivitet , biokemiske processer og neurale kredsløb. Neuropsykofarmakologi afløser psykofarmakologi inden for områderne "hvordan" og "hvorfor" og behandler derudover andre spørgsmål om hjernens funktion. Følgelig omfatter det kliniske aspekt af feltet psykiatriske (psykoaktive) såvel som neurologiske (ikke-psykoaktive) farmakologi-baserede behandlinger. Udviklingen inden for neuropsykofarmakologi kan direkte påvirke undersøgelser af angstlidelser , affektive lidelser , psykotiske lidelser , degenerative lidelser , spiseadfærd og søvnadfærd .
Historie
Lægemidler som opium , alkohol og visse planter er blevet brugt i årtusinder af mennesker for at lette lidelse eller ændre bevidsthed, men indtil den moderne videnskabelige æra var kendskabet til, hvordan stofferne faktisk virkede, ganske begrænset, mest farmakologisk viden var mere en række observationer end en sammenhængende model. Første halvdel af det 20. århundrede så psykologi og psykiatri som stort set fænomenologisk , idet adfærd eller temaer, der blev observeret hos patienter, ofte kunne korreleres med en begrænset række faktorer, såsom barndomserfaring, nedarvede tendenser eller skade på bestemte hjerneområder. Modeller af mental funktion og dysfunktion var baseret på sådanne observationer. Faktisk dispenserede den adfærdsmæssige gren af psykologien helt med, hvad der faktisk skete inde i hjernen, hvad angår de fleste psykiske dysfunktioner som det, der kunne kaldes "softwarefejl". I samme æra blev nervesystemet gradvist undersøgt på mikroskopisk og kemisk niveau, men der var stort set ingen gensidig fordel med kliniske felter - indtil flere udviklinger efter Anden Verdenskrig begyndte at bringe dem sammen. Neuropsykofarmakologi kan anses for at være begyndt i de tidligere 1950'ere med opdagelsen af lægemidler som MAO -hæmmere , tricykliske antidepressiva , thorazin og lithium, som viste en vis klinisk specificitet for psykiske sygdomme som depression og skizofreni. Indtil da var behandlinger, der rent faktisk var rettet mod disse komplekse sygdomme, praktisk talt ikke-eksisterende. De fremtrædende metoder, der direkte kunne påvirke hjernekredsløb og neurotransmitterniveauer, var præfrontal lobotomi og elektrokonvulsiv terapi , hvor sidstnævnte blev udført uden muskelafslappende midler, og som begge ofte forårsagede patienten store fysiske og psykiske skader.
Det område, der nu er kendt som neuropsykofarmakologi, er et resultat af vækst og udvidelse af mange tidligere isolerede felter, som har mødt kernen i psykiatrisk medicin og engagerer en bred vifte af fagfolk fra psykiatere til forskere inden for genetik og kemi. Anvendelsen af udtrykket har vundet popularitet siden 1990 med grundlæggelsen af flere tidsskrifter og institutioner, såsom det ungarske college for neuropsykofarmakologi . Dette hurtigt modne felt viser en vis grad af flux, da forskningshypoteser ofte omstruktureres baseret på ny information.
Oversigt
En implicit forudsætning inden for neuropsykofarmakologi med hensyn til de psykologiske aspekter er, at alle sindstilstande , herunder både normale og lægemiddelinducerede ændrede tilstande, og sygdomme, der involverer mental eller kognitiv dysfunktion , har et neurokemisk grundlag på det fundamentale niveau og visse kredsløbsspor i det centrale nervesystem på et højere niveau. (Se også: Neuron -doktrin ) Således er forståelsen af nerveceller eller neuroner i hjernen central for at forstå sindet. Det er begrundet, at de involverede mekanismer kan belyses ved hjælp af moderne kliniske og forskningsmetoder såsom genetisk manipulation hos dyr, billeddannelsesteknikker såsom funktionel magnetisk resonansbilleddannelse ( fMRI ) og in vitro -undersøgelser, der anvender selektive bindemidler på levende vævskulturer. Disse gør det muligt at overvåge og måle neural aktivitet som reaktion på en række forskellige testbetingelser. Andre vigtige observationsværktøjer omfatter radiologisk billeddannelse såsom positronemissionstomografi ( PET ) og enkeltfotonemissionstomografi ( SPECT ). Disse afbildningsteknikker er ekstremt følsomme og kan billede bittesmå molekylære koncentrationer af størrelsesordenen 10 -10 M, såsom fundet med extrastriatal D 1 receptor for dopamin.
Et af de ultimative mål er at udtænke og udvikle recept til behandling af en række neuropatologiske tilstande og psykiatriske lidelser . Mere dybtgående kan den opnåede viden imidlertid give indsigt i selve menneskets tankegang, mentale evner som læring og hukommelse og måske selve bevidstheden. Et direkte produkt af neuropsykofarmakologisk forskning er den vidensbase, der kræves for at udvikle lægemidler, der virker på meget specifikke receptorer i et neurotransmittersystem. Disse lægemidler med "hyperselektiv virkning" ville muliggøre direkte målretning af specifikke steder med relevant neural aktivitet og derved maksimere lægemidlets effekt (eller teknisk styrke ) inden for det kliniske mål og minimere bivirkninger . Der er imidlertid nogle tilfælde, hvor en vis grad af farmakologisk promiskuitet er acceptabelt og endda ønskeligt, hvilket giver mere ønskelige resultater end et mere selektivt middel ville. Et eksempel på dette er Vortioxetine , et lægemiddel, der ikke er særlig selektivt som en serotonin genoptagelseshæmmer, der har en betydelig grad af serotonin modulerende aktivitet, men som har vist reducerede seponeringssymptomer (og reduceret sandsynlighed for tilbagefald ) og stærkt reduceret forekomst af seksuel dysfunktion , uden tab af antidepressiv virkning.
Grundlaget er i øjeblikket ved at blive banet for den næste generation af farmakologiske behandlinger, som vil forbedre livskvaliteten med øget effektivitet. For eksempel modsat tidligere tankegang er det nu kendt, at den voksne hjerne til en vis grad vokser nye neuroner - hvis undersøgelse ud over neurotrofiske faktorer kan give håb om neurodegenerative sygdomme som Alzheimers , Parkinsons , ALS og typer af chorea . Alle de proteiner, der er involveret i neurotransmission, er en lille brøkdel af de mere end 100.000 proteiner i hjernen. Således er der mange proteiner, der ikke engang er i den direkte vej for signaltransduktion , hvoraf enhver stadig kan være et mål for specifik terapi. På nuværende tidspunkt rapporteres nye farmakologiske tilgange til sygdomme eller tilstande med en hastighed på næsten en om ugen.
Neurotransmission
Så vidt vi ved, er alt, hvad vi opfatter, føler, tænker, ved og gør, et resultat af neuroner, der fyrer og nulstiller. Når en celle i hjernen affyres, kan små kemiske og elektriske svingninger kaldet handlingspotentialet påvirke affyringen af så mange som tusind andre neuroner i en proces kaldet neurotransmission . På denne måde genereres og transporteres signaler gennem netværk af neuroner, hvis store elektriske effekt kan måles direkte på hovedbunden af en EEG -enhed.
I det sidste årti af det 20. århundrede var den væsentlige viden om alle de centrale træk ved neurotransmission blevet opnået. Disse funktioner er:
- Den syntese og opbevaring af neurotransmitter stoffer,
- Transport af synaptiske vesikler og efterfølgende frigivelse i synapsen ,
- Receptoraktivering og kaskadefunktion ,
- Transportmekanismer (genoptagelse) og/eller enzymnedbrydning
De nyere fremskridt involverer forståelse på det organiske molekylære niveau; biokemisk virkning af de endogene ligander , enzymer , receptorproteiner osv. De kritiske ændringer, der påvirker cellefyring, opstår, når signalneurotransmitterne fra en neuron, der fungerer som ligander, binder til receptorer af en anden neuron. Mange neurotransmittersystemer og receptorer er velkendte, og forskning fortsætter hen imod identifikation og karakterisering af et stort antal meget specifikke undertyper af receptorer. For de seks mere vigtige neurotransmittere Glu , GABA , Ach , NE , DA og 5HT (opført på neurotransmitter ) er der mindst 29 store undertyper af receptor. Yderligere "undertyper" eksisterer sammen med varianter, der i alt er hundredevis af kun disse 6 sendere. - (se f.eks. serotoninreceptor .) Det viser sig ofte, at receptorsubtyper har differentieret funktion, hvilket i princippet åbner mulighed for raffineret forsætlig kontrol over hjernens funktion.
Det har tidligere været kendt, at den ultimative kontrol over membranspændingen eller potentialet i en nervecelle og dermed affyringen af cellen ligger hos de transmembrane ionkanaler, der styrer membranstrømmene via ionerne K + , Na + og Ca + + , og af mindre betydning Mg ++ og Cl - . Koncentrationsforskellene mellem indersiden og ydersiden af cellen bestemmer membranspændingen.
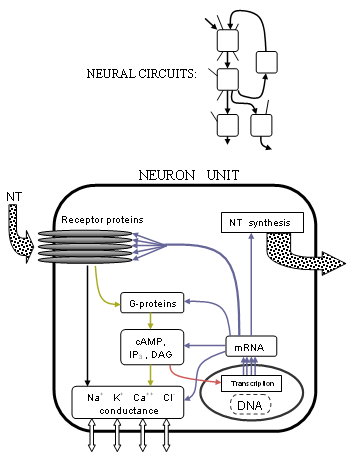
Præcis hvordan disse strømme kontrolleres er blevet meget tydeligere med fremskridtene i receptorstruktur og G-proteinkoblede processer. Mange receptorer viser sig at være pentameriske klynger af fem transmembrane proteiner (ikke nødvendigvis de samme) eller receptorsubenheder , der hver er en kæde af mange aminosyrer. Sendere binder typisk ved krydset mellem to af disse proteiner på de dele, der stikker ud fra cellemembranen. Hvis receptoren er af ionotrop type, vil en central pore eller kanal i midten af proteinerne blive flyttet mekanisk for at tillade visse ioner at strømme igennem og dermed ændre ionkoncentrationsforskellen. Hvis receptoren er af den metabotropiske type, vil G-proteiner forårsage metabolisme inde i cellen, som i sidste ende kan ændre andre ionkanaler. Forskere forstår bedre, præcis hvordan disse ændringer sker baseret på proteinstrukturens former og kemiske egenskaber.
Omfanget af denne aktivitet er blevet strakt endnu mere til selve livets plan siden afklaringen af mekanismen, der ligger til grund for gentranskription . Den syntese af cellulære proteiner fra nukleare DNA har samme grundlæggende maskiner til alle celler; hvis udforskning nu har et fast grund takket være Human Genome Project, der har opregnet hele den menneskelige DNA -sekvens, selvom mange af de anslåede 35.000 gener stadig mangler at blive identificeret. Den komplette neurotransmissionsproces strækker sig til det genetiske niveau. Genekspression bestemmer proteinstrukturer gennem type II RNA -polymerase . Så enzymer, der syntetiserer eller nedbryder neurotransmittere, receptorer og ionkanaler, er hver især fremstillet af mRNA via DNA -transkription af deres respektive gen eller gener. Men neurotransmission, ud over at styre ionkanaler enten direkte eller på anden måde gennem metabotrope processer, modulerer faktisk også genekspression. Dette opnås mest fremtrædende ved modifikation af transskriptionsinitieringsprocessen ved hjælp af en række forskellige transkriptionsfaktorer frembragt ved receptoraktivitet.
Bortset fra de vigtige farmakologiske muligheder for genekspressionsveje tillader et gens korrespondance med dets protein det vigtige analytiske værktøj til gen -knockout . Levende prøver kan oprettes ved hjælp af homolog rekombination , hvor et specifikt gen ikke kan udtrykkes. Organismen vil derefter mangle det associerede protein, som kan være en specifik receptor. Denne metode undgår kemisk blokade, der kan forårsage forvirrende eller tvetydige sekundære effekter, så virkningerne af mangel på receptor kan undersøges i renere forstand.
Narkotika
Indførelsen af mange klasser af lægemidler er i princippet ligetil: ethvert kemikalie, der kan forstærke eller formindske virkningen af et målprotein, kan undersøges nærmere for sådan anvendelse. Tricket er at finde sådan et kemikalie, der er receptorspecifikt (jf. " Snavset stof ") og sikkert at indtage. 2005 Physicians 'Desk Reference viser to gange antallet af receptpligtige lægemidler som 1990 -versionen. Mange mennesker kender nu " selektive serotonin genoptagelseshæmmere " eller SSRI'er, der eksemplificerer moderne lægemidler . Disse SSRI -antidepressive lægemidler, såsom Paxil og Prozac, hæmmer selektivt og derfor primært transporten af serotonin, hvilket forlænger aktiviteten i synapsen. Der er mange kategorier af selektive lægemidler, og transportblokering er kun en virkningsmåde. The FDA har godkendt lægemidler, der selektivt virker på hver af de store neurotransmittere såsom NE genoptagelsesinhibitor antidepressiva, DA blocker antipsykotika og GABA agonist beroligende midler ( benzodiazepiner ).
Nye endogene kemikalier identificeres løbende. Der er fundet specifikke receptorer for stofferne THC (cannabis) og GHB , med endogene transmittere anandamid og GHB. En anden ny stor opdagelse fandt sted i 1999, da orexin eller hypocretin viste sig at have en rolle i ophidselse, da manglen på orexinreceptorer afspejler narkolepsi . Orexinagonisme kan forklare den antinarcoleptiske virkning af lægemidlet modafinil, der allerede blev brugt kun et år tidligere.
Det næste trin, som store farmaceutiske virksomheder i øjeblikket arbejder hårdt på at udvikle, er receptorsubtypespecifikke lægemidler og andre specifikke midler. Et eksempel er skubbet til bedre angstdæmpende midler ( anxiolytika ) baseret på GABA A (α2) agonister, CRF 1 antagonister og 5HT 2c antagonister. Et andet er forslaget om nye udforskningsveje for antipsykotika, såsom glycin -genoptagelseshæmmere . Selvom kapaciteterne findes for receptorspecifikke lægemidler, er en mangel ved lægemiddelterapi manglen på evne til at tilvejebringe anatomisk specificitet. Ved at ændre receptorfunktion i en del af hjernen kan unormal aktivitet induceres i andre dele af hjernen på grund af den samme type receptorændringer. Et almindeligt eksempel er effekten af D 2 -ændrende lægemidler (neuroleptika), som kan hjælpe skizofreni, men forårsage en række forskellige dyskinesier ved deres virkning på motorisk cortex.
Moderne undersøgelser afslører detaljer om mekanismer for skader på nervesystemet, såsom apoptose (programmeret celledød) og afbrydelse af frie radikaler . Phencyclidin har vist sig at forårsage celledød i striatopallidale celler og unormal vakuolisering i hippocampus og andre neuroner. Den hallucinogen vedvarende opfattelse disorder (HPPD), også kendt som post-psykedelisk opfattelse lidelse , er blevet observeret hos patienter, så længe 26 år efter LSD brug. Den sandsynlige årsag til HPPD er beskadigelse af det hæmmende GABA -kredsløb i den visuelle vej (GABA -agonister såsom midazolam kan reducere nogle virkninger af LSD -forgiftning). Skaden kan skyldes et excitotoksisk respons fra 5HT 2 interneuroner . [Bemærk: Langt de fleste LSD -brugere oplever ikke HPPD. Dens manifestation kan være lige så afhængig af individuel hjernekemi som af stoffet selv.] Hvad angår MDMA , bortset fra vedvarende tab af 5HT og SERT , findes langvarig reduktion af serotonergiske axoner og terminaler fra kortvarig brug og genvækst kan have en kompromitteret funktion.
Neurale kredsløb
Det er en ikke så nylig opdagelse, at mange funktioner i hjernen er noget lokaliseret til tilknyttede områder som motorik og taleevne. Funktionelle foreninger af hjerneanatomi suppleres nu med kliniske, adfærdsmæssige og genetiske korrelater af receptorvirkning, der fuldender kendskabet til neural signalering (se også: Human Cognome Project ) . Neuronernes signalveje hyperorganiseres ud over celleskalaen til ofte komplekse neurale kredsløb. Kendskab til disse veje er måske den letteste at fortolke, idet den er mest genkendelig ud fra et systemanalysemæssigt synspunkt, som det kan ses i de følgende abstracts.
Næsten alle lægemidler med et kendt misbrugspotentiale har vist sig at modulere aktivitet (direkte eller indirekte) i det mesolimbiske dopaminsystem, som omfatter og forbinder det ventrale tegmentale område i midthjernen med hippocampus, medial præfrontal cortex og amygdala i forhjernen ; samt kernen accumbens i de basale ganglieres ventrale striatum. Især nucleus accumbens (NAc) spiller en vigtig rolle i at integrere oplevelsesmæssig hukommelse fra hippocampus, følelser fra amygdala og kontekstuel information fra PFC for at hjælpe med at forbinde bestemte stimuli eller adfærd med følelser af glæde og belønning; kontinuerlig aktivering af dette belønningsindikatorsystem med et vanedannende stof kan også forårsage, at tidligere neutrale stimuli bliver kodet som tegn på, at hjernen er ved at modtage en belønning. Dette sker via den selektive frigivelse af dopamin, en neurotransmitter, der er ansvarlig for følelser af eufori og nydelse. Brugen af dopaminerge lægemidler ændrer mængden af dopamin frigivet i hele det mesolimbiske system, og regelmæssig eller overdreven brug af lægemidlet kan resultere i en langsigtet nedregulering af dopaminsignalering, selv efter at en person holder op med at indtage stoffet. Dette kan få den enkelte til at deltage i mild til ekstrem narkotikasøgende adfærd, da hjernen regelmæssigt begynder at forvente den øgede tilstedeværelse af dopamin og de ledsagende følelser af eufori, men hvor problematisk dette er, afhænger meget af stoffet og situationen.
Der er gjort betydelige fremskridt med centrale mekanismer for visse hallucinogene lægemidler . Det er på dette tidspunkt kendt med relativ sikkerhed, at de primære fælles effekter af en bred farmakologisk gruppe af hallucinogener, undertiden kaldet "klassiske psykedelika", stort set kan tilskrives agonisme af serotoninreceptorer. 5HT 2A -receptoren, som synes at være den mest kritiske receptor for psykedelisk aktivitet, og 5HT 2C -receptoren, som er et vigtigt mål for de fleste psykedelika, men som ikke har nogen klar rolle i hallucinogenese, er involveret ved at frigive glutamat i frontal cortex , mens samtidig i locus coeruleus fremmes sensorisk information og spontan aktivitet falder. 5HT 2A- aktivitet har en netto pro-dopaminerg effekt, mens 5HT 2C- receptoragonisme har en hæmmende virkning på dopaminerg aktivitet, især i den præfrontale cortex. En hypotese tyder på, at i den frontale cortex fremmer 5HT 2A sene asynkrone excitatoriske postsynaptiske potentialer , en proces, der modvirkes af serotonin selv gennem 5HT 1- receptorer, hvilket kan forklare, hvorfor SSRI'er og andre serotonin-påvirkende lægemidler normalt ikke får en patient til at hallucinere. Det faktum, at mange klassiske psykedelika faktisk har en betydelig affinitet til 5HT 1 -receptorer, sætter imidlertid denne påstand i tvivl. Hovedryksresponsen, en test, der bruges til at vurdere klassisk psykedelisk aktivitet hos gnavere, produceres kun af serotonin i nærvær af beta-Arrestins, men udløses af klassiske psykedelika uafhængigt af rekruttering af beta-Arrestin. Dette kan bedre forklare forskellen mellem farmakologien for serotonerg neurotransmission (selvom den fremmes af lægemidler som SSRI'er) og den for klassiske psykedelika. Nyere fund indikerer imidlertid, at binding til 5HT 2A - mGlu2 heterodimeren også er nødvendig for klassisk psykedelisk aktivitet. Dette kan også være relevant for de farmakologiske forskelle mellem de to. Selvom det tidligt i historien om psykedelisk lægemiddelforskning blev antaget, at disse hallucinationer var sammenlignelige med dem, der blev frembragt af psykose, og dermed at klassiske psykedelika kunne tjene som en model for psykose, er det vigtigt at bemærke, at moderne neuropsykofarmakologisk viden om psykose er udviklet betydeligt siden da, og vi ved nu, at psykose viser ringe lighed med virkningerne af klassiske psykedelika i mekanisme, rapporteret erfaring eller de fleste andre henseender bortset fra overfladeligheden af "hallucination".
Døgnrytme , eller søvn/vågne -cykling, er centreret i den suprachiasmatiske kerne (SCN) inden for hypothalamus og er præget af melatoninniveauer 2000–4.000% højere under søvn end om dagen. Et kredsløb vides at starte med melanopsin -celler i øjet, som stimulerer SCN gennem glutamatneuroner i hypothalamus -kanalen . GABAergiske neuroner fra SCN hæmmer den paraventrikulære kerne , som signalerer den overlegne cervikale ganglion (SCG) gennem sympatiske fibre. Udgangen af SCG stimulerer NE-receptorer ( β ) i pinealkirtlen, der producerer N-acetyltransferase, hvilket forårsager produktion af melatonin fra serotonin. Inhiberende melatoninreceptorer i SCN derefter give en positiv feedback pathway . Derfor hæmmer lys produktionen af melatonin, der " medfører " 24-timers cyklus af SCN-aktivitet. SCN modtager også signaler fra andre dele af hjernen, og dens (cirka) 24-timers cyklus afhænger ikke kun af lysmønstre. Faktisk vil snittet væv fra SCN udvise daglig cyklus in vitro i mange dage. Derudover (ikke vist i diagrammet) giver basalkernen GABA-ergisk hæmmende input til den præoptiske forreste hypothalamus (PAH). Når adenosin opbygges fra metabolismen af ATP i løbet af dagen, binder det sig til adenosinreceptorer og hæmmer den basale kerne. PAH aktiveres derefter, hvilket genererer langsom bølgesøvnaktivitet. Koffein er kendt for at blokere adenosinreceptorer og derved hæmme søvn blandt andet.
Forskning
Forskning inden for neuropsykofarmakologi omfatter en lang række mål. Disse kan omfatte undersøgelse af en ny kemisk forbindelse for potentielt gavnlige kognitive eller adfærdsmæssige virkninger eller undersøgelse af en gammel kemisk forbindelse for bedre at forstå dens virkningsmekanisme på celle- og neurale kredsløbsniveauer. For eksempel har det vanedannende stimulerende stof kokain længe været kendt for at virke på belønningssystemet i hjernen, øge dopamin- og noradrenalin -niveauet og fremkalde eufori i kort tid. Nyere publicerede undersøgelser er imidlertid gået dybere end kredsløbsniveauet og fandt ud af, at et bestemt G-proteinkoblet receptorkompleks kaldet A2AR-D2R-Sigma1R dannes i NAc efter kokainbrug; dette kompleks reducerer D2R -signalering i den mesolimbiske vej og kan være en medvirkende faktor til kokainafhængighed. Andre banebrydende undersøgelser har fokuseret på genetik til at identificere specifikke biomarkører, der kan forudsige en persons specifikke reaktioner eller grad af reaktion på et lægemiddel eller deres tendens til at udvikle afhængighed i fremtiden. Disse fund er vigtige, fordi de giver detaljeret indsigt i de neurale kredsløb, der er involveret i stofbrug og hjælper med at forfine gamle såvel som udvikle nye behandlingsmetoder til lidelser eller afhængighed. Forskellige behandlingsrelaterede undersøgelser undersøger peptidnukleinsyrers potentielle rolle i behandlingen af Parkinsons sygdom og skizofreni, mens andre forsøger at etablere tidligere ukendte neurale korrelater, der ligger til grund for visse fænomener.
Forskning i neuropsykofarmakologi kommer fra en lang række aktiviteter inden for neurovidenskab og klinisk forskning. Dette har motiveret organisationer som American College of Neuropsychopharmacology (ACNP) , European College of Neuropsychopharmacology (ECNP) og Collegium Internationale Neuro-psychopharmacologicum (CINP) til at blive etableret som et mål for fokus. Den ECNP udgiver europæiske Neuropsychopharmacology , og som en del af Reed Elsevier Group offentliggør ACNP tidsskriftet Neuropsychopharmacology , og CINP udgiver tidsskriftet International Journal of Neuropsychopharmacology med Cambridge University Press . I 2002 blev der for nylig udarbejdet et omfattende samlet arbejde fra ACNP, "Neuropsykofarmakologi: Den femte generation af fremskridt". Det er et mål for videnstilstanden i 2002 og kan siges at repræsentere et milepæl i det århundredelange mål om at etablere de grundlæggende neurobiologiske principper, der styrer hjernens handlinger.
Der findes mange andre tidsskrifter, der indeholder relevant information, såsom neurovidenskab . Nogle af dem er opført på Brown University Library .
Se også
Noter
Referencer
- ("4. generation" og "5. generation" henviser til ACNP, se links)
- ^ "Historien om hCNP: Udveksling af oplysninger og katalysator fremskridt",ECNP Nyhedsbrev, N7 (2004)
- ^ Fujita, M. og Innis, RB, "In vivoMolecular Imaging: Ligand Development And Research Applications", (5. generation. Prog.)
- ^ Tallman, JF,"Neuropsychopharmacology at the New Millennium: New Industry Directions",Neuropsychopharmacology20 (1999)
- ^ Bloom, FE, "Introduktion til præklinisk neuropsykofarmakologi", (4. generation. Prog.)
- ^ Watson, SJ og Cullinan, WE, "Cytology and Circuitry", (4. generation. Prog.)
- ^ Reference til læger, 1990, 2005
- ^ Erowid,"Neurofarmakologifor γ-hydroxybutyrat (GHB)"(2004)
- ^ Tallman, JF, Cassella, J., Kehne, J., "Mechanism of Action of Anxiolytics", (5. generation. Prog.)
- ^ Depoortère, R.,et al. , "Neurokemiske, elektrofysiologiske og farmakologiske profiler af den selektive hæmmer af glycin-transportør-1 SSR504734, en potentiel ny type antipsykotisk",Neuropsykofarmakologi30, pp1963–1985, (2005)
- ^ Abraham, HD, Mccann, UD, Ricaurte, GA, "Psychedelic Drugs", (5. generation. Prog.)
- ^ Colwell, CS, "Circadian Rhythms", (4. generation. Prog.)
- ^ Lewy, AJ, "Circadian Phase Sleep And Mood Disorders", (5. generation. Prog.)
eksterne links
- ACNP -ressourcer
- Organisationer
- Collegium Internationale Neuro-psychopharmacologicum En global organisation dedikeret til neuropsykofarmakologi
- European College of Neuropsychopharmacology
- Tidsskrifter
- Neuropsychopharmacology Journal - Officiel publikation af American College of Neuropsychopharmacology
- European Neuropsychopharmacology - An Elsevier journal
- The International Journal of Neuropsychopharmacology - En publikation fra Cambridge University Press
- Neuropsykofarmakologi og terapeutika af Ivor Ebenezer (2015), John Wiley & Sons, Chichester, Storbritannien, ISBN 978-1-118-38565-4

