BRCA mutation - BRCA mutation
| BRCA mutation | |
|---|---|
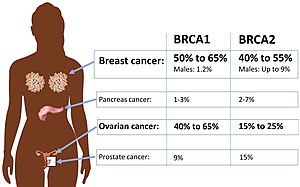 | |
| Absolut risiko for kræft i BRCA1- eller BRCA2 -mutation. | |
| Specialitet | Medicinsk genetik |
En BRCA -mutation er en mutation i et af BRCA1- og BRCA2 -generne , som er tumorsuppressorgener. Hundredvis af forskellige typer mutationer i disse gener er blevet identificeret, hvoraf nogle er blevet bestemt til at være skadelige, mens andre ikke har påvist effekt. Skadelige mutationer i disse gener kan producere et arveligt bryst -æggestokkræftsyndrom hos berørte personer. Kun 5-10% af brystkræft tilfælde hos kvinder tilskrives BRCA1 og BRCA2 mutationer (hvor BRCA1 mutationer er lidt mere almindelige end BRCA2 mutationer), men virkningen på kvinder med genmutationen er mere dyb. Kvinder med skadelige mutationer i enten BRCA1 eller BRCA2 har en risiko for brystkræft, der er omkring fem gange den normale risiko, og en risiko for æggestokkræft, der er omkring ti til tredive gange normal. Risikoen for bryst- og æggestokkræft er højere for kvinder med en højrisiko BRCA1- mutation end med en BRCA2- mutation. At have en højrisikomutation garanterer ikke, at kvinden vil udvikle nogen form for kræft eller indebære, at enhver kræft, der optræder, faktisk var forårsaget af mutationen, snarere end en anden faktor.
Højrisikomutationer, som deaktiverer en vigtig fejlfri DNA-reparationsproces ( homologirettet reparation ), øger personens risiko for at udvikle brystkræft , æggestokkræft og visse andre kræftformer betydeligt . Hvorfor BRCA1- og BRCA2- mutationer fortrinsvis fører til kræft i bryst og æggestok vides ikke, men mangel på BRCA1- funktion ser ud til at føre til ikke-funktionel X-kromosominaktivering . Ikke alle mutationer er højrisiko; nogle synes at være harmløse variationer. Kræftrisikoen forbundet med en given mutation varierer betydeligt og afhænger af mutationens nøjagtige type og placering og muligvis andre individuelle faktorer.
Mutationer kan arves fra en af forældrene og kan videregives til både sønner og døtre. Hvert barn af en genetisk bærer , uanset køn, har 50% chance for at arve det muterede gen fra den forælder, der bærer mutationen. Som følge heraf er halvdelen af mennesker med BRCA -genmutationer mandlige, som derefter ville videregive mutationen til 50% af deres afkom, mand eller kvinde. Risikoen for BRCA -relaterede brystkræftformer for mænd med mutationen er højere end for andre mænd, men stadig lav. Men BRCA kan mutationer øge risikoen for andre kræftformer, såsom coloncancer , pancreascancer og prostatacancer .
Metoder til at diagnosticere sandsynligheden for, at en patient med mutationer i BRCA1 og BRCA2 får kræft, var omfattet af patenter, der ejes eller kontrolleres af Myriad Genetics . Myriads forretningsmodel med udelukkende at tilbyde den diagnostiske test førte til, at Myriad voksede fra at være en opstart i 1994 til at være et børsnoteret selskab med 1200 ansatte og omkring $ 500 mio. I årlig omsætning i 2012; det førte også til kontroverser om høje priser og manglende evne til at få second opinions fra andre diagnostiske laboratorier, hvilket igen førte til den skelsættende Association for Molecular Pathology v. Myriad Genetics retssag.
Sundhedseffekter
Kvinder med skadelige mutationer i enten BRCA1- eller BRCA2 -generne har en høj risiko for at udvikle bryst- og/eller æggestokkræft . Fordi forskellige undersøgelser ser på forskellige populationer, og fordi forskellige typer mutationer har noget forskellige risici, udtrykkes risikoen bedst som et område frem for et enkelt tal.
Ca. 50% til 65% af kvinder født med en skadelig mutation i BRCA1 vil udvikle brystkræft ved 70 år, og 35% til 46% vil udvikle kræft i æggestokkene i 70 -årsalderen. Ca. 40% til 57% af kvinder med en skadelig mutation i BRCA2 udvikler brystkræft inden 70 år, og 13% til 23% udvikler kræft i æggestokkene inden 70 år.
Kvinder med brystkræft forbundet med en BRCA -mutation har op til 40% sandsynlighed for at udvikle en ny primær brystkræft inden for 10 år efter den første diagnose, hvis de ikke modtog tamoxifen -behandling eller havde en oophorektomi . Kvindens tiårige risiko for kræft i æggestokkene øges også med 6-12% under disse forhold.
Statistik for BRCA -relateret æggestokkræft omfatter typisk ikke kun kræft i æggestokkene selv, men også kræft i bughinden og den meget sjældne, men noget lettere at opdage, kræft i æggelederne . Kvinder med en BRCA -mutation har mere end 100 gange den normale frekvens af æggelederkræft. Disse tre typer af disse kræftformer kan være svære at skelne i deres avancerede stadier.
Kræftstart
BRCA -relateret brystkræft forekommer i en tidligere alder end sporadisk brystkræft. Det er blevet hævdet, at BRCA -relateret brystkræft er mere aggressiv end normal brystkræft, men de fleste undersøgelser i specifikke populationer tyder på ringe eller ingen forskel i overlevelsesrater på trods af tilsyneladende dårligere prognostiske faktorer.
- BRCA1 er forbundet med triple-negativ brystkræft , som ikke reagerer på hormonelle behandlinger og ikke kan behandles med nogle lægemidler, f.eks. Trastuzumab . Brystkræft forekommer ofte omkring to årtier tidligere end normalt.
- BRCA2 er primært forbundet med postmenopausal brystkræft, selvom risikoen for præmenopausal brystkræft er betydelig. Det reagerer typisk meget på hormonelle behandlinger.
BRCA -relateret kræft i æggestokkene og æggelederne er mere behandlingsbar end gennemsnittet, fordi den er usædvanligt modtagelig for platinbaseret kemoterapi som cisplatin . BRCA1 -relateret æggestokkræft forekommer i yngre aldre, men risikoen for kvinder med BRCA2 stiger markant ved eller kort efter overgangsalderen.
Overlevelseseffekt
72/100 | |
46/100 | |
|
11/100
72% af kvinderne med en BRCA1 -mutation og 46% af kvinderne med en BRCA2 -mutation (og ingen screening eller medicinske indgreb), der dør før 70 år, dør af bryst- eller æggestokkræft. 11% af kvinderne i USA, der dør før 70 år, dør af bryst- eller æggestokkræft.
|
| Gruppe | Andel, der overlever til 70 år |
|---|---|
| BRCA1 mutation |
59
|
| BRCA2 mutation |
71
|
| Typisk kvinde |
84
|
En 25-årig kvinde uden mutation i sine BRCA- gener har en 84% sandsynlighed for at nå mindst 70 år. Af dem, der ikke overlever, dør 11% af enten bryst- eller æggestokkræft og 89% af andre årsager.
I forhold til det ville en kvinde med en højrisiko BRCA1- mutation, hvis hun havde screening for brystkræft, men ingen profylaktisk medicinsk eller kirurgisk indgreb, kun have 59% chance for at nå 70 år, femogtyve procentpoint lavere end normalt. Af de kvinder, der ikke overlevede, ville 26% dø af brystkræft, 46% kræft i æggestokkene og 28% andre årsager.
Kvinder med højrisiko BRCA2- mutationer, med screening, men uden profylaktisk medicinsk eller kirurgisk indgreb, ville kun have 71% chance for at nå 70 år, tretten procentpoint lavere end normalt. Af dem, der ikke overlevede, ville 21% dø af brystkræft, 25% kræft i æggestokkene og 54% andre årsager.
Sandsynligheden for at overleve til mindst 70 år kan forbedres ved flere medicinske indgreb, især profylaktisk mastektomi og oophorektomi.
Mandlig brystkræft
Mænd med en BRCA -mutation har en dramatisk forhøjet relativ risiko for at udvikle brystkræft, men fordi den samlede forekomst af brystkræft hos mænd er så lav, er den absolutte risiko lig med eller lavere end risikoen for kvinder uden en BRCA -mutation. Ca. 1% til 2% af mændene med en BRCA1 -mutation vil udvikle brystkræft inden 70 år. Ca. 6% af mændene med en BRCA2 -mutation vil udvikle brystkræft i 70 -årsalderen, hvilket er omtrent lig med risikoen for kvinder uden en BRCA -mutation . Meget få mænd, med eller uden en predisponerende mutation, udvikler brystkræft før 50 år.
Cirka halvdelen af mænd, der udvikler brystkræft, har en mutation i et BRCA -gen eller i et af de andre gener, der er forbundet med arvelige brystkræftsygdomme .
Brystkræft hos mænd kan behandles lige så vellykket som brystkræft hos kvinder, men mænd ignorerer ofte tegn og symptomer på kræft, såsom et smertefuldt område eller en usædvanlig hævelse, som måske ikke er større end et ris , indtil det har nået et sent stadie.
I modsætning til andre mænd kan mænd med en BRCA -mutation, især en BRCA2 -mutation, have fordel af professionelle og selvstændige brystundersøgelser . Medicinsk billeddannelse anbefales normalt ikke, men fordi mandlige BRCA2- bærere har en risiko for brystkræft, der minder meget om den almindelige kvindelige befolkning, kan det årlige standard mammogramprogram tilpasses disse højrisiko mænd.
Andre kræftformer
Mutationer har været forbundet med øget risiko for at udvikle enhver form for invasiv kræft, herunder mavekræft , bugspytkirtelkræft , prostatakræft og tyktarmskræft . Bærere har de normale risici for at udvikle kræft (og andre sygdomme) forbundet med øget alder, rygning, alkoholforbrug, dårlig kost, mangel på motion og andre kendte risikofaktorer plus den ekstra risiko fra de genetiske mutationer og en øget modtagelighed for skader fra ioniserende stråling, herunder naturlig baggrundsstråling .
Mænd med BRCA- mutationer kan ikke få kræft i æggestokkene, men de kan have dobbelt så stor sandsynlighed som ikke-bærere for at udvikle prostatakræft i en yngre alder. Risikoen er mindre og omtvistet for BRCA1 -luftfartsselskaber; op til en tredjedel af BRCA2- mutationsbærere forventes at udvikle prostatakræft før 65 år. Prostatakræft hos BRCA- mutationsbærere har en tendens til at forekomme et årti tidligere end normalt, og det har en tendens til at være mere aggressiv end normalt. Som følge heraf er årlig prostata -screening, herunder en digital rektalundersøgelse , passende i en alder af 40 blandt kendte bærere frem for 50 -årsalderen.
Kræft i bugspytkirtlen har en tendens til at løbe i familier, selv blandt BRCA -familier. En BRCA1 -mutation fordobler eller tredobler cirka livstidsrisikoen for at udvikle kræft i bugspytkirtlen; en BRCA2 -mutation tredobles for at femdoble den. Mellem 4 og 7% af mennesker med kræft i bugspytkirtlen har en BRCA -mutation. Men da kræft i bugspytkirtlen er relativt sjælden, står mennesker med en BRCA2 -mutation sandsynligvis over for en absolut risiko på omkring 5%. Ligesom kræft i æggestokkene har det en tendens til ikke at producere symptomer i de tidlige, behandlingsmæssige stadier. Ligesom prostatakræft har bugspytkirtelkræft i forbindelse med en BRCA- mutation tendens til at forekomme omkring et årti tidligere end ikke-arvelige tilfælde. Asymptomatisk screening er invasiv og kan kun anbefales til BRCA2 -bærere, der også har en familiehistorie af kræft i bugspytkirtlen.
Melanom er den mest dødelige hudkræft, selvom den let kan helbredes i de tidlige stadier. Den normale sandsynlighed for at udvikle melanom afhænger af race, antallet af mol, personen har, familiehistorie, alder, køn og hvor meget personen har været udsat for UV -stråling. BRCA2 -mutationsbærere har cirka en dobbelt eller tredoblet risiko, som de normalt ville have, herunder en højere risiko end gennemsnittet for øjens melanom .
Kræft i tyktarmen er omtrent lige så almindelig hos både mænd og kvinder i den udviklede verden som brystkræft er blandt gennemsnit-risiko kvinder, med omkring 6% af mennesker, der bliver diagnosticeret med det, som regel over en alder af 50. Ligesom sporadisk prostatakræft, det er en multifaktoriel sygdom og påvirkes af alder, kost og lignende faktorer. BRCA -mutationsbærere har en højere risiko end gennemsnittet for denne almindelige kræftsygdom, men risikoen er ikke så høj som ved andre arvelige kræftformer . Risikoen kan være så høj som fire gange normal i nogle BRCA1 -familier og fordoble den normale risiko blandt BRCA2 -bærere. Ligesom kræft i bugspytkirtlen kan det være, at kun nogle BRCA -mutationer eller nogle BRCA -familier har den ekstra risiko; i modsætning til andre BRCA -forårsagede kræftformer, forekommer det ikke i en tidligere alder end normalt. Normal screening af tyktarmskræft anbefales normalt til BRCA -mutationsbærere.
Mutationer i BRCA1 og BRCA2 er stærkt impliceret i nogle hæmatologiske maligniteter . BRCA1 -mutationer er forbundet med akut myelogen leukæmi og kronisk myelogen leukæmi . Mutationer af BRCA2 findes også i mange T-cellelymfomer og kroniske lymfocytiske leukæmier .
Barsel
Dilemmaet om, hvorvidt de skal have børn, kan være en kilde til stress for kvinder, der lærer om deres BRCA -mutationer i deres fertile år.
Der er sandsynligvis ringe eller ingen effekt af en BRCA -genmutation på den samlede fertilitet , selvom kvinder med en BRCA -mutation kan have større sandsynlighed for at have primær ovarieinsufficiens . BRCA -mutationsbærere kan være mere tilbøjelige til at føde piger end drenge, men denne observation er blevet tilskrevet konstateringsbias .
Hvis begge forældre er bærere af en BRCA- mutation, bruges præ-implantation genetisk diagnose undertiden til at forhindre fødslen af et barn med BRCA- mutationer. Arv af to BRCA1 -mutationer (en fra hver forælder) er aldrig blevet rapporteret og menes at være en dødelig fødselsdefekt. Arvelig en BRCA1 -mutation og en BRCA2 -mutation er blevet rapporteret lejlighedsvis; barnets risiko for enhver given kræftform er den højere risiko for de to gener (f.eks. risikoen for kræft i æggestokkene fra BRCA1 og kræft i bugspytkirtlen fra BRCA2 ). At arve to BRCA2 -mutationer producerer Fanconi -anæmi .
Hver graviditet hos genetisk typiske kvinder er forbundet med en signifikant reduktion i moderens risiko for at udvikle brystkræft efter 40 år. Jo yngre kvinden er på tidspunktet for hendes første fødsel, jo mere beskyttelse mod brystkræft får hun. Amning i mere end et år beskytter mod brystkræft. Graviditet beskytter også mod kræft i æggestokkene hos genetisk typiske kvinder.
Selvom nogle undersøgelser har givet forskellige resultater, forventes kvinder med BRCA -mutationer generelt ikke at modtage disse betydelige beskyttelsesfordele. Aktuel forskning er for begrænset og upræcis til at muliggøre beregning af specifikke risici. Følgende generelle tendenser er imidlertid blevet identificeret:
- For kvinder med en BRCA1 -mutation har kvindens alder, da hun først fødte, ingen sammenhæng med hendes risiko for brystkræft. Barsel giver ingen beskyttelse mod brystkræft, medmindre kvinden har fem eller flere fuldtidsgraviditeter, på hvilket tidspunkt hun kun modtager beskeden beskyttelse. I lighed med genetisk typiske kvinder beskytter graviditet mod kræft i æggestokkene hos BRCA1 -kvinder. Amning i mere end et år beskytter betydeligt mod brystkræft. Denne effekt kan være så høj som 19% om året amning, hvilket er meget højere end det, der ses blandt genetisk typiske kvinder. Effekten, hvis nogen, af langvarig amning på kræft i æggestokkene er uklar.
- For kvinder med en BRCA2 -mutation er hver graviditet paradoksalt nok forbundet med en statistisk signifikant stigning i risikoen for brystkræft. I modsætning til genetisk typiske kvinder eller kvinder med BRCA1 -mutationer har amning ingen effekt på hverken kræft hos kvinder med BRCA2 -mutationer. Begrænsede og modstridende data tyder på, at graviditet, i modsætning til andre kvinder, ikke reducerer risikoen for kræft i æggestokkene væsentligt hos kvinder med en BRCA2 -mutation og kan øge den.
Genetik

Begge BRCA- gener er tumorsuppressorgener, der producerer proteiner, der bruges af cellen i en enzymatisk vej, der foretager meget præcise, perfekt matchede reparationer af DNA-molekyler, der har dobbeltstrengede pauser. Stien kræver proteiner produceret af flere andre gener, herunder CHK2 , FANCD2 og ATM . Skadelige mutationer i nogen af disse gener deaktiverer genet eller proteinet, som det producerer.
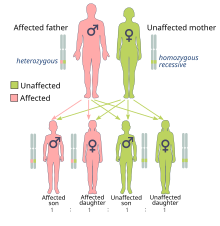
Kræftrisikoen forårsaget af BRCA1- og BRCA2 -mutationer arves på en dominerende måde, selvom normalt kun en muteret allel er direkte arvet. Dette skyldes, at mennesker med mutationen sandsynligvis vil erhverve en anden mutation, hvilket fører til dominerende udtryk for kræften. Et muteret BRCA -gen kan arves fra begge forældre. Fordi de er arvet fra forældrene, klassificeres de som arvelige eller kønsmutationer snarere end erhvervede eller somatiske mutationer . Kræft forårsaget af et muteret gen arvet fra en persons forældre er en arvelig kræft snarere end en sporadisk kræft .
Fordi mennesker har et diploid genom, har hver celle to kopier af genet (en fra hver biologisk forælder). Typisk indeholder kun en kopi en invaliderende, arvet mutation, så den berørte person er heterozygot for mutationen. Hvis den funktionelle kopi imidlertid er skadet, er cellen tvunget til at bruge alternative DNA-reparationsmekanismer, som er mere tilbøjelige til fejl. Tabet af den funktionelle kopi kaldes tab af heterozygositet (LOH). Eventuelle resulterende fejl i DNA -reparation kan resultere i celledød eller en kræftformet transformation af cellen.
Der er mange variationer i BRCA -gener, og ikke alle ændringer medfører de samme risici. Nogle varianter er ufarlige; andre vides at være meget skadelige. Nogle enkelte nukleotidpolymorfier kan kun udgøre en lille risiko eller kan kun medføre risiko i nærvær af andre mutationer eller under visse omstændigheder. I andre tilfælde er det uvist, om varianten er skadelig. Varianter klassificeres som følger:
- Skadelig mutation : Ændringen har vist sig at forårsage betydelige risici. Ofte er det rammeskiftmutationer, der forhindrer cellen i at producere mere end den første del af det nødvendige protein.
- Mistænkt skadelig : Selvom intet er bevist, menes variationen i øjeblikket at være skadelig.
- Variant af usikker betydning (VUS): Om ændringen har nogen effekt er usikkert. Dette er et almindeligt testresultat, og de fleste variationer begyndte i denne kategori. Efterhånden som der indsamles flere beviser, omklassificeres disse.
- Variant, favoriser polymorfisme : Selvom intet er bevist, menes variationen i øjeblikket at være harmløs.
- Godartet polymorfisme : Ændringen er klassificeret som harmløs. Disse kan rapporteres som "ingen mutation".
Skadelige mutationer har høj, men ikke fuldstændig, genetisk penetrans , hvilket betyder, at mennesker med mutationen har en høj risiko for at udvikle sygdom som følge heraf, men at nogle mennesker ikke vil udvikle kræft på trods af at de bærer en skadelig mutation.
Diagnose
Genetisk rådgivning anbefales til kvinder, hvis personlige eller familiens sundhedshistorie tyder på større sandsynlighed for en mutation end gennemsnittet. Formålet med genetisk rådgivning er at uddanne personen om sandsynligheden for et positivt resultat, risici og fordele ved at blive testet, testernes begrænsninger, den praktiske betydning af resultaterne og de risikoreducerende handlinger, der kan træffes, hvis resultaterne er positive. De er også uddannet til at støtte mennesker gennem følelsesmæssige reaktioner og til at være en neutral person, der hjælper klienten med at træffe sin egen beslutning i en informeret samtykkemodel , uden at skubbe klienten til at gøre, hvad rådgiveren kan gøre. Fordi kendskabet til en mutation kan forårsage betydelig angst, vælger nogle mennesker ikke at blive testet eller at udsætte testen til et senere tidspunkt.
Relative indikationer til test for en mutation i BRCA1 eller BRCA2 for nydiagnosticerede eller familiemedlemmer inkluderer en familiehistorie blandt 1. (FDR), 2. (SDR) eller 3. (TDR) grad slægtninge normalt på samme side af familien, men ikke begrænset :
- En kendt mutation (BRCA1 eller BRCA2) i et kræftfølsomhedsgen inden for familien
- Kvinder ramt af brystkræft diagnosticeret under 30 år
- Kvinder ramt med tredobbelt negativ brystkræft (TNBC) ( østrogenreceptornegativ , progesteronreceptornegativ og HER2/neu negativ) under 50 år
- To pårørende (FDR/SDR) diagnosticeret under 45 år
- Tre pårørende (FDR/SDR) diagnosticeret med en gennemsnitsalder på 50 år eller derunder
- Fire pårørende i alle aldre
- Ovariecancer med enten en yderligere diagnosticeret slægtning eller en slægtning med mandlig brystkræft
- Et enkelt familiemedlem med både bryst- og æggestokkræft
- Mandlig brystkræft
- Kræft i bugspytkirtlen med bryst- eller æggestokkræft hos samme individ eller på samme side af familien
- Ashkenazi jødisk eller polsk herkomst med et FDR -familiemedlem, der er ramt af bryst- eller æggestokkræft i alle aldre
Test af små børn betragtes som medicinsk uetisk, fordi testresultaterne ikke ville ændre måden, hvorpå barnet bliver behandlet.
Test procedure
Der findes to typer test. Begge bruger normalt en blodprøve , selvom test kan udføres på spyt. Den hurtigste, enkleste og laveste omkostningstest bruger positive testresultater fra en blods slægtning og kontrollerer kun den enkelt mutation, der vides at være til stede i familien. Hvis ingen slægtninge tidligere har oplyst positive testresultater, kan der udføres en fuld test, der kontrollerer hele sekvensen af både BRCA1 og BRCA2 . I nogle tilfælde på grund af grundlæggereffekten kan jødisk etnicitet bruges til at indsnævre testen for hurtigt at kontrollere de tre mest almindelige mutationer, der ses blandt Ashkenazi -jøder .
Test er normalt dækket af sundhedsforsikringer og offentlige sundhedsprogrammer for mennesker med høj risiko for at få en mutation, og ikke dækket af mennesker med lav risiko. Formålet med at begrænse testen til personer med høj risiko er at øge sandsynligheden for, at personen får et meningsfuldt, praktisk resultat fra testen, frem for at identificere en variant af ukendt betydning (VUS). I Canada henvises folk, der demonstrerer deres højrisikostatus ved at opfylde bestemte retningslinjer, i første omgang til et specialiseret program for arvelig kræft, og hvis de vælger at blive testet, dækkes omkostningerne ved testen fuldt ud. I USA i 2010 havde test på et enkelt sted en detailpris på 400 til 500 dollar, og analyse i fuld længde kostede omkring $ 3.000 pr. Gen, og omkostningerne blev almindeligvis dækket af private sundhedsforsikringer for mennesker, der anses for at have høj risiko.
Testen bestilles af en læge, normalt en onkolog , og resultaterne returneres altid til lægen i stedet for direkte til patienten. Hvor hurtigt resultaterne returneres, afhænger af testen-analyse på et enkelt sted kræver mindre laboratorietid-og af infrastrukturen på plads. I USA returneres testresultater normalt inden for en til flere uger; i Canada venter patienter normalt i otte til ti måneder på testresultater.
Testfortolkning
Et positivt testresultat for en kendt skadelig mutation er bevis på en disposition, selvom det ikke garanterer, at personen udvikler nogen form for kræft. Et negativt testresultat, hvis en specifik mutation vides at være til stede i familien, viser, at personen ikke har en BRCA -relateret disposition for kræft, selvom det ikke garanterer, at personen ikke udvikler et ikke -arveligt tilfælde af Kræft. I sig selv betyder et negativt testresultat ikke, at patienten ikke har nogen arvelig disposition for bryst- eller æggestokkræft. Familien kan have en anden genetisk disposition for kræft, der involverer et andet gen.
Kræftforebyggelse
En række screeningsmuligheder og -interventioner er tilgængelige for at håndtere BRCA -relaterede kræftrisici. Screeninger tilpasses individuelle og familiære risikofaktorer.
Da disse screeningsmetoder ikke forhindrer kræft, men blot forsøger at fange det tidligt, praktiseres der undertiden adskillige metoder til forebyggelse med forskellige resultater.
Screening
En intensiv kræftscreeningsplan anbefales normalt til kvinder med skadelige eller mistænkte skadelige BRCA -mutationer for at opdage nye kræftformer så tidligt som muligt. En typisk anbefaling omfatter hyppig screening af brystkræft samt test til påvisning af kræft i æggestokkene.
Brystundersøgelser omfatter normalt en bryst -MR (magnetisk resonansbilleddannelse) en gang om året, der begynder mellem 20 og 30 år, afhængigt af den alder, hvor nogen pårørende blev diagnosticeret med brystkræft. Mammogrammer bruges typisk kun i en høj alder, da der er grund til at tro, at BRCA- bærere er mere modtagelige for brystkræftinduktion ved røntgenskader end den generelle befolkning.
Alternativer indbefatter bryst ultralydsundersøgelse , CT-scanninger , PET scanninger , skintimammografi , elastografi , termografi , duktal udskylning , og eksperimentelle screeningsprotokoller, hvoraf nogle håber at identificere biomarkører for brystkræft (molekyler, der vises i blodet, når brystkræft begynder).
Ovariecancer screening involverer normalt ultralyd af bækkenområdet, typisk to gange om året. Kvinder kan også bruge en blodprøve til CA-125 og kliniske bækkenundersøgelser . Blodprøven har relativt dårlig følsomhed og specificitet for kræft i æggestokkene.
Ved både bryst- og ovariescreening undersøges områder af væv, der ser mistænkelige ud, enten med mere billeddannelse, muligvis ved hjælp af en anden billeddannelse eller efter en forsinkelse eller med biopsier af de mistænkelige områder.
Medicin
P -piller er forbundet med en væsentlig lavere risiko for kræft i æggestokkene hos kvinder med BRCA -mutationer. En metaanalyse fra 2013 viste, at oral p-pillebrug var forbundet med en 42% reduktion af den relative risiko for kræft i æggestokkene, foreningen var ens for BRCA1- og BRCA2-mutationer. Brug af orale præventionsmidler var ikke signifikant forbundet med brystkræftrisiko, selvom der blev observeret en lille stigning i risiko, der ikke nåede statistisk signifikans . En metaanalyse fra 2011 viste, at OC-brug var forbundet med en 43% relativ reduktion i risiko for kræft i æggestokkene hos kvinder med BRCA- mutationer, mens data om risikoen for brystkræft hos BRCA- mutationsbærere med oral prævention var heterogene, og resultaterne var inkonsekvente .
Selektive østrogenreceptormodulatorer , specifikt tamoxifen , har vist sig at reducere risikoen for brystkræft hos kvinder med BRCA -mutationer, der ikke fjerner deres bryst. Det er effektivt som primær forebyggelse (forebyggelse af det første tilfælde af brystkræft) hos kvinder med BRCA2 -mutationer, men ikke BRCA1 -mutationer og til sekundær forebyggelse (forebyggelse af et andet, uafhængigt brystkræft) i begge grupper af kvinder. At tage tamoxifen i fem år har vist sig at halvere brystkræftrisikoen hos kvinder, der har en høj risiko for brystkræft af en eller anden grund, men potentielt alvorlige bivirkninger som grå stær , blodpropper og livmoderkræft sammen med problemer med livskvalitet som f.eks. hedeture, resulterer i, at nogle kvinder afbryder brugen, og nogle læger begrænser brugen til kvinder med atypiske vækster i brysterne. Tamoxifen er kontraindiceret til kvinder, der mest sandsynligt vil blive skadet af de almindelige komplikationer. Raloxifene (Evista), der har en reduceret risiko for bivirkninger, bruges som et alternativ, men det er ikke blevet undersøgt i BRCA -mutationsbærere specifikt. Tamoxifen -brug kan kombineres med oophorektomi for endnu større reduktion af brystkræftrisiko, især hos kvinder med BRCA2 -mutationer.
Aromatasehæmmere er medicin, der forhindrer østrogenproduktion i binyrerne og fedtvæv . De har færre bivirkninger end selektive østrogenreceptormodulatorer som tamoxifen, men virker ikke hos kvinder før overgangsalderen, fordi de ikke forhindrer æggestokkene i at producere østrogen.
Kirurgi
Flere former for forebyggende operationer vides at reducere risikoen for kræft væsentligt for kvinder med højrisiko BRCA- mutationer. Operationerne kan bruges alene, i kombination med hinanden eller i kombination med ikke-kirurgiske indgreb for at reducere risikoen for bryst- og æggestokkræft. Bemærk, at operationer som mastektomi og oophorektomi ikke helt eliminerer chancen for brystkræft; sager er angiveligt dukket op trods disse procedurer.
- Tubal ligering er den mindst invasive af disse operationer og ser ud til at reducere kræft i æggestokkene for BRCA1 -bærere med over 60%. Salpingektomi er en anden mulighed, der er mere invasiv end tubal ligering og kan resultere i yderligere risikoreduktion. Begge disse kan udføres når som helst efter fødslen er fuldført. I modsætning til andre profylaktiske operationer reducerer disse to operationer ikke risikoen for brystkræft.
- Profylaktisk (forebyggende) mastektomi er forbundet med små risici og et stort fald i risikoen for brystkræft.
- Profylaktisk salpingo-oophorektomi (fjernelse af æggestokkene og æggelederne) resulterer i en meget stor reduktion i kræft i æggestokkene og en stor reduktion i brystkræftrisiko, hvis den udføres før naturlig overgangsalder. Det medfører imidlertid også risiko for betydelige bivirkninger, hvis de udføres i en ung alder.
- Hysterektomi har ingen direkte effekt på BRCA -relaterede kræftformer, men det gør det muligt for kvinderne at bruge nogle lægemidler, der reducerer brystkræftrisiko (f.eks. Tamoxifen ) med risiko for livmoderkræft og til at bruge færre hormoner til at håndtere de negative virkninger af en profylaktisk oophorektomi .
Hvorvidt og hvornår de præventive operationer skal udføres er en kompleks personlig beslutning. Nuværende medicinsk viden giver lidt vejledning om risici og fordele. Selv bærere af samme mutation eller fra samme familie kan have væsentligt forskellige risici for den type og sværhedsgrad af kræft, de sandsynligvis vil få, samt i hvilken alder de kan få dem. Forskellige mennesker har også forskellige værdier. De kan vælge at fokusere på total kræftforebyggelse, psykologiske fordele, nuværende livskvalitet eller generel overlevelse. Den mulige indvirkning af fremtidig medicinsk udvikling inden for behandling eller prognose kan også have en vis betydning for helt unge kvinder og familieplanlægning. Beslutningen er individualiseret og er normalt baseret på mange faktorer, såsom tidligste forekomst af BRCA -relateret kræft hos nære slægtninge.
Den beskyttende effekt af profylaktisk kirurgi er større, når den udføres i ung alder; oophorektomi har imidlertid også negative virkninger, der er størst, når de udføres længe før naturlig overgangsalder. Af denne grund anbefales oophorektomi for det meste efter 35 eller 40 år, forudsat at fødslen er fuldført. Risikoen for kræft i æggestokkene er lav før denne alder, og de negative virkninger af oophorektomi er mindre alvorlige, da kvinden nærmer sig naturlig overgangsalder.
- For bærere af højrisiko BRCA1- mutationer reducerer profylaktisk oophorektomi omkring 40 år risikoen for ovarie- og brystkræft og giver en betydelig langsigtet overlevelsesfordel. At have denne operation i en meget ung alder giver ringe eller ingen yderligere overlevelsesfordel, men det øger de negative virkninger af operationen. Sammenlignet med ingen intervention øger denne operation omkring 40 år kvindens chance for at nå 70 år med femten procentpoint fra 59% til 74%. Tilføjelse af profylaktisk mastektomi øger den forventede overlevelse med flere procentpoint.
- For bærere af højrisiko BRCA2- mutationer har oophorektomi omkring 40 år en mindre effekt. Operationen øger kvindens chance for at nå 70 år med kun fem procentpoint, fra 75% til 80%. Når der i stedet kun udføres forebyggende mastektomi i en alder af 40 år, er forbedringen den samme, hvor den forventede chance stiger fra 75% til 79%. At foretage begge operationer sammen omkring 40 år forventes at forbedre kvindens chance for at nå 70 år fra 75% til 82%
Til sammenligning har kvinder i den generelle befolkning en 84% chance for at leve til 70 år.
Forskning har undersøgt virkningerne af risikoreducerende kirurgi på psykologisk og socialt velbefindende for kvinder med en BRCA-mutation. På grund af begrænset evidens var en metaanalyse fra 2019 ikke i stand til at drage konklusioner om, hvorvidt interventioner kan hjælpe med de psykologiske virkninger af kirurgi hos kvindelige BRCA -bærere. Mere forskning er nødvendig for at konkludere, hvordan man bedst støtter kvinder, der vælger kirurgi.
Mastektomi
Hos en kvinde, der ikke har udviklet brystkræft, kan fjernelse af brysterne reducere hendes risiko for nogensinde at blive diagnosticeret med brystkræft med 90%til et niveau, der er cirka halvdelen af den gennemsnitlige kvindes risiko.
Bilateral mastektomi er fjernelse af begge bryster af en brystkirurg . Den modificerede radikale mastektomi bruges kun til kvinder med diagnosen invasiv brystkræft. Teknikker til profylaktisk mastektomi omfatter:
- Enkel mastektomi , som anbefales til kvinder, der ikke har brystrekonstruktion, efterlader den mindste mængde brystvæv i kroppen og opnår derfor den største risikoreduktion. Ud over profylaktisk brug bruges den også af kvinder, der har fået konstateret tidligere stadier af kræft.
- Hudbesparende mastektomi fjerner vævet i bryst, brystvorte og areola, men lader den "overskydende" hud være på plads til genopbygning. Det har mindre synligt arvæv end en simpel mastektomi.
- Brystvortebesparende mastektomi fjerner brystvævet, men efterlader brystvorten og areola intakt for et mere naturligt udseende.
- Subkutan mastektomi fjerner brystvævet, men efterlader brystvorten og areola intakte. Arene er skjult i den inframammary fold under brystet.
- Areola-besparende mastektomi fjerner brystvævet og brystvorten, men ikke areolaen.
- Nervesparende mastektomi er et forsøg på at opretholde de nerver, der giver huden fornemmelse over brysterne. Bryster, der har gennemgået nogen af disse operationer, har meget mindre taktil fornemmelse end naturlige bryster. Nervesparende teknikker er et forsøg på at bevare en vis følelse i brysterne, med begrænset og ofte kun delvis succes.
Hvilken teknik der bruges, bestemmes af eksistensen af kræft og generel sundhed samt af kvindens ønske om nogen til brystrekonstruktion til æstetiske formål. Kvinder, der vælger et fladbrystet udseende eller bruger eksterne brystproteser, vælger typisk simpel mastektomi med dens større risikoreduktion.
Brystrekonstruktion udføres normalt af en plastikkirurg og kan startes som en del af den samme multi-timers operation, der fjerner brysterne. Flere teknikker til genopbygning er blevet brugt med forskellige steder og mængder af ardannelse. Nogle teknikker bruger væv fra en anden del af kroppen, såsom fedtvæv fra underlivet eller lejlighedsvis muskler fra andre dele af torso. Andre bruger brystimplantater , muligvis forud for vævsudvidere, for at give volumen. Nogle genopbygningsteknikker kræver flere operationer. Bagefter har nogle kvinder tilføjet tatoveringer for at simulere bryst -areoler eller få huden omformet til en brystvorte.
Salpingo-oophorektomi
Oophorektomi (kirurgisk fjernelse af æggestokkene) og salpingektomi (kirurgisk fjernelse af æggelederne) anbefales kraftigt til kvinder med BRCA -mutationer. Salpingo-oophorektomi er den mest effektive metode til forebyggelse af kræft i æggestokkene og æggelederne hos kvinder med en BRCA- mutation. Imidlertid er der stadig en lille risiko for primær peritoneal kræft , i det mindste blandt kvinder med BRCA1 -mutationer, da peritoneale foring er den samme type celler som dele af æggestokken. Denne risiko anslås at producere omkring fem tilfælde af peritoneal kræft pr. 100 kvinder med skadelige BRCA1 -mutationer i de 20 år efter operationen.
BRCA2- relateret æggestokkræft har tendens til at forekomme hos perimenopausale eller menopausale kvinder, så salpingo-oophorektomi anbefales mellem 45 og 50 år. Hvis det gøres før overgangsalderen, har kvinderne også fordel af en reduceret risiko for brystkræft.
Operationen udføres ofte i forbindelse med en hysterektomi (kirurgisk fjernelse af livmoderen) og nogle gange en cervicektomi (kirurgisk fjernelse af livmoderhalsen ), især hos kvinder, der ønsker at tage tamoxifen , som vides at forårsage livmoderkræft, eller som har livmoderen fibromer . Flere former for kirurgi er tilgængelige, herunder laparoskopisk (nøglehul) kirurgi. Fordi omkring 5% af kvinderne med en BRCA -mutation har uopdaget kræft i æggestokkene på tidspunktet for deres planlagte operation, bør operationen behandles som om det var en fjernelse af en kendt kræftsygdom.
Salpingo-oophorektomi gør kvinden steril (ude af stand til at føde børn). Infertilitetstjenester kan bruges til at bevare hendes æg , hvis det ønskes. Da fordelene ved operationen er størst tæt på overgangsalderen, udsætter de fleste kvinder simpelthen operationen, indtil de allerede har født så mange børn, som de vælger at.
Operationen fremkalder også kunstigt overgangsalderen, hvilket forårsager hedeture , søvnforstyrrelser, humørsvingninger, vaginal tørhed, seksuelle vanskeligheder, vanskeligheder med at huske ord og andre medicinske tegn og symptomer . Bivirkningerne spænder fra mild til svær; de fleste kan behandles i det mindste delvist. Mange kvinder med en BRCA tager hormonerstatningsterapi for at reducere disse virkninger: østrogen-progesteron-kombinationer til kvinder, der har en livmoder, og ubestridt østrogen til kvinder, hvis livmoder blev fjernet. Østrogen kan forårsage brystkræft, men da mængden af østrogen, der tages, er mindre end den mængde, der produceres af de nu fjernede æggestokke, vurderes nettorisikoen normalt at være acceptabel.
Nogle kilder antager, at oophorektomi før 50 år fordobler risikoen for hjerte -kar -sygdomme og øger risikoen for hoftebrud forårsaget af osteoporose i den relevante befolkning.
Ikke-medicinske valg
I betragtning af de høje risici og den lave fordel ved livsstilsvalg i BRCA -mutationsbærere, giver ingen livsstilsvalg tilstrækkelig beskyttelse.
At have sit første barn i en yngre alder, få flere børn end gennemsnittet og amme i mere end et år reducerer risikoen for brystkræft for en kvinde med en gennemsnitlig risiko. Undersøgelser om denne effekt blandt BRCA -mutationsbærere har frembragt modstridende resultater, men generelt antages det at have børn kun lidt eller ingen beskyttelse mod brystkræft for kvinder med BRCA1 -mutationer og paradoksalt nok øge risikoen for brystkræft for kvinder med BRCA2 -mutationer .
At være fysisk aktiv og opretholde en sund kropsvægt forhindrer bryst- og andre kræftformer i den generelle befolkning samt forhindrer hjertesygdomme og andre medicinske tilstande. Blandt kvinder med en BRCA -mutation har fysisk aktivitet og en sund kropsvægt som teenager ingen effekt på kræft i æggestokkene og forsinker, men forhindrer ikke helt, brystkræft efter overgangsalderen. I nogle undersøgelser gav kun betydelig, anstrengende træning nogen fordel. Fedme og vægtøgning som voksen er forbundet med diagnoser af brystkræft.
Undersøgelser af specifikke fødevarer, kostvaner eller kosttilskud har generelt frembragt modstridende oplysninger, eller i tilfælde af fedt , sojaforbrug og at drikke grøn te er kun blevet udført hos kvinder med gennemsnitlig risiko. Den eneste kostintervention, der generelt accepteres som forebyggelse af brystkræft hos BRCA -mutationsbærere, er at minimere forbruget af alkoholholdige drikkevarer . Indtagelse af mere end en alkoholholdig drink om dagen er stærkt forbundet med en højere risiko for at udvikle brystkræft, og bærere opfordres normalt til ikke at indtage mere end en alkoholholdig drink om dagen og ikke mere end fire i alt om en uge.
I en undersøgelse foretaget med Ashkenazi jødiske kvinder blev det observeret, at mutationsbærere født før 1940 har en meget lavere risiko for at blive diagnosticeret med brystkræft i 50 -årsalderen end dem, der er født efter 1940; dette blev også observeret i ikke-bærerpopulationen. Årsagerne til forskellen er ukendt. I modsætning til den generelle befolkning har alder ved menarche og alder i overgangsalderen ingen effekt på brystkræftrisiko for BRCA -mutationsbærere.
Evolutionær fordel
Flere hypoteser foreslår, at BRCA -mutationer kan have evolutionære fordele, såsom højere intelligens. Ashkenazi -intelligenshypotesen blev foreslået af Gregory Cochran og hævder, at en defekt i BRCA1 -genet kan frigøre neural vækst.
Undersøgelser har vist, at BRCA1 -mutationer ikke er tilfældige, men under adaptiv selektion, hvilket indikerer, at selvom BRCA1 -mutationer er knyttet til brystkræft, har mutationerne sandsynligvis også en gavnlig effekt.
Patenter
En patentansøgning om det isolerede BRCA1- gen og kræftkræftfremmende mutationer, der er diskuteret ovenfor, samt metoder til at diagnosticere sandsynligheden for at få brystkræft, blev indgivet af University of Utah, National Institute of Environmental Health Sciences (NIEHS) og Myriad Genetics i 1994; i løbet af det næste år isolerede og sekventerede Myriad i samarbejde med efterforskere fra Endo Recherche, Inc., HSC Research & Development Limited Partnership og University of Pennsylvania BRCA2 -genet og identificerede centrale mutationer, og det første BRCA2 -patent blev indgivet i USA af Myriad og andre institutioner i 1995. Myriad er den eksklusive licenshaver af disse patenter og har håndhævet dem i USA mod kliniske diagnostiske laboratorier. Denne forretningsmodel førte til, at Myriad voksede som en opstart i 1994 til at være et børsnoteret selskab med 1200 ansatte og omkring $ 500 mio. I årlig omsætning i 2012; det førte også til kontroverser om høje priser og manglende evne til at få second opinions fra andre diagnostiske laboratorier, hvilket igen førte til den skelsættende Association for Molecular Pathology v. Myriad Genetics retssag. Patenterne begynder at udløbe i 2014.
Ifølge en artikel, der blev offentliggjort i tidsskriftet, Genetic Medicine, i 2010, "Patenthistorien uden for USA er mere kompliceret .... For eksempel er der opnået patenter, men patenterne ignoreres af provinsielle sundhedssystemer i Canada. I Australien og Storbritannien tillod Myriads licenshaver brug af sundhedssystemer, men annoncerede en ændring af planer i august 2008. ... Kun en enkelt mutation er blevet patenteret i Myriads enlige europæiske dækkende patent, selvom nogle patenter stadig er under revision af en oppositionen. Faktisk er USA den eneste jurisdiktion, hvor Myriads stærke patentstilling har givet eneleverandørstatus. " Peter Meldrum, administrerende direktør for Myriad Genetics, har erkendt, at Myriad har "andre konkurrencemæssige fordele, der kan gøre en sådan [patent] håndhævelse unødvendig" i Europa.
Juridiske afgørelser omkring BRCA1- og BRCA2 -patenterne påvirker generelt genetisk testning. I juni 2013, i Association for Molecular Pathology v. Myriad Genetics (nr. 12-398), fastslog den amerikanske højesteret enstemmigt, at "Et naturligt forekommende DNA-segment er et naturprodukt og ikke patentberettiget, blot fordi det er blevet isoleret , "ugyldiggør Myriads patenter på BRCA1- og BRCA2 -generne. Domstolen fastslog imidlertid også, at manipulation af et gen for at skabe noget, der ikke findes i naturen, stadig kan være berettiget til patentbeskyttelse.
Se også
Referencer
eksterne links
- BOADICEA , et risikovurderingsværktøj til familiær bryst- og æggestokkræft
- BRCA1 og BRCA2 ved Lab Tests Online
- BRCA Exchange , stor database med BRCA1- og BRCA2 -varianter med patogenicitetsklassifikationer.
