Diabetisk nefropati - Diabetic nephropathy
| Diabetisk nefropati | |
|---|---|
| Andre navne | Diabetisk nyresygdom |
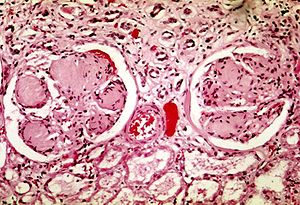 | |
| To glomeruli ved diabetisk nefropati: de acellulære lyslilla områder inden for kapillartufterne er de destruktive mesangiale matrixaflejringer. | |
| Specialitet |
Nefrologi , endokrinologi |
| Symptomer | Albuminuri , perifert ødem , forhøjet blodtryk, træthed |
| Risikofaktorer | Højt blodtryk, tobaksrygning , ustabil blodsukker |
| Diagnostisk metode | Unormale niveauer af urinalbumin |
| Forebyggelse | Rygestop |
| Behandling | ACE -hæmmere |
Diabetisk nefropati , også kendt som diabetisk nyresygdom , er det kroniske tab af nyrefunktion, der forekommer hos personer med diabetes mellitus . Diabetisk nefropati er en af de førende årsager til kronisk nyresygdom (CKD) og nyresygdom i slutstadiet (ESRD) globalt. Proteintab i urinen på grund af skader på glomeruli kan blive massivt og forårsage et lavt serumalbumin med resulterende generaliseret kropshævelse (ødem) og resultere i nefrotisk syndrom . På samme måde kan den estimerede glomerulære filtrationshastighed (eGFR) gradvist falde fra en normal på over 90 ml/min/1,73 m 2 til mindre end 15, på hvilket tidspunkt det siges, at patienten har nyresygdom i slutstadiet . Det er normalt langsomt progressivt over år.
Patofysiologiske abnormiteter ved diabetisk nefropati begynder med mangeårige dårligt kontrollerede blodglukoseniveauer. Dette efterfølges af flere ændringer i filtreringsenhederne i nyrerne, nefronerne . (Der er normalt omkring 750.000–1.5 millioner nefroner i hver voksen nyre). Indledningsvis er der indsnævring af de efferente arterioler og udvidelse af afferente arterioler med resulterende glomerulær kapillær hypertension og hyperfiltrering; dette ændrer gradvist til hypofiltrering over tid. Samtidig er der ændringer i selve glomerulus: disse omfatter en fortykkelse af basalmembranen , en udvidelse af podocytternes spaltmembraner , en stigning i antallet af mesangialceller og en stigning i mesangial matrix. Denne matrix invaderer de glomerulære kapillærer og producerer aflejringer kaldet Kimmelstiel-Wilson knuder. De mesangiale celler og matrix kan gradvist ekspandere og forbruge hele glomerulus og lukke filtrering.
Status for diabetisk nefropati kan overvåges ved at måle to værdier: mængden af protein i urinen - proteinuri ; og en blodprøve kaldet serumkreatinin . Mængden af proteinuri afspejler graden af skade på enhver stadig fungerende glomeruli. Værdien af serumkreatinin kan bruges til at beregne den estimerede glomerulære filtrationshastighed (eGFR), som afspejler procentdelen af glomeruli, som ikke længere filtrerer blodet. Behandling med en angiotensinkonverterende enzymhæmmer eller angiotensinreceptorblokker , der udvider arteriolen, der forlader glomerulus, og dermed reducerer blodtrykket i de glomerulære kapillærer, hvilket kan bremse (men ikke stoppe) sygdommens forløb. Tre klasser af diabetesmedicin- GLP-1-agonister , DPP-4-hæmmere og SGLT2-hæmmere -menes også at bremse udviklingen af diabetisk nefropati.
Diabetisk nefropati er den mest almindelige årsag til nyresygdom i slutstadiet og er en alvorlig komplikation, der rammer cirka en fjerdedel af voksne med diabetes i USA. Berørte personer med nyresygdom i slutstadiet kræver ofte hæmodialyse og til sidst nyretransplantation for at erstatte den mislykkede nyrefunktion. Diabetisk nefropati er forbundet med en øget risiko for død generelt, især fra hjerte -kar -sygdomme .
tegn og symptomer
Symptomernes begyndelse er 5 til 10 år efter, at sygdommen begynder. Et sædvanligt første symptom er hyppig vandladning om natten: nocturia . Andre symptomer omfatter træthed , hovedpine , generel sygdomsfølelse , kvalme , opkastning , hyppig vandladning i dagtimerne, mangel på appetit , kløende hud og hævelse af benene . Den kliniske præsentation af diabetisk nefropati (DN) er karakteriseret ved proteinuri (protein i urinen), hypertension og progressivt tab af nyrefunktion. Processen kan i første omgang være sløv, hvilket gør regelmæssig screening for diabetisk nefropati hos patienter med diabetes mellitus af stor betydning.
Risikofaktorer
Ikke alle patienter med diabetes udvikler diabetisk nefropati. De vigtigste risikofaktorer, der øger sandsynligheden for at udvikle diabetisk nefropati er:
- Dårlig kontrol af blodsukker
- Ukontrolleret forhøjet blodtryk
- Type 1 diabetes mellitus , med debut inden 20 år
- Tidligere eller nuværende cigaretbrug
- En familiehistorie med diabetisk nefropati- visse gener er blevet identificeret, der er forbundet med DN. (Der er imidlertid endnu ikke etableret nogen direkte sammenhæng. Et af disse gener er APOL1, som har vist sig at være forbundet med nefropati hos afroamerikanske individer.)
- Visse racegrupper (afroamerikanere, mexicanske amerikanere og pima -indianere har større risiko).
Patofysiologi
Sygdomsprogressionen ved diabetisk nefropati involverer forskellige kliniske faser: hyperfiltrering, mikroalbuminuri, makroalbuminuri, nefrotisk proteinuri til progressiv kronisk nyresygdom, der fører til nyresygdom i slutstadiet (ESRD). Skaden udøves på alle rum i nyrerne: glomerulus, nyretubuli, vaskulaturen (afferente og efferente renale arterioler) og interstitium. Nyrefibrose er den sidste fælles vej for DN. Denne fibrose er et produkt af flere mekanismer, herunder nyrehæmodynamiske ændringer, glukosemetabolisme-abnormiteter forbundet med oxidativ stress samt inflammatoriske processer og et overaktivt renin-angiotensin-aldosteronsystem (RAAS).
Patofysiologien ved diabetisk nefropati menes at involvere en vekselvirkning mellem hæmodynamiske og metaboliske faktorer.
Hæmodynamiske faktorer omfatter en stigning i systemisk og intraglomerulært tryk samt overaktivering af RAAS. Undersøgelser har vist, at i forbindelse med diabetes stimulerer forskellige faktorer RAAS, som er en af de vigtigste veje inden for diabetisk nefropati -patofysiologi. På grund af den højere mængde filtreret glukose er der en opregulering i natriumglucose-cotransporter 2 (SGLT2) i de proksimale tubuli, som cotransporterer natrium og glucose tilbage til cirkulation. Dette fører til et fald i levering af natriumchlorid til macula densa i de distale tubuli, hvilket fremmer frigivelse af renin og overaktiverende RAAS. Hyperfiltrering er et af de tidligste træk ved DN. Flere mekanismer er blevet foreslået til at forårsage hyperfiltrering. En af disse mekanismer er, at når glomeruli bliver hypertrofieret, øges filtreringsoverfladearealet i første omgang. En anden mulig mekanisme er, at unormal vaskulær kontrol ved diabetisk nefropati fører til en reduktion i afferent glomerulær arteriolær resistens og en stigning i efferent glomerulær arteriolær resistens, hvilket fører til en nettostigning i nyreblodgennemstrømning (RBF) og glomerulær filtrationshastighed (GFR). Glomerulær hyperfiltrering og en afvigende regulering af RAAS fører til øget intraglomerulært tryk, hvilket forårsager stress på endotelcellerne, mesangialcellerne og podocytterne. Dette forværrer dysfunktionen forårsaget af metaboliske virkninger af hyperglykæmi.
Metaboliske faktorer omfatter dannelsen af avancerede glycation-slutprodukter (AGE'er), som har en central rolle i patofysiologien for mange af komplikationerne ved diabetes mellitus, herunder kardiovaskulære komplikationer. ALDER er kemiske grupper, der dannes, når et reducerende sukker (glucose i dette tilfælde) reagerer ikke-enzymatisk med en amingruppe, overvejende lysin og arginin, som er bundet til proteiner, lipider og nukleinsyrer. Disse glykeringsprodukter akkumuleres på proteinerne i karvægskollagen og danner et irreversibelt kompleks af tværbundne AGE'er. En vigtig måde, hvorpå AGE'er udøver deres virkning, er gennem en receptormedieret mekanisme, vigtigst af receptoren for avancerede glycation-slutprodukter (RAGE). RAGE er en signaltransduktionsreceptor, der findes på en række celletyper, herunder makrofager, endotelceller, renale mesangialceller og podocytter i glomerulus. Bindinger af AGE'er til RAGE-receptorer øger produktionen af cytosoliske reaktive iltarter (ROS) samt stimulerer intracellulære molekyler såsom Protein Kinase C (PKC), NF-kB og aktiveringen af vækstfaktorer TGF-B og vaskulær endotelvækstfaktor (VEGF ). Disse faktorer, sammen med de hæmodynamiske ændringer, der opstår, fører til podocytskade, oxidativ stress, betændelse og fibrose. Efterhånden som skaden forværres, falder nyrefunktionen, og glomerulær basalmembran (GBM) bliver mere gennemtrængelig og mindre effektiv ved filtrering. Dette ledsages af et støt fald i nyrefunktionen.
Diagnose
Diagnosen er baseret på måling af unormale niveauer af urinalbumin hos en diabetiker kombineret med udelukkelse af andre årsager til albuminuri. Albuminmålinger defineres som følger:
- Normal albuminuri : udskillelse af albumin i urinen <30 mg/24 timer;
- Mikroalbuminuri : udskillelse af albumin i urinen i intervallet 30–299 mg/24 timer;
- Makroalbuminuri : udskillelse af albumin i urinen ≥300 mg/24 timer
- Urinalbuminudskillelse kan også måles ved urinalbumin/kreatininforhold i en urinprøve, som er lige så præcis, men mere bekvem end en 24-timers urinopsamling.
Det anbefales, at diabetikere får deres albuminniveauer kontrolleret årligt, begyndende umiddelbart efter en diagnose af type 2 -diabetes og fem år efter en diagnose af type 1 -diabetes. Medicinsk billeddannelse af nyrerne, generelt ved ultralyd , anbefales som led i en differentialdiagnose, hvis der er mistanke om urinvejsobstruktion , urinvejsinfektion , nyresten eller polycystisk nyresygdom . Conformation nyrebiopsi bør kun udføres, hvis der er mistanke om ikke-diabetisk nyresygdom.
Urinanalyse hos patienter med diabetisk nyresygdom er ofte intetsigende. I tilfælde af stærkt øget mikroalbuminuri kan hæmaturi være til stede. fedtstoffer kan være til stede hos patienter, der udvikler nefrotisk proteinuri.
| CKD Stage | eGFR -niveau (ml/min/1,73 m 2 ) |
|---|---|
| Scene 1 | ≥ 90 |
| Trin 2 | 60–89 |
| Trin 3 | 30–59 |
| Trin 4 | 15–29 |
| Trin 5 | <15 |
Iscenesættelse
For at trinere graden af skade ved denne (og enhver) nyresygdom bestemmes serumkreatinin og bruges til at beregne den estimerede glomerulære filtrationshastighed ( eGFR ). Normal eGFR er lig med eller større end 90 ml/min/1,73 m 2 .
Biomarkører
Selvom albuminuri er den hyppigst anvendte markør for DN, har den en begrænset følsomhed, da mange patienter med diabetisk nefropati oplever GFR -tab og glomerulosklerose uden øjeblikkelig stigning i albuminuri. Mange nye markører undersøges i øjeblikket, der potentielt påviser diabetisk nefropati på tidligere stadier og identificerer udviklingsrisiko. Cystatin C er et protein, der filtreres frit i glomeruli, før det reabsorberes og kataboliseres i de renale tubulære celler. Serumniveauet er uafhængigt af muskelmasse, hvilket gør det mere præcist at estimere GFR end kreatininserumniveauer.
Behandling
Behandlingsmålene er at bremse udviklingen af nyreskader og kontrollere relaterede komplikationer. Håndtering af diabetisk nefropati er i øjeblikket centreret over fire hovedområder: Kardiovaskulær risikoreduktion, glykæmisk kontrol, blodtrykskontrol samt hæmning af RAAS -systemet.
Kardiovaskulær risikoreduktion: Patienter med diabetes har en signifikant øget risiko for hjerte -kar -sygdomme, som også er en uafhængig risikofaktor for nyresvigt. Derfor er det vigtigt aggressivt at håndtere kardiovaskulære risikofaktorer hos patienter med diabetes mellitus og især dem med diabetisk nefropati. Hovedkomponenterne i håndteringen af hjerte-kar-sygdomme er med tobaksophør, lipidsænkende behandlinger (f.eks. Statiner) samt regelmæssig motion og sund kost. Hos patienter med nyresygdom foretrækkes atorvastatin frem for andre statiner, da det ikke kræver dosisjustering baseret på GFR.
Glykæmisk kontrol: Flere undersøgelser har fundet en positiv effekt af forbedret glykæmisk kontrol på kliniske resultater af patienter med diabetisk nefropati. Intensiv glykæmisk kontrol reducerer også frekvensen af andre DM -komplikationer, såsom retinopati og neuropati. Glykæmisk kontrol opretholdes hovedsageligt med insulin hos patienter med type 1 DM og med hypoglykæmiske midler og/eller insulin hos patienter med type 2 DM. Undersøgelser viste et fald i mikrovaskulære komplikationer af diabetisk nefropati med en målmål HbA1c -koncentration på 7%. Yderligere reduktion af HbA1c korrelerede ikke med bedre resultater og anbefales derfor ikke hos de fleste patienter, da det kunne øge risikoen for hypoglykæmiske episoder.
Blodtrykskontrol: Flere randomiserede kliniske forsøg har vist en fordel ved faldende systolisk blodtryk til <140 mmHg hos patienter med diabetisk nefropati. Højt blodtryk er forbundet med accelereret udvikling af mikroalbuminuri, over proteinuri og faldende nyrefunktion. Angiotensin-konverterende enzymhæmmere samt angiotensin II-receptorblokkere er særligt nyttige til patienter med diabetes til at sænke blodtrykket og bremse udviklingen af nefropati. Mere intensivt lavere blodtryk (125-130/<80) hos patienter med diabetes mellitus har vist sig at reducere risikoen for progression af diabetisk nefropati samt andre diabetiske komplikationer. Nogle patienter kan kræve dobbeltbehandling for at kontrollere trykket tilstrækkeligt, i hvilket tilfælde calciumkanalblokkere eller diuretika er en god andenlinjemulighed.
RAAS -hæmning: Inhibering kan opnås med flere behandlinger, hovedsageligt ACE -hæmmere, angiotensinreceptorblokkere, direkte reninhæmmere og mineralokortikoidantagonister. RAAS -hæmning har vist sig at være den mest effektive terapi til at bremse udviklingen af diabetisk nefropati i alle faser. Selvom RAAS -blokade ved brug af mere end ét middel yderligere kan reducere proteinuri, opvejer risikoen for bivirkninger (såsom hyperkalæmi, akut nyreskade) de potentielle fordele. Derfor anbefales det, at der kun bruges et middel til patienter med DM, der har hypertension eller tegn på mikroalbuminuri eller diabetisk nefropati.
Omkring halvdelen af insulin metaboliseres og ryddes af nyrerne. Det betyder, at da nyrefunktionen forværres ved indstilling af DN, kan nogle patienter med insulinafhængig DM opleve, at deres normale insulindoser varer længere end normalt, eller at de oplever en stigende hyppighed af hypoglykæmiske episoder. Det er også afgørende at nøje overvåge nyrefunktionen for korrekt dosering af medicin, der ryddes af nyrerne. Nogle af de mest almindeligt anvendte nefrotoksiske lægemidler er ikke-steroide antiinflammatoriske lægemidler (NSAID'er) såsom ibuprofen. Med forværret nyrefunktion kan det også være nødvendigt at følge en renal diæt for at undgå komplikationer såsom hyperkalæmi og metabolisk acidose. Nogle beviser tyder på, at begrænsning af kostprotein kan bremse udviklingen af DN, men yderligere beviser er nødvendige for at bekræfte denne fordel. Patienter med diabetisk nefropati kan fortsætte med at udvikle nyresygdom i slutstadiet og kræve nyretransplantation eller hæmodialyse.
Nye terapier
En relativt ny medicin, der er godkendt til behandling af DM, er natriumglucosecotransporter 2 (SGLT2) -hæmmere. Virkningsmekanismen for dette lægemiddel er til natriumglucoseoptagelsens cotransporter i den proksimale tubuli og derved genererer naturesis og glucosuri. I flere kliniske forsøg viste SGLT2 -hæmmere forbedrede kardiovaskulære resultater hos patienter med DM samt en positiv effekt på nyreudfaldet, hovedsageligt en reduktion i albuminuri og progression af nyreskader. Andre klasser af diabetesmedicin, der har vist sig at have en positiv effekt på udviklingen af diabetisk nefropati, er GLP-1-agonister og DPP-4-hæmmere.
Prognose
Diabetisk nefropati ved type 2 -diabetes kan være sværere at forudsige, fordi starten på diabetes normalt ikke er veletableret. Uden intervention vil 20–40 procent af patienterne med type 2 -diabetes/mikroalbuminuri udvikle sig til makroalbuminuri. Diabetisk nefropati er den mest almindelige årsag til nyresygdom i slutstadiet , som kan kræve hæmodialyse eller endda nyretransplantation . Det er forbundet med en øget risiko for død generelt, især fra hjerte -kar -sygdomme .
Epidemiologi
Diabetisk nefropati rammer cirka en tredjedel af patienterne med type 1 og type 2 diabetes. Diabetisk nefropati er ansvarlig for omkring en tredjedel af tilfældene af ESRD på verdensplan og en endnu større brøkdel i de udviklede lande. På verdensplan forventes forekomsten af diabetes at stige fra 382 millioner i 2013 til over 592 millioner i 2035. Denne stigning forventes at være størst i udviklede lande. Forekomsten af type 2 DM stiger især på grund af den stigende forekomst af fedme på verdensplan. Diabetisk nyresygdomsprogression kan føre til ESRD samt øget risiko for kardiovaskulære komplikationer, som alle medfører en betydelig økonomisk byrde. De anslåede omkostninger til behandling af patienter med ESRD på grund af diabetisk nefropati i USA er 39,35 milliarder USD i 2010. Inden for udviklede lande har visse etniske grupper som afroamerikanere og indianere større risiko for at udvikle diabetisk nefropati og ESRD.
Se også
Referencer
Yderligere læsning
- "Virkninger af renin-angiotensinsystemblokkere på nyreudfald og dødelighed af alle årsager hos patienter med diabetisk nefropati: en opdateret metaanalyse" . www.crd.york.ac.uk . Hentet 2015-07-02 .
- Gross JL, de Azevedo MJ, Silveiro SP, Canani LH, Caramori ML, Zelmanovitz T (januar 2005). "Diabetisk nefropati: diagnose, forebyggelse og behandling" . Diabetes Care . 28 (1): 164–76. doi : 10.2337/diacare.28.1.164 . PMID 15616252 .
- Tziomalos K, Athyros VG (2015). "Diabetisk nefropati: Nye risikofaktorer og forbedringer i diagnosen" . Anmeldelsen af diabetesstudier . 12 (1–2): 110–8. doi : 10.1900/RDS.2015.12.110 . PMC 5397986 . PMID 26676664 .
- Kume S, Koya D, Uzu T, Maegawa H (2014). "Rolle af næringsfølende signaler i patogenesen af diabetisk nefropati" . BioMed Research International . 2014 : 315494. doi : 10.1155/2014/315494 . PMC 4122096 . PMID 25126552 .
- Doshi SM, Friedman AN (august 2017). "Diagnose og håndtering af type 2 -diabetisk nyresygdom" . Clinical Journal of the American Society of Nephrology . 12 (8): 1366–1373. doi : 10.2215/CJN.11111016 . PMC 5544517 . PMID 28280116 .
eksterne links
| Klassifikation | |
|---|---|
| Eksterne ressourcer |
| Scholia har et emne profil for diabetisk nefropati . |

