RNA -terapi - RNA therapeutics
RNA -terapi er en ny klasse medicin, der er baseret på ribonukleinsyre (RNA) . Forskning har arbejdet med klinisk brug siden 1990'erne med betydelig succes inden for kræftbehandling i begyndelsen af 2010'erne. I 2020 og 2021 er mRNA-vacciner blevet udviklet globalt til brug til bekæmpelse af coronavirus-sygdommen (COVID-19-pandemi). Den Pfizer-BioNTech COVID-19-vaccine var den første mRNA vaccine godkendt af en medicin regulator , efterfulgt af Moderna COVID-19-vaccine , og andre.
Hovedtyperne af RNA -terapi er dem, der er baseret på messenger -RNA (mRNA), antisense -RNA (asRNA), RNA -interferens (RNAi) og RNA -aptamerer . Af de fire typer er mRNA-baseret terapi den eneste type, der er baseret på at udløse syntese af proteiner i cellerne, hvilket gør den særlig nyttig i vaccineudvikling. Antisense RNA er komplementær til kodning af mRNA og bruges til at udløse mRNA -inaktivering for at forhindre mRNA'et i at blive brugt i proteinoversættelse. RNAi-baserede systemer bruger en lignende mekanisme og involverer brug af både lille interfererende RNA (siRNA) og mikro-RNA (miRNA) for at forhindre mRNA-translation. RNA -aptamerer er imidlertid korte, enkeltstrengede RNA -molekyler, der produceres ved styret evolution for at binde til en række biomolekylære mål med høj affinitet og derved påvirke deres normale in vivo -aktivitet.
RNA syntetiseres fra skabelon -DNA ved hjælp af RNA -polymerase med messenger -RNA (mRNA), der tjener som biomolekylet mellem DNA mellem ekspression og protein -translation . På grund af dets unikke egenskaber (såsom dens typisk enkeltstrengede natur og dens 2 'OH-gruppe) samt dets evne til at adoptere mange forskellige sekundære/tertiære strukturer har både kodende og ikke-kodende RNA'er tiltrukket særlig opmærksomhed inden for medicin. Forskning er begyndt at undersøge RNAs potentiale til at blive brugt til terapeutisk fordel, og unikke udfordringer er opstået under opdagelse af lægemidler og implementering af RNA -terapi.
mRNA
Messenger RNA ( mRNA ) er et enkeltstrenget RNA- molekyle, der er komplementært til en af DNA- strengene i et gen . Et mRNA -molekyle overfører en del af DNA -koden til andre dele af cellen til fremstilling af proteiner. DNA -terapier har brug for adgang til kernen for at blive transskriberet til RNA, og dets funktionalitet afhænger af nedbrydning af kernekapsler under celledeling. Imidlertid behøver mRNA -terapi ikke at komme ind i kernen for at være funktionel, da det vil blive oversat med det samme, når det er nået til cytoplasmaet . I modsætning plasmider og virale vektorer , mRNA'er ikke integreret i genomet , og derfor ikke har risikoen for insertionsmutagenese , hvilket gør dem egnede til anvendelse i cancervacciner, tumorimmunterapi og infektiøs sygdomsforebyggelse.
Opdagelse og udvikling
I 1953 rapporterede Alfred Day Hershey , at bakterier hurtigt efter infektion med fag producerede en form for RNA på et højt niveau, og at dette RNA også blev nedbrudt hurtigt. Men det første klar indikation af mRNA var fra arbejdet i Elliot Volkin og Lazarus Astrachan i 1956 ved at inficere E. coli med T2 bakteriofager og sætte dem ind i mediet med 32 P . De fandt ud af, at proteinsyntesen af E.Coli blev stoppet, og fagproteiner blev syntetiseret. Derefter i maj 1961 meddelte deres samarbejdede forskere Sydney Brenner, François Jacob og Jim Watson isolering af mRNA. I et par årtier efter mRNA -opdagelse fokuserede folk på at forstå de strukturelle, funktionelle og metaboliske vejaspekter ved mRNA'er. I 1990 demonstrerede Jon A. Wolff imidlertid ideen om nukleinsyrekodede lægemidler ved direkte at injicere in vitro-transskriberet (IVT) mRNA eller plasmid-DNA (pDNA) i muskelens skelet, som udtrykte det kodede protein i den injicerede muskel.
Når IVT mRNA har nået cytoplasma, oversættes mRNA med det samme. Det behøver således ikke at komme ind i kernen for at være funktionel. Det integreres heller ikke i genomet og har derfor ikke risiko for indsættende mutagenese. Desuden er IVT mRNA kun forbigående aktivt og nedbrydes fuldstændigt via fysiologiske metaboliske veje. På grund af disse årsager har IVT mRNA gennemgået omfattende præklinisk undersøgelse.
Mekanismer
In vitro -transskription (IVT) udføres på en lineariseret DNA -plasmidskabelon, der indeholder den målrettede kodende sekvens. Derefter vil nøgent mRNA eller mRNA kompleksbundet i en nanopartikel blive leveret systemisk eller lokalt. Herefter går en del af det eksogene nøgne mRNA eller komplekserede mRNA gennem cellespecifikke mekanismer. Når det er i cytoplasma, oversættes IVT mRNA af proteinsyntesemaskineriet.
Der er to identificerede RNA-sensorer, vejlignende receptorer (TLR'er) og RIG-I-lignende receptorfamilien. TLR'er er lokaliseret i det endosomale rum af celler, såsom DC'er og makrofager. RIG-I-lignende familie er som en mønstergenkendelsesreceptor (PRR). Imidlertid er immunresponsmekanismerne og processen med genkendelse af mRNA -vaccine ved hjælp af cellulære sensorer og mekanismen for sensoraktivering stadig uklare.
Ansøgninger
Immunterapi mod kræft
I 1995 demonstrerede Robert Conry, at intramuskulær injektion af nøgen RNA, der koder for carcinoembryonisk antigen, fremkaldte antigenspecifikke antistofresponser. Derefter blev det uddybet ved at demonstrere, at dendritiske celler (DC'er) udsat for mRNA, der koder for specifikke antigener eller for totalt mRNA ekstraheret fra tumorceller og injiceret i tumorbærende mus, inducerede T-celleimmunresponser og hæmmede væksten af tumorer. Derefter begyndte forskere at nærme sig mRNA-transficerede DC'er ved hjælp af vacciner baseret på ex vivo IVT mRNA-transficerede DC'er. I mellemtiden havde Argos Therapeutics igangsat et klinisk fase III -forsøg med DC'er med avanceret nyrecellecarcinom i 2015 (NCT01582672), men det blev afsluttet på grund af den manglende effekt.
For yderligere anvendelse blev IVT mRNA optimeret til in situ transfektioner af DC'er in vivo . Det forbedrede translationseffektiviteten og stabiliteten af IVT mRNA og forbedrede præsentationen af det mRNA-kodede antigen på MHC klasse I og II molekyler. Derefter fandt de ud af, at den direkte injektion af nøgen IVT -mRNA i lymfeknuder var den mest effektive måde at fremkalde T -cellers respons på. Baseret på denne opdagelse er først hos mennesker testet af injektion af nøgne IVT-mRNA, der koder for kræftantigener af BioNTech, startet med patienter med melanom (NCT01684241).
For nylig blev den nye kræftimmunterapi, kombinationen af selvleverende RNA (sd-rxRNA) og adoptiv celleoverførsel (ACT), opfundet af RXi Pharmaceuticals og Karolinska Institute . I denne terapi eliminerede sd-rxRNA ekspressionen af immunsuppressive receptorer og proteiner i terapeutiske immunceller, så det forbedrede immuncellernes evne til at ødelægge tumorcellerne. Derefter hjalp PD-1- målrettet sd-rxRNA med at øge antitumoraktiviteten af tumorinfiltrerende lymfocytter (TIL) mod melanomceller. Baseret på denne idé er mRNA-4157 blevet testet og bestået fase I klinisk forsøg.
Vacciner
I 1993 blev den første succes med en mRNA -vaccine rapporteret i mus ved anvendelse af liposomindkapslet IVT mRNA, der koder for nukleoproteinet af influenza, der inducerede virusspecifikke T -celler. Derefter blev IVT mRNA formuleret med syntetiske lipid -nanopartikler, og det inducerede beskyttende antistofresponser mod respiratorisk syncytialvirus (RSV) og influenzavirus hos mus.
Der er et par forskellige typer IVT mRNA-baseret vaccineudvikling til infektionssygdomme. En af de vellykkede typer er at bruge selvforstærkende IVT mRNA, der har sekvenser af positivt strandede RNA-vira. Det blev oprindeligt udviklet til et flavivirus, og det fungerede med intradermal injektion. En af de andre måder er kun at injicere en to-komponentvaccine, der indeholder et mRNA- adjuvans og nøgen IVT-mRNA, der kun koder for influenza hemagglutinin- antigen eller i kombination med neuraminidase, der koder for IVT-mRNA.
For eksempel, til HIV -behandling, bruger vacciner DC'er transficeret med IVT mRNA, der koder for HIV -proteiner. Der er et par fase I og II kliniske forsøg med IVT mRNA-kodende kombinationer, og det viser, at antigenspecifikke CD8+ og CD4+ T-cellersvar kan induceres. Der er imidlertid ikke observeret nogen antivirale virkninger i det kliniske forsøg.
En af de andre mRNA-vacciner er mod COVID-19 . Det alvorlige akutte respiratoriske syndrom CoronaVirus 2 ( SARS-CoV-2 ) udbrud i december 2019 og spredte sig over hele verden, hvilket forårsagede en pandemi af luftvejssygdomme betegnet coronavirus sygdom 2019 (Covid-19). Den Moderna COVID-19-vaccine , fremstillet af Moderna siden 2020 er et lipid nanopartikel (LNP) indkapslede mRNA-baseret vaccine, som koder for et fuld-længde, prefusion stabiliseret spike (S) -2p antigenet af SARS-CoV-2 med en transmembrananker .
Begrænsninger
Der er mange udfordringer for en vellykket oversættelse af mRNA til lægemidler, fordi mRNA er et meget stort og tungt molekyle (10^5 ~ 10^6 Da). Desuden er mRNA ustabil og nedbrydes let af nukleaser, og det aktiverer også immunsystemet. Desuden har mRNA en høj negativ ladningstæthed, og det reducerer gennemtrængning af mRNA på tværs af cellemembraner. Af disse årsager nedbrydes mRNA let uden det passende leveringssystem, og halveringstiden for mRNA uden et leveringssystem er kun omkring 7 timer. Selvom nogle grader af udfordringer kunne overvindes ved kemiske ændringer , er levering af mRNA stadig en hindring. De metoder, der er blevet undersøgt for at forbedre leveringssystemet for mRNA, bruger mikroinjektion , RNA-patches (mRNA indlæst i en opløselig mikro-nål), genpistol , protaminkondens , RNA- adjuvanser og indkapsling af mRNA i nanopartikler med lipider.
Selvom In Vitro Translated (IVT) mRNA med afgivelsesmidler viste forbedret modstand mod nedbrydning, har det brug for flere undersøgelser af, hvordan man kan forbedre effektiviteten af levering af nøgen mRNA in vivo .
Antisense RNA
Antisense RNA er det ikke-kodende og enkeltstrengede RNA, der er komplementært til en kodende sekvens af mRNA. Det hæmmer evnen af mRNA til at blive translateret til proteiner. Korte antisense-RNA-transkripter produceres i kernen ved virkningen af enzymet Dicer, som spalter dobbeltstrengede RNA-forstadier til 21-26 nukleotid lange RNA-arter.
Der er en antisense-baseret opdagelsesstrategi, begrundelse og design af screeningsassays og anvendelse af sådanne assays til screening af naturlige produktekstrakter og opdagelse af fedtsyrekondenserende enzymhæmmere. Antisense RNA bruges til behandling af kræft og inhibering af metastase og vektorer til antisense -sekvestrering. Især MicroRNA'er (miR'er) 15 og 16 til en patient med behov for behandling til diagnose og profylakse af kræft. Antisense -lægemidler er baseret på det faktum, at antisense -RNA hybridiserer med og inaktiverer mRNA. Disse lægemidler er korte sekvenser af RNA, der binder sig til mRNA og forhindrer et bestemt gen i at producere det protein, som det koder for. Antisense -lægemidler udvikles til behandling af lungekræft, diabetes og sygdomme som gigt og astma med en stor inflammatorisk komponent. Det viser, at den nedsatte ekspression af MLLT4 antisense RNA 1 (MLLT4 -AS1) er en potentiel biomarkør og en forudsigelse for en dårlig prognose for mavekræft. Hidtil er anvendelser af antisense -RNA'er i antivirus- og kræftbehandlinger og til regulering af ekspression af beslægtede gener i planter og mikroorganismer blevet undersøgt.
For at levere antisense-RNA gennem cellemembranen til cytoplasma og kerne er der anvendt ikke-virale vektorer, virusvektorer, såsom retrovirus og adenovirus og liposomer. Det er blevet fundet ud af, at den virusbaserede levering er den mest fordelagtige blandt forskellige leveringssystemer, fordi den har en høj transfektionseffektivitet. Det er imidlertid svært at levere antisense -RNA kun til de målrettede websteder, og også på grund af størrelsen og stabilitetsproblemerne for antisense -RNA er der nogle begrænsninger for at bruge det. For at forbedre leveringsproblemerne er kemiske ændringer og design af nye oligonukleotider blevet undersøgt, og det forbedrede lægemiddelfordelingen, bivirkninger og tolerabilitet.
RNAi
Interfererende RNA er en klasse af kort, ikke-kodende RNA, der virker til at undertrykke translationelt eller post-translationelt genekspression. Deres opdagelse og efterfølgende identifikation som nøgleeffektorer af post-transkriptionel genregulering har gjort små interfererende RNA ( siRNA ) og mikro RNA ( miRNA ) potentielle terapeutiske midler til systemiske sygdomme. RNAi-systemet blev oprindeligt opdaget i 1990 af Jorgensen et al., Der forskede i introduktion af farvegener i petunier, og det menes, at dette system oprindeligt udviklede sig som et middel til medfødt immunitet mod dobbeltstrengede RNA-vira.
siRNA
Små interfererende ( siRNA ) er korte, 19-23 basepar (med et 3 'overhæng af to nukleotider), dobbeltstrengede stykker RNA, der deltager i det RNA-inducerede lyddæmpningskompleks (RISC) til gen-lyddæmpning. Specifikt er siRNA bundet af RISC -komplekset, hvor det afvikles ved hjælp af ATP -hydrolyse. Det bruges derefter som en vejledning af enzymet "Slicer" til at målrette mRNA'er til nedbrydning baseret på komplementær baseparring til mål-mRNA. Som terapeut kan siRNA leveres lokalt gennem øjet eller næsen til behandling af forskellige sygdomme. Lokal levering drager fordel af enkel formulering og levering af lægemidler og høj biotilgængelighed af lægemidlet. Systemisk levering er nødvendig for at målrette mod kræft og andre sygdomme. Målretning af siRNA, når det leveres lokalt, er en af de største udfordringer inden for siRNA -terapi. Selvom det er muligt at bruge intravenøs injektion til at levere siRNA-terapier, er der blevet rejst bekymringer om de store mængder, der blev brugt i injektionen, da disse ofte skal være ~ 20-30% af det samlede blodvolumen. Andre leveringsmetoder omfatter liposomemballage, konjugering til membranpermeable peptider og direkte væv/ organelektroporering . Derudover har det vist sig, at eksogene siRNA'er kun varer et par dage (højst et par uger i ikke-delende celler) in vivo . Hvis siRNA er i stand til med succes at nå sit mål, har det potentiale til terapeutisk at regulere genekspression gennem dets evne til at baseparre til mRNA-mål og fremme deres nedbrydning gennem RISC-systemet I øjeblikket er siRNA-baseret terapi i et klinisk fase I-forsøg til behandling af aldersrelateret makuladegeneration , selvom det også undersøges til brug i kræftbehandling. F.eks. Kan siRNA bruges til at målrette mRNA'er, der koder for proteiner, der fremmer tumorvækst, såsom VEGF -receptoren og telomeraseenzymet .
miRNA
Mikro RNA'er ( miRNA'er ) er korte, ~ 19-23 basepar lange RNA-oligonukleotider, der er involveret i det mikroRNA-inducerede lyddæmpningskompleks. Specifikt, når de er indlæst på ARGONAUTE- enzymet, arbejder miRNA'er med mRNA'er for at undertrykke translation og post-translationelt destabilisere mRNA . Mens de funktionelt ligner siRNA'er, kræver miRNA'er ikke omfattende baseparring til mRNA-lyddæmpning (kan kræve så få som syv basepar med mål), hvilket tillader dem i vid udstrækning at påvirke et bredere spektrum af mRNA-mål. I cellen bruger miRNA switch, tuning og neutrale interaktioner til fint at regulere genrepression. Som terapeut har miRNA potentialet til at påvirke biokemiske veje i hele organismen.
Med mere end 400 miRNA identificeret hos mennesker, er det den første udfordring at skelne mellem deres målgen for repression. Der er blevet bygget flere databaser, f.eks. TargetScan , ved hjælp af miRNA -frømatchning . In vitro assays hjælper med at bestemme de fænotypiske virkninger af miRNA'er, men på grund af genreguleringens komplekse natur har ikke alle identificerede miRNA'er den forventede effekt. Derudover har flere miRNA'er vist sig at fungere som enten tumorsuppressorer eller onkogener in vivo , såsom det onkogene miR-155 og miR-17-92.
I kliniske forsøg bruges miRNA almindeligvis som biomarkører for en række forskellige sygdomme, hvilket muligvis giver tidligere diagnose samt sygdomsprogression, stadium og genetiske forbindelser. Fase 1 og 2 forsøg tester i øjeblikket miRNA -efterligner (for at udtrykke gener) og miRNA (for at undertrykke gener) hos patienter med kræft og andre sygdomme. Især efterlignes miRNA'er til at introducere miRNA'er, der fungerer som tumorsuppressorer i kræftvæv, mens miRNA-antagonister bruges til at målrette onkogene miRNA'er for at forhindre deres kræftfremmende aktivitet. Terapeutisk miRNA bruges også ud over almindelige terapier (såsom kræftbehandlinger), der vides at overudtrykke eller destabilisere patientens miRNA -niveauer. Et eksempel på en efterligning af miRNA-terapi, der demonstrerede effektivitet til at hæmme lungekræfttumorvækst i musestudier, er miR-34a.
Et aspekt vedrørende miRNA-baserede terapier er potentialet for det eksogene miRNA til at påvirke miRNA-dæmpningsmekanismer i normale kropsceller og derved påvirke normale cellulære biokemiske veje. Imidlertid har in vivo- undersøgelser vist, at miRNA'er udviser ringe eller ingen effekt i ikke-målvæv/organer.
RNA -aptamer

Stort set er aptamerer små molekyler sammensat af enten enkeltstrenget DNA eller RNA og er typisk 20-100 nukleotider i længden eller ~ 3-60 kDa . På grund af deres enkeltstrengede natur er aptamerer i stand til at danne mange sekundære strukturer, herunder pseudoknoter , stamsløjfer og udbulninger, gennem inter-streng baseparringsinteraktioner. Kombinationerne af sekundære strukturer til stede i en aptamer giver den en bestemt tertiær struktur, som igen dikterer det specifikke mål, som aptamer selektivt vil binde sig til. På grund af aptamers selektive bindingsevne overvejer de et lovende biomolekyle til brug i lægemidler. Derudover udviser aptamerer stram binding til mål med dissociationskonstanter ofte i pM til nM -området. Udover deres stærke bindingsevne er aptamerer også værdsat, fordi de kan bruges på mål, der ikke er i stand til at blive bundet af små peptider genereret af fagvisning eller af antistoffer , og de er i stand til at skelne mellem konformationelle isomerer og aminosyresubstitutioner . Fordi aptamerer også er nukleinsyrebaserede, kan de syntetiseres direkte, hvilket eliminerer behovet for cellebaseret ekspression og ekstraktion, som det er tilfældet i antistofproduktion. RNA -aptamerer er især i stand til at producere et utal af forskellige strukturer, hvilket fører til spekulationer om, at de er mere diskriminerende i deres målaffinitet sammenlignet med DNA -aptamerer.
Opdagelse og udvikling
Aptamerer blev oprindeligt opdaget i 1990, da Lary Gold og Craig Tuerk anvendte en metode til styret evolution kendt som SELEX til at isolere et lille enkeltstrenget RNA -molekyle, der var i stand til at binde til T4 -bakteriofag -DNA -polymerase. Derudover blev udtrykket "aptamer" opfundet af Andrew Ellington, der arbejdede sammen med Jack Szostak for at vælge en RNA -aptamer, der var i stand til tæt binding til visse organiske farvestofmolekyler. Selve udtrykket er en konglomeration af det latinske "aptus" eller "at passe" og det græske "meros" eller "del".
RNA -aptamerer er ikke så meget “skabt” som “udvalgte”. For at udvikle en RNA -aptamer, der er i stand til selektiv binding til et molekylært mål, bruges en metode kendt som Systematic Evolution of Ligands by EXponential Enrichment (SELEX) til at isolere en unik RNA -aptamer fra en pulje på ~ 10^13 til 10^16 forskellige aptamerer , ellers kendt som et bibliotek. Biblioteket over potentielle aptameroligonukleotider inkuberes derefter med en ikke-målart for at fjerne aptamerer, der udviser ikke-specifik binding. Efter efterfølgende fjernelse af de ikke-specifikke aptamerer udsættes de resterende biblioteksmedlemmer derefter for det ønskede mål, som kan være et protein, peptid, celletype eller endda et organ (i tilfælde af levende dyrebaserede SELEX). Derfra transkriberes RNA-aptamererne, der var bundet til målet, til cDNA, som derefter amplificeres gennem PCR , og PCR-produkterne transskriberes derefter til RNA. Disse nye RNA-transkripter bruges derefter til at gentage selektionscyklussen mange gange og frembringer således til sidst en homogen pool af RNA-aptamerer, der er i stand til stærkt specifik målbinding med høj affinitet.
Eksempler
RNA aptamerer kan designes til at fungere som antagonister , agonister eller såkaldte ”RNA decoy aptamers.” I tilfælde af antagonister bruges RNA aptamer enten til at forhindre binding af et bestemt protein til dets cellemembranreceptor eller til at forhindre protein fra at udføre sin aktivitet ved at binde sig til proteinets mål. I øjeblikket fungerer de eneste RNA aptamer-baserede terapier, der har avanceret til kliniske forsøg som antagonister. Når RNA aptamerer er designet til at fungere som agonister, fremmer de immuncelleaktivering som en co- stimulerende molekyle, hvilket hjælper med at mobilisere kroppens eget forsvarssystem.For RNA -decoy -aptamerer ligner den syntetiske RNA -aptamer et naturligt RNA -molekyle. muligvis forstyrrer den biomolekylære vej for en bestemt sygdom Ud over deres anvendelighed som direkte terapeutiske midler overvejes RNA -aptamerer også til andre terapeutiske roller. konjugerer RNA -aptamer til en lægemiddelforbindelse, kan RNA -aptamer fungere som et målrettet leveringssystem for dette lægemiddel. Sådanne RNA -aptamerer er kendt som ApDC'er. Derudover kan RNA -aptamerer være nyttige ved konjugation til radioisotop eller et fluorescerende farvestofmolekyle ved diagnostisk billeddannelse.
På grund af SELEX -processen, der bruges til at vælge RNA -aptamerer, kan RNA -aptamerer genereres til mange potentielle mål. Ved direkte at introducere RNA-aptamererne til målet under SELEX, kan der produceres en meget selektiv, homogen pool af RNA-aptamerer med høj affinitet. Som sådan kan RNA -aptamerer laves til at målrette små peptider og proteiner samt cellefragmenter, hele celler og endda specifikke væv. Eksempler på RNA aptamer molekylære mål og potentielle mål indbefatter vaskulær endotelvækstfaktor , osteoblaster og CXC Chemokine Ligand 12 ( CXCL2 ).
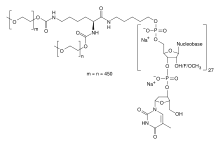
Et eksempel på en RNA-aptamerterapi omfatter Pegaptanib (alias Macugen ®), den eneste FDA-godkendte RNA-aptamerbehandling. Oprindeligt godkendt i 2004 til behandling af aldersrelateret makula degeneration , Pegaptanib er en 28 nukleotid RNA aptamer, der fungerer som en VEGF antagonist. Det er imidlertid ikke så effektivt som antistofbaserede behandlinger som bevacizumab og ranibizumab . Et andet eksempel på en RNA aptamer terapeutisk er NOX-A12, en 45 nukleotid RNA aptamer, der er i kliniske forsøg for kronisk lymfatisk leukæmi , bugspytkirtelkræft samt andre kræftformer. NOX-A12 fungerer som antagonist for CXCL12/SDF-1, et kemokin involveret i tumorvækst.
Begrænsninger
Selvom høj-selektivitet og tæt binding af RNA-aptamerer har skabt interesse for deres anvendelse som lægemidler, er der mange problemer, der har forhindret dem i at blive vellykkede in vivo . For det første nedbrydes RNA aptamerer efter ændringer efter at være blevet indført i kroppen af nukleaser i løbet af et par minutter. På grund af deres lille størrelse kan RNA -aptamerer også fjernes fra blodbanen af nyresystemet. På grund af deres negative ladning er RNA-aptamerer desuden kendt for at binde proteiner i blodbanen, hvilket fører til ikke-målvævsafgivelse og toksicitet. Der skal også udvises forsigtighed ved isolering af RNA-aptamererne, da aptamerer, der indeholder gentagne Cytosine-Phosphate-Guanine (CpG) sekvenser, vil forårsage immunsystemaktivering gennem den Toll-lignende receptorvej .
For at bekæmpe nogle af in vivo -begrænsningerne for RNA -aptamerer kan forskellige modifikationer tilføjes til nukleotiderne for at hjælpe med effektiviteten af aptameren. For eksempel kan en polyethylenglycol (PEG) -del fastgøres for at øge størrelsen på aptameren og derved forhindre dens fjernelse fra blodbanen med den nyre glomerulus . Imidlertid har PEG været impliceret i allergiske reaktioner under in vivo -test. Endvidere kan der tilføjes ændringer for at forhindre nedbrydning af nuklease, såsom en 2' -fluor- eller aminogruppe samt en 3 'inverteret thymidin. Derudover kan aptameren syntetiseres, så ribosesukkeret er i L-form i stedet for D-form , hvilket yderligere forhindrer nukleasegenkendelse. Sådanne aptamerer er kendt som Spiegelmers . For at forhindre Toll-lignende receptorvejsaktivering kan cytosinnukleobaserne i aptameren methyleres. På trods af disse potentielle løsninger til reduceret in vivo -effekt er det imidlertid muligt, at kemisk ændring af aptameren kan svække dens bindingsaffinitet over for sit mål.
Se også
Referencer
eksterne links
| Scholia har en profil for RNA -terapi (Q103741648) . |
- RNA -terapier stiger , Nature (april 2020)

