Glioblastoma - Glioblastoma
| Glioblastom | |
|---|---|
| Andre navne | Glioblastoma multiforme, klasse IV astrocytom |
 | |
| Koronal MR med kontrast til et glioblastom hos en 15-årig mand | |
| Specialitet | Neuro-onkologi , neurokirurgi |
| Symptomer | I første omgang uspecifikke, hovedpine , personlighedsændringer, kvalme , symptomer svarende til et slagtilfælde |
| Almindelig start | ~ 64 år gammel |
| Årsager | Normalt uklart |
| Risikofaktorer | Genetiske lidelser ( neurofibromatose , Li – Fraumeni syndrom ), tidligere strålebehandling |
| Diagnostisk metode | CT -scanning , MR -scanning , vævsbiopsi |
| Forebyggelse | Ukendt |
| Behandling | Kirurgi , kemoterapi , stråling |
| Medicin | Temozolomid , steroider |
| Prognose | Forventet levetid ~ 14 måneder med behandling (5 års overlevelse <7%) |
| Frekvens | 3 pr. 100.000 om året |
Glioblastoma , også kendt som glioblastoma multiforme ( GBM ), er den mest aggressive kræftform, der begynder i hjernen . I første omgang er tegn og symptomer på glioblastom uspecifikke. De kan omfatte hovedpine , personlighedsændringer, kvalme og symptomer, der ligner symptomer på et slagtilfælde . Symptomer forværres ofte hurtigt og kan udvikle sig til bevidstløshed .
Årsagen til de fleste tilfælde af glioblastom kendes ikke. Usædvanlige risikofaktorer omfatter genetiske lidelser , såsom neurofibromatose og Li - Fraumeni syndrom , og tidligere strålebehandling . Glioblastomer repræsenterer 15% af alle hjernetumorer . De kan enten starte fra normale hjerneceller eller udvikle sig fra et eksisterende lavkvalitets astrocytom . Diagnosen stilles typisk ved en kombination af en CT -scanning , MR -scanning og vævsbiopsi .
Der er ingen kendt metode til forebyggelse af kræften. Behandlingen involverer normalt kirurgi , hvorefter kemoterapi og strålebehandling anvendes. Medicinen temozolomid bruges ofte som en del af kemoterapi. Højdosis steroider kan bruges til at reducere hævelse og reducere symptomer. Kirurgisk fjernelse (dekompression) af tumoren er forbundet med øget overlevelse, men kun med nogle måneder.
På trods af maksimal behandling gentager kræften sig altid . Den typiske overlevelsesvarighed efter diagnosen er 12-15 måneder, hvor færre end 3-7% af mennesker overlever længere end fem år. Uden behandling er overlevelse typisk tre måneder. Det er den mest almindelige kræft, der begynder i hjernen og den næsthyppigste hjernesvulst, efter meningiom . Omkring 3 ud af 100.000 mennesker udvikler sygdommen om året. Gennemsnitsalderen ved diagnosen er 64, og sygdommen forekommer hyppigere hos mænd end kvinder. Immunterapi undersøges som behandling af kræften.
tegn og symptomer
Almindelige symptomer omfatter anfald , hovedpine, kvalme og opkastning , hukommelsestab , ændringer i personlighed, humør eller koncentration og lokaliserede neurologiske problemer. Den type symptomer, der produceres, afhænger mere af tumorens placering end af dens patologiske egenskaber. Tumoren kan hurtigt begynde at producere symptomer, men lejlighedsvis er en asymptomatisk tilstand, indtil den når en enorm størrelse.
Risikofaktorer
Årsagen til de fleste tilfælde er uklar. Omkring 5% udvikler sig fra en anden type hjernetumor kendt som et lavt kvalitetsastrocytom.
Genetik
Usædvanlige risikofaktorer omfatter genetiske lidelser som neurofibromatose, Li - Fraumeni syndrom, tuberøs sklerose eller Turcot syndrom . Tidligere strålebehandling er også en risiko. Af ukendte årsager forekommer det mere almindeligt hos mænd.
Miljø
Andre foreninger omfatter udsættelse for rygning , pesticider og arbejde inden for petroleumraffinering eller gummiproduktion .
Glioblastoma er blevet forbundet med viruserne SV40 , HHV-6 og cytomegalovirus .
Andet
Forskning er blevet foretaget for at se, om forbrug af spidskød er en risikofaktor. Ingen risiko var blevet bekræftet fra 2013. På samme måde er eksponering for stråling under medicinsk billeddannelse , formaldehyd og elektromagnetiske felter i boliger , f.eks. Fra mobiltelefoner og elektriske ledninger i hjemmet, blevet undersøgt som risikofaktorer. Fra 2015 havde de ikke vist sig at forårsage GBM. En metaanalyse, der blev offentliggjort i 2007, fandt imidlertid en sammenhæng mellem frekvensen af GBM'er og brug af en mobiltelefon i mere end 10 år, især blandt dem, der altid havde telefonen på den ene side af hovedet.
Patogenese
Den cellulære oprindelse af glioblastom er ukendt. På grund af lighederne i immunfarvning af gliaceller og glioblastom har gliomer, såsom glioblastoma, længe været antaget at stamme fra celler af glial type. Nyere undersøgelser tyder på, at astrocytter , oligodendrocyt -stamceller og neurale stamceller alle kunne tjene som oprindelsescelle.
Glioblastomer er kendetegnet ved tilstedeværelsen af små områder af nekrotiserende væv, der er omgivet af anaplastiske celler. Denne egenskab samt tilstedeværelsen af hyperplastiske blodkar adskiller tumoren fra astrocytomer af grad 3, som ikke har disse egenskaber.
GBM'er dannes normalt i det cerebrale hvide stof, vokser hurtigt og kan blive meget store, før de producerer symptomer. Færre end 10% dannes langsommere efter degeneration af lavkvalitets astrocytom eller anaplastisk astrocytom . Disse kaldes sekundære GBM'er og er mere almindelige hos yngre patienter (middelalder 45 mod 62 år). Tumoren kan strække sig ind i meninges eller ventrikelvæg , hvilket fører til højt proteinindhold i cerebrospinalvæsken (CSF) (> 100 mg/dl) samt lejlighedsvis pleocytose af 10 til 100 celler, for det meste lymfocytter . Maligne celler transporteret i CSF kan spredes (sjældent) til rygmarven eller forårsage meningeal gliomatose. Men metastaser af GBM ud over det centrale nervesystem er yderst usædvanligt. Omkring 50% af GBM'er optager mere end en lap på en halvkugle eller er bilaterale. Tumorer af denne type opstår sædvanligvis fra lillehjernen og kan udvise den klassiske infiltration over corpus callosum , der producerer en sommerfugl (bilateral) gliom .
Klassificering af Glioblastoma
Hjernetumorklassificering har traditionelt været baseret på histopatologi på makroskopisk niveau, målt i hæmatoxylin-eosinsnit . Den WHO offentliggjorde den første standard klassifikation i 1979 og har gjort det siden. WHO -klassificeringen af tumorer i det centrale nervesystem i 2007 var den sidste klassifikation hovedsageligt baseret på mikroskopifunktioner. Den nye WHO -klassificering af tumorer i det centrale nervesystem i 2016 var et paradigmeskift: nogle af tumorerne blev også defineret af deres genetiske sammensætning såvel som deres cellemorfologi.
Klassificeringen af gliomer ændrede sig væsentligt, og glioblastom blev nu hovedsageligt klassificeret i henhold til status for isocitrat dehydrogenase (IDH) mutation: IDH-vildtype eller IDH-mutant.
| IDH-vildtype glioblastom | IDH-mutant glioblastom | |
|---|---|---|
| Synonym | Primært glioblastom | Sekundært glioblastom |
| Forstadie læsion | Identificeret de novo | Spredt astrocytom
Anaplastisk astrocytom |
| Andel af glioblastomer | ~ 90% | ~ 10% |
| Medianalder ved diagnose | ~ 62 år | ~ 44 år |
| Mand: Kvinde forhold | 1,42: 1 | 1.05: 1 |
| Median længde af klinisk historie ved diagnose | 4 måneder | 15 måneder |
| Median samlet overlevelse | ||
| Kirurgi + strålebehandling | 9,9 måneder | 24 måneder |
| Kirurgi + strålebehandling + kemoterapi | 15 måneder | 31 måneder |
| Beliggenhed | Supratentorial | Helst frontalt |
| Nekrose | Stor | Begrænset |
| TERT promotor mutationer | 72% | 26% |
| TP53 mutationer | 27% | 81% |
| ATRX mutationer | Enestående | 71% |
| EGFR forstærkning | 35% | Enestående |
| PTEN mutationer | 24% | Enestående |
Molekylære ændringer
Fire undertyper af glioblastom er blevet identificeret baseret på genekspression:
- Klassisk: Omkring 97% af tumorer i denne undertype bærer ekstra kopier af epidermal growth factor receptor ( EGFR ) genet, og de fleste har højere end normalt ekspression af EGFR , hvorimod genet TP53 (p53), som ofte er muteret i glioblastom, er sjældent muteret i denne undertype. Tab af heterozygositet i kromosom 10 ses også ofte i den klassiske undertype ved siden af kromosom 7 -amplifikation.
- Den proneurale undertype har ofte høje ændringer i TP53 (p53) og i PDGFRA, genet, der koder for en type blodpladeafledt vækstfaktorreceptor , og i IDH1, genet, der koder for isocitrat dehydrogenase -1.
- Den mesenkymale undertype er karakteriseret ved høje mutationshastigheder eller andre ændringer i NF1 , genet, der koder for neurofibromin 1 og færre ændringer i EGFR -genet og mindre ekspression af EGFR end andre typer.
- Den neurale undertype blev karakteriseret ved ekspression af neuronmarkører som NEFL , GABRA1 , SYT1 og SLC12A5 , mens de ofte præsenterede sig som normale celler ved patologisk vurdering.
Mange andre genetiske ændringer er blevet beskrevet i glioblastom, og størstedelen af dem er grupperet i to veje, RB og PI3K/AKT . Glioblastomer har ændringer i henholdsvis 68-78% og 88% af disse veje.
En anden vigtig ændring er methylering af MGMT , et "selvmord" DNA -reparationsenzym. Methylering forringer DNA -transkription og ekspression af MGMT -genet. Da MGMT-enzymet kun kan reparere én DNA-alkylering på grund af dets selvmordsreparationsmekanisme, er reservekapaciteten lav, og methylering af MGMT-genpromotoren påvirker i høj grad DNA-reparationskapacitet. MGMT-methylering er forbundet med en forbedret reaktion på behandling med DNA-skadelige kemoterapeutika, såsom temozolomid.
Kræftens stamceller
Glioblastomceller med egenskaber, der ligner stamceller (glioblastomcancer stamceller ) er fundet i glioblastomer. Deres tilstedeværelse kombineret med glioblastomets diffuse karakter resulterer i vanskeligheder med at fjerne dem fuldstændigt ved kirurgi og menes derfor at være den mulige årsag bag resistens over for konventionelle behandlinger og den høje tilbagefaldshastighed. Glioblastomcancer stamceller deler en vis lighed med neurale stamceller, der begge udtrykker overfladereceptoren CD133. CD44 kan også bruges som en kræftstamcellemarkør i en delmængde af glioblastom -tumorceller. Glioblastomcancer stamceller ser ud til at udvise øget resistens over for strålebehandling og kemoterapi medieret, i det mindste delvist, ved opregulering af DNA-skaderesponsen .
Metabolisme
De IDH1 genet koder for enzymet isocitratdehydrogenase 1 og er ikke almindelige muteret i glioblastom (primær GBM: 5%, sekundær GBM> 80%). Ved at producere meget høje koncentrationer af "oncometabolite" D-2-hydroxyglutarat og dysregulere funktionen af vildtype IDH1-enzymet fremkalder det dybe ændringer i metabolismen af IDH1- muteret glioblastom sammenlignet med IDH1 vildtype glioblastom eller raske astrocytter . Blandt andet øger det glioblastomcellernes afhængighed af glutamin eller glutamat som energikilde. IDH1 -muterede glioblastomer menes at have en meget stor efterspørgsel efter glutamat og bruger denne aminosyre og neurotransmitter som et kemotaktisk signal. Da raske astrocytter udskiller glutamat, favoriserer IDH1 -muterede glioblastomceller ikke tætte tumorstrukturer, men vandrer, invaderer og spredes i sunde dele af hjernen, hvor glutamatkoncentrationer er højere. Dette kan forklare den invasive adfærd af disse IDH1 -muterede glioblastom.
Ionkanaler
Endvidere udviser GBM talrige ændringer i gener, der koder for ionkanaler, herunder opregulering af gBK-kaliumkanaler og ClC-3-chloridkanaler. Ved opregulering disse ionkanaler, er glioblastoma tumorceller hypotese, at lette øget ion bevægelse over cellemembranen, og derved øge H 2 O bevægelse gennem osmose, som hjælper glioblastomaceller i ændre cellulær volumen meget hurtigt. Dette er nyttigt i deres ekstremt aggressive invasive adfærd, fordi hurtige tilpasninger i mobilvolumen kan lette bevægelse gennem hjernens sinuøse ekstracellulære matrix.
MicroRNA
Fra 2012 var RNA -interferens, sædvanligvis mikroRNA, under undersøgelse i vævskultur, patologiprøver og prækliniske dyremodeller af glioblastom. Desuden tyder eksperimentelle observationer på, at microRNA-451 er en nøgleregulator for LKB1/AMPK-signalering i dyrkede gliomaceller, og at miRNA-klynge styrer epigenetiske veje i sygdommen.
Tumor vaskulatur
GBM er kendetegnet ved unormale fartøjer, der viser forstyrret morfologi og funktionalitet. Den høje permeabilitet og dårlige perfusion af vaskulaturen resulterer i en uorganiseret blodgennemstrømning i tumoren og kan føre til øget hypoxi, hvilket igen letter kræftfremgang ved at fremme processer som immunsuppression.
Diagnose

Når det ses med MR, fremstår glioblastomer ofte som ringforstærkende læsioner. Udseendet er imidlertid ikke specifikt, da andre læsioner såsom abscess , metastase , tumefaktiv multipel sklerose og andre enheder kan have et lignende udseende. Definitiv diagnose af en formodet GBM på CT eller MR kræver en stereotaktisk biopsi eller en kraniotomi med tumorresektion og patologisk bekræftelse. Fordi tumorkvaliteten er baseret på den mest ondartede del af tumoren, kan biopsi eller subtotal tumorresektion resultere i undergradering af læsionen. Billeddannelse af tumorblodstrøm ved hjælp af perfusions -MR og måling af tumormetabolitkoncentration med MR -spektroskopi kan tilføje diagnostisk værdi til standard -MR i udvalgte tilfælde ved at vise henholdsvis øget relativ cerebralt blodvolumen og øget cholin -top, men patologi forbliver guldstandarden for diagnose og molekylær karakterisering.
Det er vigtigt at skelne mellem primært glioblastom og sekundært glioblastom. Disse tumorer opstår spontant ( de novo ) eller er udviklet sig fra et henholdsvis gliom af lavere kvalitet. Primære glioblastomer har en dårligere prognose og forskellig tumorbiologi og kan have en anden reaktion på terapi, hvilket gør dette til en kritisk vurdering for at bestemme patientprognose og terapi. Over 80% af sekundære glioblastomer bærer en mutation i IDH1 , hvorimod denne mutation er sjælden ved primært glioblastom (5-10%). Således er IDH1 -mutationer et nyttigt værktøj til at skelne mellem primære og sekundære glioblastomer, da histopatologisk er de meget ens, og sondringen uden molekylære biomarkører er upålidelig.
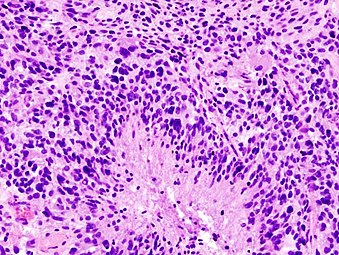
Histopatologi af glioblastom, der viser højkvalitets astrocytomtræk ved markant nuklear pleomorfisme, flere mitoser (en ved hvid pil) og flerkernede celler (en ved sort pil), med celler med et mønsterløst arrangement i en lyserød fibrillær baggrund på H & E -plet.
Lavere forstørrelseshistopatologi, der viser nekrose omgivet af pseudopalisader af tumorceller, hvilket giver diagnosen glioblastom frem for anaplastisk astrocytom .
Forebyggelse
Der er ingen kendte metoder til at forhindre glioblastom. Det er tilfældet for de fleste gliomer, i modsætning til nogle andre former for kræft, at de sker uden forudgående advarsel, og der er ingen kendte måder at forhindre dem på.
Behandling
Behandling af glioblastom er vanskelig på grund af flere komplicerende faktorer:
- Tumorcellerne er resistente over for konventionelle behandlinger.
- Hjernen er modtagelig for skader fra konventionel terapi.
- Hjernen har en begrænset kapacitet til at reparere sig selv.
- Mange lægemidler kan ikke krydse blod -hjerne -barrieren for at virke på tumoren.
Behandling af primære hjernetumorer består af palliativ (symptomatisk) pleje og terapier, der har til formål at forbedre overlevelsen.
Symptomatisk terapi
Støttende behandling fokuserer på at lindre symptomer og forbedre patientens neurologiske funktion. De primære understøttende midler er antikonvulsiva og kortikosteroider .
- Historisk set gennemgik omkring 90% af patienterne med glioblastom antikonvulsiv behandling, selvom kun anslået 40% af patienterne havde brug for denne behandling. For nylig er neurokirurger blevet anbefalet, at antikonvulsiva ikke administreres profylaktisk og bør vente, indtil der opstår et anfald, før denne medicin ordineres. Dem, der modtager phenytoin samtidig med stråling, kan have alvorlige hudreaktioner såsom erythema multiforme og Stevens -Johnsons syndrom .
- Kortikosteroider, sædvanligvis dexamethason , kan reducere peritumoral ødem (gennem omlægning af blod -hjerne -barrieren), reducere masseeffekten og sænke intrakranielt tryk med et fald i hovedpine eller døsighed.
Kirurgi
Kirurgi er den første fase af behandlingen af glioblastom. En gennemsnitlig GBM -tumor indeholder 10 11 celler, som i gennemsnit reduceres til 10 9 celler efter operationen (en reduktion på 99%). Fordelene ved kirurgi omfatter resektion til en patologisk diagnose, lindring af symptomer relateret til masseeffekt og potentielt fjernelse af sygdom, før der opstår sekundær resistens over for strålebehandling og kemoterapi.
Jo større omfang af tumorfjernelse, desto bedre. I retrospektive analyser har fjernelse af 98% eller mere af tumoren været forbundet med en betydeligt længere sundere tid, end hvis mindre end 98% af tumoren fjernes. Chancerne for næsten fuldstændig initial fjernelse af tumoren kan øges, hvis operationen styres af et fluorescerende farvestof kendt som 5-aminolevulinsyre . GBM -celler er meget infiltrative gennem hjernen ved diagnosen, så på trods af en "total resektion" af alle tydelige tumorer udvikler de fleste mennesker med GBM senere tilbagevendende tumorer enten nær det oprindelige sted eller på fjernere steder i hjernen. Andre metoder, typisk stråling og kemoterapi, bruges efter operationen i et forsøg på at undertrykke og bremse tilbagevendende sygdom.
Strålebehandling
Efter operationen bliver strålebehandling grundlaget for behandlingen af mennesker med glioblastom. Det udføres typisk sammen med at give temozolomid . Et centralt klinisk forsøg foretaget i begyndelsen af 1970'erne viste, at blandt 303 GBM -patienter, der blev randomiseret til stråle- eller strålebehandling, havde de, der modtog stråling, en median overlevelse mere end det dobbelte af dem, der ikke gjorde det. Efterfølgende klinisk forskning har forsøgt at bygge på rygraden i kirurgi efterfulgt af stråling. I gennemsnit kan strålebehandling efter operation reducere tumorstørrelsen til 10 7 celler. Hele hjernestrålebehandling forbedres ikke i forhold til den mere præcise og målrettede tredimensionelle konforme strålebehandling. En total stråledosis på 60–65 Gy har vist sig at være optimal til behandling.
GBM -tumorer er velkendte for at indeholde zoner af væv, der udviser hypoxi , som er yderst resistente over for strålebehandling. Forskellige tilgange til kemoterapi radiosensibilisatorer er blevet forfulgt med begrænset succes fra 2016. Fra og med 2010 omfattede nyere forskningsmetoder prækliniske og kliniske undersøgelser af brugen af en oxygendiffusionsforstærkende forbindelse, såsom transnatriumcrocetinat som radiosensibiliserende midler , og fra 2015 en kliniske forsøg var i gang. Borneutronfangstbehandling er blevet testet som en alternativ behandling for glioblastom, men er ikke i almindelig brug.
Kemoterapi
De fleste undersøgelser viser ingen fordel ved tilføjelse af kemoterapi. Et stort klinisk forsøg med 575 deltagere randomiseret til standardstråling kontra stråling plus temozolomid -kemoterapi viste imidlertid, at gruppen, der modtog temozolomid, overlevede en median på 14,6 måneder i modsætning til 12,1 måneder for gruppen, der modtog stråling alene. Dette behandlingsregime er nu standard for de fleste tilfælde af glioblastom, hvor personen ikke er indskrevet i et klinisk forsøg . Temozolomid ser ud til at virke ved at sensitivere tumorcellerne for stråling og fremstår mere effektivt for tumorer med MGMT -promotormethylering. Høje doser temozolomid i gliomer af høj kvalitet giver lav toksicitet, men resultaterne kan sammenlignes med standarddoserne. Antiangiogen behandling med medicin såsom bevacizumab -kontrol symptomer, men ser ikke ud til at påvirke den samlede overlevelse hos dem med glioblastom. Den samlede fordel ved antiangiogene behandlinger fra 2019 er uklar. Hos ældre med nydiagnosticeret glioblastom, der er rimeligt passende, giver samtidig og adjuverende kemoradioterapi den bedste samlede overlevelse, men er forbundet med en større risiko for hæmatologiske bivirkninger end strålebehandling alene.
Cannabinoider
Effekten af cannabinoider (cannabisderivater) er kendt inden for onkologi (gennem kapsler af tetrahydrocannabinol (THC) eller den syntetiske analoge nabilon) på den ene side til bekæmpelse af kvalme og opkastning forårsaget af kemoterapi, på den anden side for at stimulere appetitten og mindske sansen angst eller den egentlige smerte. Deres evne til at hæmme vækst og angiogenese i maligne gliomer i musemodeller er blevet påvist. Resultaterne af en pilotundersøgelse om brugen af THC hos patienter i slutstadiet med tilbagevendende glioblastom syntes værdige til yderligere undersøgelser. En mulig vej til fremtidig forskning hviler på opdagelsen af, at cannabinoider er i stand til at angribe de neoplastiske stamceller af glioblastom i musemodeller, med resultatet på den ene side at inducere deres differentiering til mere modne, muligvis mere "behandlingsbare" celler og videre den anden side for at hæmme tumorigenese.
Andre procedurer
Skiftende elektrisk feltterapi er en FDA-godkendt behandling for nydiagnosticeret og tilbagevendende glioblastom. I 2015 rapporterede indledende resultater fra et randomiseret fase-tre klinisk forsøg med vekslende elektrisk feltterapi plus temozolomid ved nydiagnosticeret glioblastom en tre måneders forbedring i progressionsfri overlevelse og en fem måneders forbedring i den samlede overlevelse sammenlignet med temozolomidbehandling alene , der repræsenterer det første store forsøg i et årti for at vise en overlevelse forbedring i denne indstilling. På trods af disse resultater er effektiviteten af denne fremgangsmåde fortsat kontroversiel blandt medicinske eksperter. Imidlertid kan en stigende forståelse af det mekanistiske grundlag, hvorved vekslende elektrisk feltterapi udøver kræftbekæmpende virkninger og resultater fra igangværende fase 3-kliniske forsøg med ekstrakranial kræft, hjælpe med at lette øget klinisk accept til behandling af glioblastom i fremtiden.
En undersøgelse fra Tel Aviv University viste, at farmakologisk og molekylær inhibering af P-selectin- proteinet fører til reduceret tumorvækst og øget overlevelse i musemodeller af glioblastom. Resultaterne af denne forskning kan åbne for mulige behandlinger med lægemidler, der hæmmer dette protein, såsom crizanlizumab .
Prognose
Den mest almindelige overlevelseslængde efter diagnosen er 12 til 15 måneder, hvor færre end 3 til 7% af mennesker overlever længere end fem år. I USA mellem 2012 og 2016 var den femårige overlevelse 6,8%. Uden behandling er overlevelse typisk 3 måneder. Komplette helbredelser er ekstremt sjældne, men er blevet rapporteret. Der er i øjeblikket et individ i USA, der har levet med sygdommen i mere end 20 år.
Stigende alder (> 60 år) medfører en værre prognostisk risiko. Døden skyldes normalt udbredt tumorinfiltration med cerebralt ødem og øget intrakranielt tryk .
En god indledende Karnofsky performance score (KPS) og MGMT methylering er forbundet med længere overlevelse. En DNA -test kan udføres på glioblastomer for at bestemme, om promotoren for MGMT -genet er methyleret eller ej . Patienter med en methyleret MGMT -promotor har længere overlevelse end patienter med en umethyleret MGMT -promotor, blandt andet på grund af øget følsomhed over for temozolomid. En anden positiv prognostisk markør for glioblastompatienter er mutation af IDH1- genet, som kan testes ved hjælp af DNA-baserede metoder eller ved immunhistokemi ved hjælp af et antistof mod den mest almindelige mutation, nemlig IDH1-R132H.
Mere prognostisk effekt kan opnås ved at kombinere IDH1 's mutationsstatus og methyleringsstatus for MGMT til en togeners forudsigelse. Patienter med både IDH1 -mutationer og MGMT -methylering har den længste overlevelse, patienter med en IDH1 -mutation eller MGMT -methylering en mellemliggende overlevelse, og patienter uden nogen af de genetiske hændelser har den korteste overlevelse.
Langsigtede fordele har også været forbundet med de patienter, der modtager kirurgi, strålebehandling og temozolomid kemoterapi. Meget er imidlertid stadig ukendt om, hvorfor nogle patienter overlever længere med glioblastom. Alder under 50 er forbundet med længere overlevelse i GBM, ligesom 98%+ resektion og brug af temozolomid kemoterapi og bedre KPS'er. En nylig undersøgelse bekræfter, at yngre alder er forbundet med en meget bedre prognose, idet en lille brøkdel af patienter under 40 år opnår en populationsbaseret kur. Kure menes at opstå, når en persons risiko for død vender tilbage til den normale befolknings, og i GBM menes dette at forekomme efter 10 år.
UCLA Neuro-onkologi offentliggør realtids-overlevelsesdata for patienter med denne diagnose.
Ifølge en undersøgelse fra 2003 kan GBM -prognosen opdeles i tre undergrupper afhængigt af KPS, patientens alder og behandling.
| Rekursiv partitioneringsanalyse (RPA) klasse |
Definition | Historisk median overlevelsestid | Historisk 1-årig overlevelse | Historisk 3-årig overlevelse | Historisk 5-årig overlevelse |
|---|---|---|---|---|---|
| III | Alder <50, KPS ≥ 90 | 17,1 måneder | 70% | 20% | 14% |
| IV | Alder <50, KPS <90 | 11,2 måneder | 46% | 7% | 4% |
| Alder ≥ 50, KPS ≥ 70, kirurgisk fjernelse med god neurologisk funktion | |||||
| V + VI | Alder ≥ 50, KPS ≥ 70, kirurgisk fjernelse med dårlig neurologisk funktion | 7,5 måneder | 28% | 1% | 0% |
| Alder ≥ 50, KPS ≥ 70, ingen kirurgisk fjernelse | |||||
| Alder ≥ 50, KPS <70 |
Epidemiologi
Omkring tre pr. 100.000 mennesker udvikler sygdommen om året, selvom regional frekvens kan være meget højere. Hyppigheden i England er fordoblet mellem 1995 og 2015.
Det er den næsthyppigste kræft i centralnervesystemet efter meningiom . Det forekommer hyppigere hos mænd end kvinder. Selvom gennemsnitsalderen ved diagnosen er 64 år, var den brede kategori af kræft i hjernen i 2014 kun anden efter leukæmi hos mennesker i USA under 20 år.
Historie
Udtrykket glioblastoma multiforme blev introduceret i 1926 af Percival Bailey og Harvey Cushing , baseret på ideen om, at tumoren stammer fra primitive forstadier til gliaceller ( glioblaster ) og det meget varierende udseende på grund af tilstedeværelsen af nekrose, blødning og cyster ( multiform).
Forskning
Genterapi
Genterapi er blevet undersøgt som en metode til behandling af glioblastom, og mens dyremodeller og kliniske forsøg i tidlig fase har været vellykkede, havde 2017 alle genterapilægemidler, der var blevet testet i kliniske fase III-forsøg for glioblastom, mislykkedes. Forskere har udviklet core -shell nanostrukturerede LPLNP -PPT til effektiv genlevering og sporing med positive resultater. Dette er en TRAIL -ligand, der er blevet kodet til at inducere apoptose af kræftceller, mere specifikt glioblastomer. Selvom denne undersøgelse stadig er i kliniske forsøg, har den vist diagnostiske og terapeutiske funktionaliteter og vil åbne store interesser for kliniske anvendelser inden for stamcellebaseret terapi.
Onkolytisk viroterapi
Oncolytisk viroterapi er en ny behandling, der er under opsejling, både på prækliniske og kliniske stadier. Adskillige vira, herunder herpes simplex -virus, adenovirus, poliovirus og reovirus, testes i øjeblikket i fase I og II af kliniske forsøg med glioblastombehandling og har vist sig at forbedre den samlede overlevelse.
Intranasal lægemiddellevering
Direkte lægemiddellevering fra næse til hjerne undersøges som et middel til at opnå højere og forhåbentlig mere effektive lægemiddelkoncentrationer i hjernen. Et klinisk fase I/II -studie med glioblastompatienter i Brasilien undersøgte den naturlige forbindelse perillylalkohol til intranasal levering som aerosol . Resultaterne var opmuntrende, og fra 2016 er et lignende forsøg blevet indledt i USA.
Se også
Referencer
eksterne links
| Klassifikation | |
|---|---|
| Eksterne ressourcer |
- Information om Glioblastoma Multiforme (GBM) fra American Brain Tumor Association
- AFIP -kursusplan - Astrocytoma WHO -gradueringsforedrag