Lesch – Nyhan syndrom - Lesch–Nyhan syndrome
| Lesch – Nyhan syndrom | |
|---|---|
| Andre navne | Ung gigt, Primært hyperuricæmi syndrom, Choreoathetosis self-mutilation syndrom, X-forbundet primær hyperuricæmi, HGPRT-mangel |
| Specialitet |
Endokrinologi |
| Symptomer | selvskade , dystoni , chorea , rumlighed, intellektuel funktionsnedsættelse , hyperuricæmi , |
| Komplikationer | nyresvigt , megaloblastisk anæmi |
| Differential diagnose | cerebral parese , dystoni , Cornelia de Lange syndrom , autisme , famillial dysautonomi, Tourettes syndrom |
| Frekvens | 1 ud af 380.000 |
Lesch – Nyhan syndrom ( LNS ) er en sjælden arvelig lidelse forårsaget af mangel på enzymet hypoxanthin-guanin phosphoribosyltransferase (HGPRT). Denne mangel opstår på grund af mutationer i HPRT1 -genet placeret på X -kromosomet . LNS påvirker omkring 1 ud af 380.000 levendefødte. Lidelsen blev først anerkendt og klinisk karakteriseret af den amerikanske medicinstuderende Michael Lesch og hans mentor, børnelæge William Nyhan , på Johns Hopkins .
HGPRT-manglen forårsager en ophobning af urinsyre i alle kropsvæsker. Kombinationen af øget syntese og nedsat udnyttelse af puriner fører til høje niveauer af urinsyreproduktion. Dette resulterer i både høje niveauer af urinsyre i blodet og urinen , forbundet med alvorlig gigt og nyreproblemer. Neurologiske tegn omfatter dårlig muskelkontrol og moderat intellektuel funktionsnedsættelse . Disse komplikationer forekommer normalt i det første leveår. Begyndende i det andet leveår er et særligt slående træk ved LNS selvlempende adfærd, karakteriseret ved læbe- og fingerbid. Neurologiske symptomer omfatter ansigtsgrimasser, ufrivillig vridning og gentagne bevægelser af arme og ben svarende til dem, der ses ved Huntingtons sygdom . Den årsag til de neurologiske abnormiteter er fortsat ukendt. Fordi mangel på HGPRT får kroppen til at udnytte vitamin B 12 dårligt , kan nogle mænd udvikle megaloblastisk anæmi .
LNS arves på en X-forbundet recessiv måde; genmutationen bæres normalt af moderen og videregives til hendes søn, selvom en tredjedel af alle tilfælde opstår de novo (fra nye mutationer) og ikke har en familiehistorie. LNS er til stede ved fødslen hos baby drenge. De fleste, men ikke alle, personer med denne mangel har alvorlige psykiske og fysiske problemer gennem livet. Tilfælde hos kvinder er meget sjældne.
Symptomerne forårsaget af ophobning af urinsyre ( gigt og nyresymptomer ) reagerer godt på behandling med medicin som allopurinol, der reducerer urinsyreniveauet i blodet. De psykiske underskud og selvskadende adfærd reagerer ikke godt på behandlingen. Der er ingen kur, men mange berørte mennesker lever til voksenalderen. Flere nye eksperimentelle behandlinger kan lindre symptomer.
tegn og symptomer
LNS er kendetegnet ved tre store kendetegn: neurologisk dysfunktion, kognitive og adfærdsmæssige forstyrrelser, herunder selvlemlæstelse og urinsyreoverproduktion ( hyperuricæmi ). Skader på de basale ganglier får syge til at indtage en karakteristisk hegnestilling på grund af læsionens art. Nogle kan også være ramt af makrocytisk anæmi på grund af den defekte DNA -syntese, sandsynligvis på grund af mangelfuld purinsyntese, der fører til et forsinket celledeling med hensyn til stigninger i cellemasse. Stort set alle patienter er mænd; mænd lider forsinket vækst og pubertet , og de fleste udvikler krympede testikler eller testikelatrofi . Kvindelige bærere har en øget risiko for urinsyregigt, men er normalt ellers upåvirket.
Overproduktion af urinsyre
Et af de første symptomer på sygdommen er tilstedeværelsen af sandlignende krystaller af urinsyre i bleerne på det berørte spædbarn. Overproduktion af urinsyre kan føre til udvikling af urinsyrekrystaller eller sten i nyrerne , urinlederne eller blæren . Sådanne krystaller deponeret i leddene senere i sygdomsforløbet kan frembringe gigt -lignende arthritis , med hævelse og ømhed. Overproduktionen af urinsyre er til stede ved fødslen, men genkendes muligvis ikke ved rutinemæssige kliniske laboratorietestmetoder. Serumkoncentrationen af urinsyre er ofte normal, da overskydende puriner straks elimineres i urinen. Krystallerne fremstår normalt som et orange kornet materiale, eller de kan samles for at danne enten flere små sten eller tydelige store sten, der er vanskelige at passere. Stenene eller calculi forårsager normalt hæmaturi (blod i urinen) og øger risikoen for urinvejsinfektion . Nogle ofre lider nyreskade på grund af sådanne nyresten . Sten kan være det nuværende træk ved sygdommen, men kan forblive uopdaget i måneder eller endda år.
Nervesystemet svækket
Perioderne før og omkring fødslen er typisk normale hos personer med LNS. De mest almindelige egenskaber ved præsentation er unormalt nedsat muskeltonus ( hypotoni ) og udviklingsforsinkelse, som er tydelige ved en alder på tre til seks måneder. Berørte personer sidder sent på at sidde op, mens de fleste aldrig kravler eller går . Mangel på talen er også en meget fælles træk i forbindelse med LNS.
Irritabilitet bemærkes oftest sammen med de første tegn på nedsat nervesystem. Inden for de første leveår forårsager ekstrapyramidal involvering unormale ufrivillige muskelsammentrækninger såsom tab af motorisk kontrol ( dystoni ), vridende bevægelser ( choreoathetosis ) og buet i rygsøjlen ( opisthotonus ). Tegn på pyramideformet systeminddragelse , herunder spasticitet, overaktive reflekser ( hyperrefleksi ) og extensor plantarreflekser , forekommer også. Ligheden med athetoid cerebral parese er tydelig i de neurologiske aspekter af LNS. Som et resultat diagnosticeres de fleste individer i første omgang med at have cerebral parese. Det motoriske handicap er så omfattende, at de fleste mennesker aldrig går og bliver livslange kørestolsbrugere.
Selvskadende adfærd
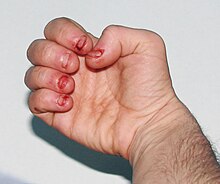
De berørte personer er kognitivt svækkede og har adfærdsforstyrrelser, der opstår mellem to og tre år. Den ukontrollerbare selvskade forbundet med LNS begynder normalt også ved tre års alder. Selvskaden begynder med bid af læber og tunge; efterhånden som sygdommen skrider frem, udvikler de berørte personer ofte fingerbidning og hovedstød. Selvskaden kan stige i perioder med stress. Selvskade er et kendetegn ved sygdommen og er tydeligt hos 85% af de ramte mænd.
Størstedelen af individer er kognitivt nedsat, hvilket nogle gange er svært at skelne fra andre symptomer på grund af de adfærdsforstyrrelser og motoriske underskud, der er forbundet med syndromet. På mange måder kan adfærden ses som en psykologisk forlængelse af tvang til at forårsage selvskade og omfatter afvisning af ønskede godbidder eller rejser, tilbagebetaling af venlighed med koldhed eller raseri, manglende besvarelse af testspørgsmål korrekt på trods af studier og et ønske om at lykkes , fremkalder vrede fra omsorgspersoner, når kærlighed ønskes.
Tvangsadfærd forekommer også, herunder aggressivitet, opkastning , spyt og coprolalia (ufrivillig bande). Udviklingen af denne type adfærd ses nogle gange inden for det første år eller i den tidlige barndom, men andre udvikler den måske først senere i livet.
LNS hos kvinder
Mens bærerhunner generelt er en asymptomatisk tilstand , oplever de en stigning i urinsyreudskillelse, og nogle kan udvikle symptomer på hyperuricæmi og lider af gigt i de senere år. Test i denne sammenhæng har ingen klinisk konsekvens, men det kan afsløre muligheden for at overføre egenskaben til mandlige børn. Kvinder kan også kræve test, hvis et mandligt barn udvikler LNS. I dette tilfælde betyder en negativ test, at sønnens sygdom er resultatet af en ny mutation, og risikoen for søskende øges ikke.
Kvinder, der bærer en kopi af det defekte gen, er bærere med en 50% chance for at overføre sygdommen til deres sønner. For at en kvinde skulle blive påvirket, skulle hun have to kopier af det muterede gen, hvoraf den ene skulle være arvet fra hendes far. Hanner, der er ramt af LNS, får normalt ikke børn på grund af sygdommens invaliderende virkninger. Det er muligt for en kvinde at arve et X -kromosom fra sin upåvirkede far, der bærer en ny mutation af HGPRT -genet. Under disse omstændigheder kan en pige blive født med LNS, og selvom der er få rapporter om, at dette er sket, er det meget sjældent. Det overvældende flertal af patienter med LNS er mænd.
Mindre alvorlige former
En mindre alvorlig, beslægtet sygdom, delvis HPRT -mangel, er kendt som Kelley -Seegmiller syndrom (Lesch – Nyhan syndrom involverer total HPRT -mangel). Symptomer involverer generelt mindre neurologisk involvering, men sygdommen forårsager stadig gigt og nyresten.
Genetik

LNS skyldes mutationer i HPRT1- genet , så navngivet, fordi det koder for enzymet hypoxanthin-guaninphosphoribosyltransferase (HPRT eller HGPRT, EC 2.4.2.8 ). Dette enzym er involveret i de biokemiske veje, kroppen bruger til at producere puriner , en af komponenterne i DNA og RNA . Defekter af dette enzym fører til øget produktion af urinsyre . Da HPRT- genet er placeret på X-kromosomet , er LNS en X-forbundet arvelig sygdom.
Faderen til en ramt mand vil ikke være bærer af den mutante allel og vil ikke have sygdommen. En obligatorisk transportør ville være en kvinde, der har en ramt søn og en anden berørt slægtning i moderlinjen.
Hvis en kvinde er den første i sin familie med en ramt søn, forudsiger Haldanes regel en 2/3 chance for, at hun er bærer og 1/3 chance for, at sønnen har en ny kønscellemutation .
Risikoen for søskende til en berørt person afhænger af moderens bærerstatus. En 50% chance gives til enhver kvinde, der er bærer til at overføre HPRT1 -mutationen i hver graviditet . Sønner, der arver mutationen, vil blive påvirket, mens døtre, der arver mutationen, er bærere. Derfor har en bærerkvinde for hver graviditet en 25% chance for at få en han, der er påvirket, en 25% chance for at have en hun, der er en bærer, og en 50% chance for at have en normal han eller kvinde.
Hanner med LNS formerer sig ikke på grund af sygdommens egenskaber. Men hvis en mand med en mindre alvorlig fænotype formerer sig, er alle hans døtre bærere, og ingen af hans sønner vil blive påvirket.
Patofysiologi
Som ved andre X-koblede sygdomme påvirkes hanner, fordi de kun har en kopi af X-kromosomet. I Lesch-Nyhan syndrom, det defekte gen er, at for hypoxanthin-guanin phosphoribosyltransferase (HPRT), deltager i 'genbrug' af purin nukleotider . Kvindelige bærere har et andet X -kromosom, som indeholder en "normal" kopi af HPRT, der forhindrer sygdommen i at udvikle sig, selvom de kan have øget risiko for hyperuricæmi.
Et stort antal mutationer af HPRT kendes. Mutationer, der kun mildt nedsætter enzymets funktion, forårsager normalt ikke den alvorlige form for LNS, men producerer en mildere form for sygdommen, som stadig indeholder purinoverproduktion ledsaget af modtagelighed for urinsyregigt og urinsyre -nefrolithiasis .
Dannelse af DNA (under celledeling ) kræver nukleotider , molekyler, der er byggestenene til DNA. Purinbaserne ( adenin og guanin ) og pyrimidinbaser ( thymin og cytosin ) er bundet til deoxyribose og phosphat og inkorporeret efter behov. Normalt syntetiseres nukleotiderne de novo fra aminosyrer og andre forstadier. En lille del er imidlertid 'genbrugt' fra nedbrudt DNA fra nedbrudte celler. Dette kaldes "bjærgningsvejen".
HGPRT er "bjærgningsenzymet" for purinerne: det kanaliserer hypoxanthin og guanin tilbage til DNA -syntese. Svigt af dette enzym har to resultater:
- Produkter til nedbrydning af celler kan ikke genbruges og nedbrydes derfor. Dette giver anledning til øget urinsyre , et purinnedbrydningsprodukt.
- De novo- vejen stimuleres på grund af et overskud af PRPP (5-phospho-D-ribosyl-1-pyrophosphat eller simpelthen phosphoribosyl-pyrophosphat).
Det var tidligere uklart, om de neurologiske abnormaliteter i LMS skyldtes urinsyre neurotoksicitet eller til en relativ mangel på "nye" purin nukleotider under essentielle syntesetrin. Genetiske mutationer, der påvirker enzymerne i de novo -syntesevejen, kan muligvis bidrage til sygdommen, selvom disse er sjældne eller ukendte. Urinsyre er blevet foreslået som en mulig årsag til neurotoksicitet, men dette er ikke bevist.
Vigtigere tyder beviser på, at en eller flere læsioner i striatale dopaminerge veje kan være centrale for de neurologiske underskud, især den koreoathetoid dyskinesi og selvlemlæstelse. 6-hydroxydopamintoksicitet hos gnavere kan være en nyttig dyremodel for syndromet, selvom dette ikke er bevist. Forbindelsen mellem dopamin og purinsyntese er imidlertid et nukleotid kaldet guanosintrifosfat eller 'GTP'. Det første trin i dopaminsyntese er GTP -cyclohydrolase , og en betydelig mangel på dette trin frembringer et syndrom, der har en neuropatologi, der ligner LNS. Således kan mangel på HGPRT forårsage en nukleotidmangel (specifikt: GTP -mangel) lidelse, hvilket resulterer i dopaminmangel.
En anden dyremodel for LNS er blevet foreslået at skyldes oxidativ skade forårsaget af hyperuricæmi, der ledsager LNS. Dette er baseret på teorien om, at urinsyre er et kraftfuldt reduktionsmiddel og sandsynligvis en vigtig menneskelig antioxidant i høj koncentration i blod. Det er således blevet foreslået, at frie radikaler , oxidativ stress og reaktive iltarter kan spille en rolle i neuropatologien for LNS.
Nogle beviser tyder imidlertid på, at urinsyre ikke spiller en rolle i neuropatologien for Lesch – Nyhan syndrom:
- Hyperurikæmi forbundet med klassisk primær gigt , som er forårsaget af lav urinsyre renal clearance frem for urinsyre overproduktion, er ikke forbundet med neuropatologi.
- Hypouricæmi forekommer ved en række purinforstyrrelser , især xanthinuri . På trods af fuldstændigt fravær af urinsyre i blodet har xanthinuri -patienter ikke nogen neuropatologi eller andre sygdomstilstande - bortset fra nyresten forårsaget af ophobning af uopløseligt xanthin i stedet for urinsyre.
På samme måde trænger urinsyre ikke godt ind i blod -hjerne -barrieren. Imidlertid menes det nu, at oxidativt stress på grund af urinsyre spiller ind i metabolisk syndrom , åreforkalkning og slagtilfælde , alle syndromer forbundet med høje urinsyreniveauer. På samme måde forbedrer Superoxiddismutase ("SOD") og SOD-mimetika såsom TEMPOL virkningerne af hyperuricæmi. På samme måde fungerer 6-hydroxydopamin (den formodede dyremodel for Lesch – Nyhans neuropati) tilsyneladende som et neurotoksin ved dannelse af reaktive iltarter. Det kan være, at oxidativ stress forårsaget af andre oxypurin såsom xanthin forårsager sygdommen.
Diagnose
Når en berørt person fuldt ud har udviklet de tre kliniske elementer af urinsyreoverproduktion, neurologisk dysfunktion og kognitive og adfærdsforstyrrelser, stilles diagnosen LNS let. Diagnose er mindre let i de tidlige stadier, når de tre funktioner endnu ikke er indlysende. Tegn på selvskadende adfærd (SIB), resultater af stamtavleanalyse og ny molekylærbiologi med genetisk testning (kaldet Diagnostic triad for LNS), bekræfter ofte diagnosen. Mistanke opstår ofte, når individets udviklingsforsinkelse er forbundet med hyperuricæmi. Ellers skal diagnosen påstås, når udviklingsforsinkelse er forbundet med nyresten ( nephrolithiasis ) eller blod i urinen ( hæmaturi ) forårsaget af urinsyresten. For det meste mistænkes først Lesch – Nyhan syndrom, når selvforskyldt skadesadfærd udvikler sig. Imidlertid forekommer selvskadende adfærd i andre forhold, herunder ikke-specifik intellektuel handicap , autisme , Rett syndrom , Cornelia de Lange-syndrom , Tourettes syndrom , familiær dysautonomi , choreoacanthocytosis , sensorisk neuropati indbefatter arvelig sensorisk neuropati type 1, og adskillige psykiatriske tilstande. Af disse er det kun personer med Lesch – Nyhan syndrom, de Lange syndrom og familiedysautonomi, der tilbagevendende viser tab af væv som en konsekvens. At bide fingre og læber er et definitivt træk ved Lesch – Nyhan syndrom; i andre syndromer, der er forbundet med selvskade, består adfærden normalt af hovedstød og uspecifik selvskæring, men ikke bid af kinder, læber og fingre. Lesch – Nyhan syndrom bør klart overvejes kun, når selvskadende adfærd finder sted i forbindelse med hyperuricæmi og neurologisk dysfunktion.
Diagnostisk tilgang
Koncentratforholdet mellem urat og kreatinin (nedbrydningsprodukt af kreatinfosfat i muskler) i urinen er forhøjet. Dette er en god indikator for syreoverproduktion. For børn under ti år med LNS findes et forhold mellem urat og kreatinin over to typisk. 24-timers uratsekretion på mere end 20 mg/kg er også typisk, men er ikke diagnostisk . Hyperuricæmi (serum urinsyre koncentration på> 8 mg/dL) er ofte til stede, men ikke pålidelig nok til diagnose. HGPRT -enzymets aktivitet i celler fra enhver type væv (f.eks. Blod , dyrkede fibroblaster eller lymfoblaster ), der er mindre end 1,5% af normal enzymaktivitet, bekræfter diagnosen Lesch – Nyhan syndrom. Molekylære genetiske undersøgelser af HPRT-genmutationer kan bekræfte diagnosen og er særligt nyttige til efterfølgende 'bærertest' hos hunner med risiko som f.eks. Nære slægtninge på den kvindelige side.
Test
Brugen af biokemiske test til påvisning af bærere er teknisk krævende og bruges ikke ofte. Biokemiske analyser, der er blevet udført på hårløg fra udsatte kvinder, har haft et lille antal både falsk positive og falske negative resultater. Hvis kun en mistænkt bærerkvinde er tilgængelig til mutationstest, kan det være passende at dyrke sine lymfocytter i 6-thioguanin (en purinanalog ), hvilket kun tillader HGPRT-mangelfulde celler at overleve. En mutantfrekvens på 0,5–5,0 × 10 −2 findes hos bærerhunnerne, mens en ikke-bærende kvinde har en frekvens på 1–20 × 10 −6 . Denne frekvens er normalt diagnostisk i sig selv.
Molekylær genetisk test er den mest effektive testmetode, da HPRT1 er det eneste gen, der vides at være forbundet med LNS. Personer, der viser den fulde Lesch – Nyhan -fænotype, har alle mutationer i HPRT1 -genet. Sekvensanalyse af mRNA er tilgængelig klinisk og kan bruges til at påvise HPRT1 -mutationer hos mænd, der er ramt af Lesch – Nyhan syndrom. Teknikker som RT-PCR, multiplex genomisk PCR og sekvensanalyse (cDNA og genomisk DNA), der bruges til diagnosticering af genetiske sygdomme, udføres på forskningsbasis. Hvis RT-PCR-test resulterer i, at cDNA viser fravær af en hel exon eller exoner, udføres multiplex genomisk PCR-test. Multiplex genomisk PCR -test forstærker de ni exoner af HPRT1 -genet som otte PCR -produkter. Hvis den pågældende exon slettes, mangler det tilsvarende bånd i multiplex -PCR'en. Men hvis exon er til stede, sekventeres exon for at identificere mutationen, hvilket forårsager eksklusion af exon fra cDNA. Hvis der ikke skabes cDNA ved RT-PCR, udføres multiplex PCR på den forestilling, at det meste eller hele genet er udslettet.
Behandling
Behandling for LNS er symptomatisk. Gigt kan behandles med allopurinol for at kontrollere store mængder urinsyre . Nyresten kan behandles med lithotripsy , en teknik til at bryde nyresten ved hjælp af stødbølger eller laserstråler. Der er ingen standardbehandling for de neurologiske symptomer på LNS. Nogle kan blive lettet med stofferne carbidopa / levodopa , diazepam , phenobarbital eller haloperidol .
Det er vigtigt, at overproduktionen af urinsyre kontrolleres for at reducere risikoen for nefropati , nefrolithiasis og urinsyregigt. Lægemidlet allopurinol bruges til at stoppe omdannelsen af oxypuriner til urinsyre og forhindre udviklingen af efterfølgende artritisk tophi (produceret efter kronisk gigt), nyresten og nefropati , den resulterende nyresygdom. Allopurinol tages oralt i en typisk dosis på 3–20 mg/kg pr. Dag. Dosis justeres derefter for at bringe urinsyreniveauet ned i det normale område (<3 mg/dL). De fleste berørte personer kan behandles med allopurinol hele livet.
Ingen medicin er effektiv til at kontrollere sygdommens ekstrapyramidale motoriske træk. Spasticitet kan imidlertid reduceres ved administration af baclofen eller benzodiazepiner .
Der har tidligere ikke været nogen effektiv behandlingsmetode til sygdommens neurobehaviorale aspekter. Selv børn behandlet fra fødslen med allopurinol udvikler adfærdsmæssige og neurologiske problemer, selvom de aldrig har haft høje serumkoncentrationer af urinsyre. Selvskadende og anden adfærd styres bedst ved en kombination af medicinske, fysiske og adfærdsmæssige indgreb. Selvlemlæstelsen reduceres ofte ved hjælp af begrænsninger. 60 procent af individerne får deres tænder trukket ud for at undgå selvskade, hvilket familier har fundet at være en effektiv behandlingsteknik. Fordi stress øger selvskaden, øger adfærdsstyring gennem aversive teknikker (som normalt ville reducere selvskade) faktisk selvskade hos personer med LNS. Næsten alle berørte personer har brug for begrænsninger for at forhindre selvskade og er tilbageholdt mere end 75% af tiden. Dette er ofte på deres egen anmodning og involverer lejlighedsvis begrænsninger, der ser ud til at være ineffektive, da de ikke fysisk forhindrer bid. Familier rapporterer, at berørte personer er mere trygge, når de er tilbageholdt.
Matheny Medical and Educational Center [2] i Peapack, NJ, har seks patienter med Lesch – Nyhan syndrom, der menes at være den største koncentration af LNS -tilfælde ét sted, og er anerkendt som den førende kilde til information om plejespørgsmål.
Behandling af LNS -patienter, ifølge Gary E. Eddey, MD, medicinsk direktør, bør omfatte: 1) forsvarlig brug af beskyttelsesudstyr; 2) Udnyttelse af en adfærdsteknik, der normalt omtales som 'selektiv ignorering' med omdirigering af aktiviteter; og 3) lejlighedsvis brug af medicin.
En artikel i nummeret 13. august 2007 af magasinet The New Yorker , skrevet af Richard Preston , diskuterer " dyb hjernestimulering " som en mulig behandling. Det er blevet udført på et par patienter med Lesch – Nyhan syndrom af Dr. Takaomi Taira i Tokyo og af en gruppe i Frankrig under ledelse af Dr. Philippe Coubes. Nogle patienter oplevede et fald i spastiske selvskadende symptomer. Teknikken blev udviklet til behandling af mennesker med Parkinsons sygdom , ifølge Preston for over 20 år siden. Behandlingen indebærer invasiv kirurgi for at placere ledninger, der bærer en kontinuerlig elektrisk strøm ind i et bestemt område af hjernen.
Et opmuntrende fremskridt i behandlingen af de neurobehaviourale aspekter af LNS var offentliggørelsen i oktober 2006-udgaven af Journal of Inherited Metabolic Disease af en eksperimentel terapi, der gav oral S-adenosyl-methionin (SAMe). Dette lægemiddel er en nukleotidforløber , der giver et let absorberet purin, som vides at blive transporteret over blod -hjerne -barrieren . Administration af SAMe til voksne LNS -patienter viste sig at give forbedring i neurobehavioural og andre neurologiske egenskaber. Lægemidlet er tilgængeligt uden recept og har været meget udbredt til depression , men dets anvendelse til behandling af LNS bør kun foretages under strengt lægeligt tilsyn, da bivirkninger er kendt.
Prognose
Prognosen for personer med svær LNS er dårlig. Døden skyldes normalt nyresvigt eller komplikationer fra hypotoni i det første eller andet årti af livet. Mindre alvorlige former har bedre prognoser.
Historie
Michael Lesch var lægeelev på Johns Hopkins og William Nyhan , børnelæge og biokemisk genetiker, var hans mentor, da de to identificerede LNS og dets tilhørende hyperuricæmi hos to berørte brødre i alderen 4 og 8. Lesch og Nyhan offentliggjorde deres fund i 1964. Inden for tre år blev den metaboliske årsag identificeret af J. Edwin Seegmiller og hans kolleger på NIH .
Referencer
eksterne links
- Lesch-Nyhan syndrom på NIHs kontor for sjældne sygdomme
- GeneReview/NIH/UW -post om Lesch – Nyhan syndrom
- National Institute of Child Health and Human Development (NICHD)
| Klassifikation | |
|---|---|
| Eksterne ressourcer |

